Циклічний аденозинмонофосфат
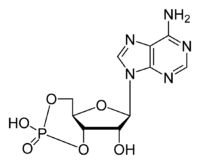
Циклічний аденозинмонофосфат (цАМФ, циклічний АМФ, 5'-3'-циклічний аденозинмоносфосфат) — універсальний вторинний посередник, що забезпечує підсилення клітинних сигналів, продукт циклізації АТФ під впливом ферменту аденілатциклази. Циклічний АМФ переважно діє шляхом активації серин/треонінової протеїнкінази А (цАМФ-залежної протеїнкінази, ПКА). Виконує сигнальну функцію у всіх основних груп організмів: еукаріот, еубактерій та архей.[1].
| Циклічний аденозинмонофосфат | |
|---|---|
 |
 |
| Ідентифікатори | |
| Номер CAS | 60-92-4 |
| PubChem | 6076 |
| Номер EINECS | 200-492-9 |
| DrugBank | DB02527 |
| KEGG | C00575 |
| Назва MeSH | Cyclic+AMP |
| ChEBI | 17489 |
| SMILES |
c1nc(c2c(n1)n(cn2)[C@H]3[C@@H]([C@H]4[C@H](O3)COP(=O)(O4)O)O)N |
| InChI |
1/C10H12N5O6P/c11-8-5-9(13-2-12-8)15(3-14-5)10-6(16)7-4(20-10)1-19-22(17,18)21-7/h2-4,6-7,10,16H,1H2,(H,17,18)(H2,11,12,13)/t4-,6-,7-,10-/m1/s1 |
| Номер Бельштейна | 52645 |
| Властивості | |
| Молекулярна формула | C10H12N5O6P |
| Молярна маса | 329,206 г/моль |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
Циклічний АМФ був відкритий групою Ерла Сазерленда 1957 року під час дослідження впливу адреналіну на глікогеноліз у печінці собаки, і став першою відомою речовиною із функціями вторинного посередника. 1971 року Сазерленд отримав Нобелівську премію «за відкриття пов'язані із механізмом дії гормонів». Виявлення цАМФ було частково наслідком щасливого випадку. У той час більшість експериментів із гормонами ссавців проводились на печінці пацюків. Під час розвитку цих тварин (на 6—60 день) знижується рівень β- та зростає рівень α1-адренергічних рецепторів, внаслідок чого в дорослих пацюків вторинним посередником у регуляції глікогенолізу виступає тільки кальцій, а не цАМФ[1].
Сазерленд встановив, що активація глікогенолізу відбувається в два етапи, на першому з них продукується термостабільний фактор, що може підлягати діалізу. Разом із АТФ він здатний викликати активацію глікогенфосфорилази. Дослідження спектру поглинання фактора в УФ ділянці, його реакції з орцинолом та визначення загальної кількості фосфатів дозволило встановити, що він складається з рибози, аденіну та залишку фосфорної кислоти у співвідношенні 1:1:1. Дослідники також виявили, що активність речовини різко падає після інкубування із екстрактами собачої печінки, мозку або серця[1].
Метаболізм
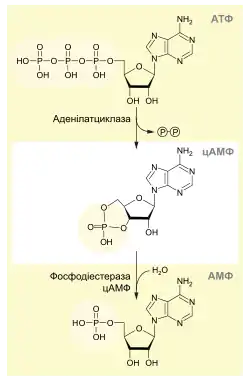
За нормальних умов концентрація цАМФ в цитозолі мізерна — близько 10−7 моль/л, проте у відповідь на зовнішньоклітинний сигнал вона може зрости більше як в 20 разів впродовж секунд[2], хоча зазвичай для максимального фізіологічного ефекту достатньо зростання в 2—3 рази[3].
Утворення цАМФ каталізує мембранний фермент аденілатциклаза, субстратом для якого є АТФ:
- АТФ → 5'-3'-цАМФ + ФФн;
У ссавців існує як мінімум вісім ізоформ аденілатциклази, більшість з яких регулюється як G-білками (стимулюючі (Gs) активують їх, інгібуючі (Gi) — пригнічують) так і кальцієм[2].
Розщеплює цАМФ фосфодіестераза циклічних нуклеотидів — конститутивно активний фермент:
- 5'-3'-цАМФ → АМФ.
Функції
Циклічний аденозиномонофосфат найбільш відомий тією функцію, у зв'язку з вивченням якої його і відкрили, тобто як внутрішньоклітинний сигнал до розщеплення глікогену в печінці. Проте його роль в організмі ссавців цим не обмежується, цАМФ необхідний для реалізації дії багатьох гідрофільних гормонів, нейромедіаторів та інших первинних посередників, для функціонування сенсорних систем, зокрема нюхової, тощо[1][2].
Поширений також в інших еукароітичних організмів. Наприклад, є свідченння про те, що в рослин цАМФ регулює іонні канали. Відкривання калієвих каналів у листках Vicia faba залежить від активності протеїнкінази А, яка у свою чергу регулюється цАМФ. В багатьох простих еукаріот роль цАМФ пов'язана із відповіддю на голодування. Наприклад, він є сигналом росту в дріжджів: у випадку наявності достатньої кількості поживи в середовищі Ras-білки активують аденілатциклазу, внаслідок чого утворюється цАМФ, що стимулює клітини до поділу. В умовах нестачі їжі концентрація цАМФ падає і клітини дріжджів переходять до мейозу і утворення спор. Амебоподібні організми Dictyostelium discoideum за несприятливих умов виділяють у середовище цАМФ, що є для них для сигналом для агрегації і утворення плодового тіла[1].
Циклічний АМФ також присутній у прокаріот, як еубактерій так і архей, його функції різняться, проте також найчастіше мають стосунок до відповіді на наявність чи відсутність енергетичних субстратів в середовищі: наприклад в кишкової палички цАМФ синтезується при нестачі глюкози в середовищі, і стимулює експресію ферментів необхідних, для утилізації інших органічних речовин[1].
Стимуляція глікогенолізу
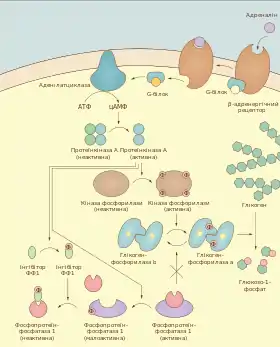
Гормон адреналін відповідає за реакцію організму «бийся або тікай» (англ. fight or flight), частиною якої є швидке збільшення рівня глюкози в крові внаслідок розщеплення глікогену клітинами печінки. Також адреналін запускає глікогеноліз у скелетних м'язах, проте у цьому випадку глюкоза не виділяється у кров, а використовується для отримання АТФ. На поверхні гепатоцитів і м'язових волокон адреналін зв'язується із β-адренорецепторами спряженими із тримерним Gs-білком. Внаслідок цього відбувається активація спочатку рецептора, а потім і G-білка, після чого α-субодиниця останнього стимулює фермент аденілатциклазу. Аденілатциклаза каталізує перетворення АТФ у цАМФ, а цей вторинний посередник далі активує протеїнкіназу А. ПКА — тетрамерний фермент, що забезпечує фосфорилювання білків по залишках серину та треоніну, він складається із двох каталітичних (C) та двох регуляторних (R) субодиниць. Останні мають у своєму складі так звану «псевдосусбстратну» послідовність амінокислот (Арг-Арг-Глі-Ала-Іле)[4], тобто схожу до тієї, по якій каталітичні субодиниці здійснюють фосфорилювання (Арг-Арг-Глі-Сер-Іле)[4]. Псевдосубстратна послідовність закриває активні центри C субодиниць, внаслідок чого фермент перебуває в інкативованому стані. R субодиниці також мають алостеричні сайти для зв'язування цАМФ, після приєднання цієї молекули вони змінюють свою конформацію і звільняють активні центри від псевдосубстрату. Активовані каталітичні субодиниці тепер можуть каталізувати фосфорилювання білка кінази фосфорилази, який у свою чергу приєднує фосфатний залишок до малоактивної гілкогенфосфорилази b, внаслідок чого та перетворюється в a форму та інтенсивно здійснює розщеплення глікогену з утворенням глюкозо-1-фосфату[5][2].
Впродовж майже всього каскаду реакцій відбувається постійне підсилення (ампліфікація) сигналу. Якщо вважати, що було активовано x рецепторів, то кількість молекул цАМФ становитиме 20x, кількість активованих молекул ПКА — 10x (для активації потрібно 2 цАМФ), кінази фосфорилази — 100x, глікогенфосфорилази — 1000x, а глюкози — 10 000x[5]. Таким чином проходить підсилення сигналу у 10 тис. раз і така невелика концетрація адреналіну в крові як 10−10 моль/л, може викликати значне зростання рівня глюкози[1].
Інші функції, опосередковані ПКА
Циклічним АМФ як вторинним посередником «користується» не тільки адреналін, а й багато інших біологічно активних речовин. Зокрема за його посередництва через Gs-білки діють: вазопресин, глюкагон, хоріонічний гонадотропін, дофамін (через D1-рецептор), кальцитонін, кортикотропін, лютеїнізуючий гормон, меланоцитстимулюючий гормон, норадреналін (через β-адренорецептори), тиреотропний, фолікулстимулюючий. Зменшення кількості цАМФ викликають: ангіотензин ІІ, ацетилхолін (через м-холінорецептори), дофамін (через D2-рецептори), норадреналін (через α2-адренорецептори), опіоїдні пептиди, соматостатин[6].
Кожен із цих гормонів має свій унікальний вплив, що відрізняється у різних клітин-мішеней. Протеїнкіназа А може фосфорилювати велику кількість різних білків, серед яких глікогенсинтаза, піруваткіназа, піруватдегідрогеназний комплекс, гормон-чутлива ліпаза, фосфофруктокіназа, фруктозо-2,6-біфосфатаза, тирозингідроксилаза, гістон H1, гістон H2B, серцевий фосфоламбан, та багато інших[2].
Фосфорилювання транскрипційних факторів
Фосфорилювання ферментів викликає швидкі відповіді, що тривають впродовж секунд (такі як вивільнення глюкози в кров), проте сигналювання за участі цАМФ може мати і довготривалі ефекти, у випадку коли ця молекула впливає на експресію генів. Одними із субстратів ПКА є фактори транскрипції, зокрема CREB (англ. cAMP responce element binging protein). У фосфорильованому стані він може взаємодіяти із коактиваторами CREBBP (англ. CREB binding protien) та p300 і у формі димера приєднуватись до дев'ятинуклеотидної паліндромної послідовністі CRE (англ. cAMP responce element) в ділянці промотора деяких генів та активувати їх експресію. Приклад такої регуляції — активація синтезу мРНК β2-адренергічних рецепторів під впливом катехоламінів, стимуляція синтезу соматостатину[1].
Адаптерні білки
Специфічність відповіді клітин різного типу на збільшення концентрації цАМФ частково забезпечується спеціальними адаптерними білками AKAP (англ. A kinase adaptor proteins), одним кінцем вони кріпляться до регуляторної субодиниці протеїнкінази А, а іншим, до якогось іншого субстрату — мікротрубочок, актинових філаментів, іонних каналів, білків мітохондрій, ядра тощо. Таким чином відбувається локалізація сигналу. Існує багато видів AKAP і вони по-різному експресуються в різних типах клітин, тому в одних клітинах цАМФ може стимулювати фосфолиювання цитоскелетних білків, а в іншій — білків мітохондрій тощо. Окрім того AKAP часто сполучають ПКА із аденілатциклазою або/і фосфодіестеразою, таким чином забезпечується не тільки локалізованість сигналу, а і його обмеженість у часі[5][2].
Сигнали цАМФ, не пов'язані із ПКА
Хоча основним ефектом цАМФ є активація протеїнкінази А, він деколи може діяти і без посередництва цього ферменту. Наприклад у нюхових рецепторних нейронах ссавців існують цАМФ-керовані катіонні канали, що відкриваються під впливом цього вторинного посередника. Відкриття каналів супроводжується заходженням в клітини іонів Na+ та деполяризацією мембрани, отже виникненням потенціалу дії. цАМФ у цьому випадку синтезується аденілатциклазою, яку активує α-субодиниця Golf-білка[2].
Також цАМФ може впливати на активність мономерної ГТФ-ази Rap1, що задіяна в таких процесах як активація тромбоцитів, проліферація та диференціація клітин та морфогенез. Вплив цАМФ здійснюється через фактор обміну гуанілових нуклеотидів Epac (англ. exchange protein directly activated by cAMP)[1]. Найбільш вираженим впливом Rap1 є збільшення рівня клітинної адгезії внаслідок активації інтегринів[2].
цАМФ і катаболічна репресія кишкової палички
За умов коли в середовищі проживання кишкової палички є багато глюкози, вона віддає перевагу саме цьому енергетичному субстрату і не виробляє ферментів для утилізації інших органічних речовин, це явище називається катаболічною репресією. Коли запаси глюкози вичерпуються в клітині починає накопичуватись цАМФ, який приєднується до білка CAP (англ. catabolite activator protein) переводить його в активну форму. CAP взаємодіє із промоторними ділянками багатьох оперонів (зокрема лактозного), збільшує їхню спорідненість до РНК-полімерази, і таким чином стимулює синтез більше ста генів необхідних для катаболізму[7].
Бактерійні токсини, що впливають на рівень цАМФ
Сигнальні системи клітини, у яких цАМФ є вторинним посередником, навчились використовувати у своїх цілях деякі бактерії. Наприклад збудник холери Vibrio cholerae продукує токсин, що здійснює АДФ-рибозилювання α-субодиниці Gs-білка у клітинах кишківника. Внаслідок цього вона втрачає здатність гідролізувати ГТФ і переходить у стан перманентного збудження, через що у клітинах постійно активна аденілатциклаза і відбувається синтез великої кількості цАМФ. Підвищена концентрація останнього призводить до виділення у просвіт кишківника води та хлориданіонів, і як наслідок виникнення важкої форми діареї[2][5].
Коклюшний токсин, що виділяється паразитом дихальних шляхів Bordetella pertussis, також каталізує АДФ-рибозилювання, але в цьому випадку α-субодиниці Gi-білка, внаслідок цього він не може приєднатись до рецептора і обміняти ГДФ на ГТФ. Тому втрачає здатність пригнічувати аденілатциклазу, що знову ж призводить до постійного збільшення концентрації цАМФ в клітині. В таких умовах клітини дихальних шляхів ушкоджуються і виникає пароксимальний (судомний) кашель[2][5].
Вимірювання концентрації цАМФ за допомогою FRET
Використання методу флуоресцентного резонансного переносу енергії (FRET) дозволяє досить точно проводити вимірювання концентрації цАМФ у різних ділянках живої клітини. FRET базується на явищі переносу енергії від одного флуоресцентного барвника (донора) до іншого (акцептора) без випромінювання, відбуватись ця явище може тільки тоді, коли донор та акцептор розташовані дуже близько одне до одного (на відстані 1—50 Å). Для вимірювання концентрації цАМФ використовують клітини, в яких ген C субодиниці ПКА злитий із геном зеленого флуоресцентного білка (GFP), а ген R субодиниці — із геном червоного флуоресцентного білка (RFP). В інактивованому ферменті BFP (донор, збудження при 380 нм, випромінювання при 460 нм) та GFP (акцептор, збудження при 475 нм, випромінювання при 545 нм) знаходяться достатньо близько, щоб між ними відбувся FRET. У ділянках із підвищеним вмістом цАМФ тетрамерний комплекс дисоціює, внаслідок чого сигнал FRET втрачається і спостерігається інтенсивніше випромінювання у ділянці 460 нм. Таким чином, вимірювання співвідношення випромінювання у 460 нм та 545 нм є чутливим методом для визначення концентрації цАМФ. На основі таких вимірювань можна побудувати зображення, на яких інтенсивністю забарвлення відповідає відносній концентрації цАМФ. Також можна спостерігати зміну рівня вторинного посередника в часі[5].
Джерела
- Gomperts BD, Kramer IM, Tatham PER (2003). Signal Transduction (вид. 1st). Academic Press. ISBN 0122896327.
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5.
- Kraus G (2003). Biochemistry of Signal Transduction and Regulation (вид. 3rd). Wiley-VCH. ISBN 3-527-30591-2.
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5.
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry 5th Fifth Edition (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1.
- Губський Ю.І. (2007). Біологічна хімія. Київ-Вінниця: Нова книга. с. 656. ISBN 978-966-382-017-0.
- Campbell NA, Reece JB (2008). Biology (вид. 8th). Benjamin Cammings. ISBN 978-0321543257.