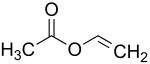
Вінілацетат
Віні́лацета́т — органічна сполука, естер оцтової кислоти складу CH3COOCHCH2. Вінілацетат є безбарвною, легкозаймистою рідиною із різким запахом. Вперше він був отриманий у 1912 році німецьким хіміком Фріцом Клатте.
| Вінілацетат | |
|---|---|
 | |
 | |
| Назва за IUPAC | етенілацетат[1] |
| Систематична назва | етенілетаноат |
| Ідентифікатори | |
| Номер CAS | 108-05-4 |
| Номер EINECS | 203-545-4 |
| KEGG | C19309 |
| ChEBI | 46916 |
| RTECS | AK0875000 |
| SMILES |
CC(=O)OC=C[2] |
| InChI |
InChI=1S/C4H6O2/c1-3-6-4(2)5/h3H,1H2,2H3 |
| Номер Бельштейна | 4290704 і 1209327 |
| Властивості | |
| Молекулярна формула | C4H6O2 |
| Молекулярна маса | 86,090 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 0,9256 г/см³ |
| Тпл | -93,2 °C |
| Ткип | 72,8 °C |
| Розчинність (вода) | 20 г/л (20 °C) |
| Показник заломлення (nD) | 1,3926 |
| В'язкість | 0,421 мПа·с |
| Структура | |
| Дипольний момент | 1,79 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-349,2 кДж/моль (рід.) -314,4 кДж/моль (газ) |
| Небезпеки | |
| Температура спалаху | -8 °C |
| Температура самозаймання | 402 °C |
| Вибухові границі | 2,6—13,4% |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Вінілацетат використовується головним чином для отримання полімерів та кополімерів, що, зокрема, йдуть на виробництво фарб, адгезивів, текстилю, паперу, жувальних ґумок. Він є сировиною для отримання важливих полімерів полівінілового спирту і полівінілбутирату, які є поширеними матеріалами для покриттів.
Отримання
Нині відомо декілька можливих шляхів для його добування:
- взаємодія ацетилену та оцтової кислоти:
- у рідкій фазі, застосовуючи солі ртуті як гомогенний каталізатор;
- у газовій фазі, в присутності солей цинку (гетерогенний каталізатор);
- реакція оцтового ангідриду з етаналем;
- реакція етилену з оцтовою кислотою і киснем;
- реакція метилацетату або диметилового етеру з монооксидом вуглецю та воднем у присутності родію або платиноїдів як каталізатору.
Рідкофазний процес
Взаємодія між оцтовою кислотою та ацетиленом відбувається за помірних температур у присутності солей ртуті як каталізатору:
- ; ΔH = -117 кДж/моль
Вінілацетат вперше був синтезований саме за цим способом. В наш час він має лише історичне значення.
Газофазний процес
Перший газофазний процес був спроектований у Мюнхені Консорціумом Електрохімічної промисловості. До 1965 року цей метод отримання вінілацетату був основним.
Каталізатором у даному процесі виступає активоване вугілля, що модифіковане солями цинку (наприклад, ацетатом цинку):
- ; ΔH = -117 кДж/моль
В ході синтезу ацетилен попередньо підігрівають і змішують із парою оцтової кислоти; оптимальне співвідношення ацетилен:кислота варіюється від 1:4 до 1:4,5. Підігріту суміш подають згодом до реактору. Тепло, що виділяється в результаті взаємодії відводиться охолоджувачами, а на виході з реактору газова суміш проходить кількастадійний процес охолодження, де кінцева температура сягає 0 °C, тим самим зріджуючи продукти реакції. Рідкий вінілацетат із домішками відділяється, а надлишкова частина газів (90% з них — ацетилен) повертається у реактор. Після перегонки рідких продуктів виділяють оцтову кислоту, яку повертають у реактор, і чистий вінілацетат.
Для запобігання небажаної полімеризації вінілацетату вносять добавки інгібітору. Найкраще для цього підходить гідрохінон, також використовують солі купруму, метиленовий синій, фенотіазин.
Температурний режим реакції підтримується у проміжку 160—170 °C, в залежності від вугілля, обраного для створення каталізатору. При підвищенні до 205—210 °C активність каталізатору знижується і утворюється більша кількість побічних продуктів. Типовий вихід вінілацетату за цим методом складає до 99%, а в кількісному відношенні — близько 60—70 г за годину на літр каталізатору.
Етилідендіацетатний процес
Метод був спроектований американською компанією Celanese. Він включає в себе взаємодію оцтового альдегіду з оцтовим ангідридом та розкладання утвореного продукту — етилідендіацетату:
Перша реакція відбувається у рідкій фазі, в присутності каталізаторів на кшталт хлориду заліза(III). Деяка частина утвореного етилідендіацетату зворотньо розкладається на альдегід та ангідрид. Отриманий діацетат зазнає термального розкладу — для цього використовують каталітичну дію толуенсульфонової кислоти.
Рідкофазний процес
У рідкофазному процесі етилен пропускається крізь розчин оцтової кислоти у присутності каталізатору PdCl2:
У розчині також присутній CuCl2 та пропускається кисень, який бере участь у регенерації каталізатору:
Оскільки одним із продуктів регенерації є вода, кінцевий продукт вінілацетат може гідролізуватися.
Синтез проводиться за температури 110—130 °C і тиску 3—4 МПа. Побічними продуктами за цим методом є CO2, мурашина кислота, щавлева кислота, хлоровані сполуки.
Газофазний процес
Газофазний метод було започатковано дещо раніше, ніж рідкофазний. Його використання розпочалося вже з 1968 року. Ніні близько 80% світового виробництва вінілацетату здійснюється саме за цим методом.
Етилен реагує з оцтовою кислотою і киснем у присутності твердих каталізаторів:
- ; ΔH = -178 кДж/моль
Усі застосовувані каталізатори містять паладій та солі лужних металів; вони наносяться на поверхню носіїв типу активованого вугілля, оксиду алюмінію, літієвих шпінелей. Додатковими активаторами є золото, родій, платину і кадмій.
Процес отримання вінілацетату проходить через стадію взаємодії з ацетатом паладію:
Вихідний етилен насичують парою оцтової кислоти і подають у випарювач, підігріваючи суміш до необхідної температури. Після того суміш змішується із киснем в окремій камері. Перетворення вихідних речовин складає 8—10% для етилену, 15—35% для кислоти і 90% для кисню. Умовами синтезу є надлишковий тиск 0,5—1,2 МПа і температура 140 °C.
Газова суміш охолоджується після реакційної камери і направляється на дистиляцію. На цьому етапі важливою є відгонка води від кінцевого продукту. Для уникнення полімеризації вінілацетату під час дистиляції, вносять добавки гідрохінону, бензохінону або пропускають струмінь кисню.
Побічні продукти методу: вода, CO2, незначні кількості етилацетату, етилідендіацетату та глікольацетату.
Реакція метилацетату з CO та H2
Також застосовується метод карбонілювання метилацетату:
Реакція проводиться у рідкій фазі при 150 °C і тиску 7 МПа. Як каталізатори тут використовуються солі родію, йодометан та аміни.
Отриманий діацетат згодом розкладають, отримуючи вінілацетат:
Утворена в ході реакцій оцтова кислота може бути застосована повторно — після додавання метанолу і отримання вихідного естеру:
Альтернативною сировиною є диметиловий етер:
Побічні продукти утворюються на всіх етапах синтезу, а їхнє виокремлення є вельми дорогим, тому цей метод не знайшов широкого застосування.
Хімічні властивості
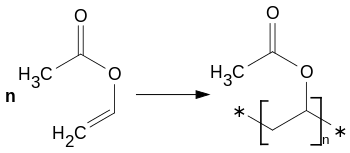
Серед хімічних властивостей вінілацетату найбільше значення має його здатність до полімеризації:
Полімеризація відбувається за вільнорадикальним механізмом. Ініціюють реакцію неорганічні пероксиди, азосполуки, окисно-відновні системи, дія сонячного світла або високоенергетичне іонізаційне випромінювання. Полімеризування інгібується або суттєво сповільнюється у присутності кисню, ароматичних гідрокси, нітро- та аміносполук, хінону, кротонового альдегіду, солей купруму, сульфуру. Енергетичний ефект процесу складає 1035,8 кДж/кг.
Вінілацетат гідролізується під дією кислотного або термічного каталізу. Ця реакція проходить у 1000 разів швидше, ніж в його насиченого аналогу — етилацетату. Гідроліз веде до утворення оцтової кислоти та вінілового спирту, який швидко таутомеризується до етаналю:
Вінілацетат реагує з галогеноводнями із утворенням 1-галогеноетилацетатів (взаємодія проходить відповідно до правила Марковникова):
Аналогічно проходить реакція і з синильною кислотою:
Взаємодіючи з оцтовою кислотою, утворюється етилідендіацетат:
Вінілацетат окиснюється пероксидом водню до гідроксіоцтового альдегіду:
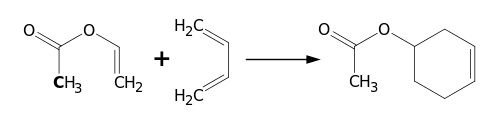
Наявна у молекулі вінільна група бере участь у взаємодії з дієнами за реакцією Дільса — Альдера:
При взаємодії зі спиртами утворюється відповідний естер та етаналь:
В результаті термічного розщеплення вінілацетат розпадається на етаналь та етенон (кетен):
Примітки
- IUPAC Provisional Recommendations. — 2004. — P. 2, 37. (англ.)
- VINYL ACETATE
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Cordeiro, Cajetan F. Vinyl Acetate Polymers // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 24. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Roscher, G. Vinyl Esters // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)