ДНК-вакцина
ДНК-вакцина (також генна вакцина, вакцина на основі нуклеїнових кислот) — генно-інженерна конструкція, яка після введення в клітину забезпечує продукування білків патогенів або пухлинних антигенів та викликає імунну реакцію. Введення ДНК-вакцин в організм називають генетичною імунізацією. ДНК-вакцинація має низку переваг у порівнянні зі звичайними вакцинами. Зокрема показано, що такі вакцини забезпечують не лише вироблення антитіл (гуморальний імунітет), а й специфічну цитотоксичну відповідь (клітинний імунітет), що раніше було досяжним лише з допомогою живих вакцин. Сьогодні ДНК-вакцини не застосовують для лікування людини, проте прогнозується, що генетична імунізація допоможе подолати цілий ряд захворювань.
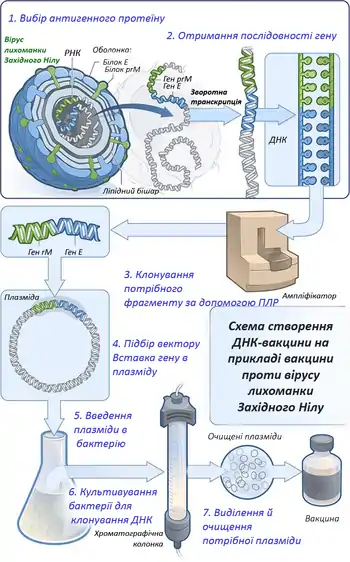
Історія створення
Ідея використовувати фрагменти ДНК для вакцинації з'явилася у 50-60-ті роки. Після серії дослідів було з'ясовано, що генетична інформація ДНК зберігає здатність транскрибуватись і транслюватись після перенесення в іншу клітину[1][2]. Того ж року виявили, введення тваринам геному вірусу поліомієліту стимулює вироблення антитіл[3][4]. Пізніше активацію гуморального імунітету показали для молекул ДНК, отриманих з неінфекційних агентів[5]. Починаючи з 90-х років наукові лабораторії почали все активніше досліджувати імуностимулюючі властивості ДНК. У 1992 році Танг разом з колегами показав, що ген гормону росту людини, вбудований в плазміду, стабільно експресується в організмі миші, а синтезований гормон розпізнається імунною системою як антиген і стимулює вироблення антитіл. Процес введення плазмідної ДНК для стимуляції гуморального імунітету був названий Тангом «генетична імунізація»[6]. Проте вже наступного року інша група вчених заявила, що введення плазміди, кодуючої білки вірусу грипу, викликає як гуморальну, так і клітинну відповідь[7]. Індукування обох гілок імунітету того ж року виявили і для плазміди, що містила гени ВІЛ[8]. З 1995 року почали з'являтися дані, що ДНК-вакцинація здатна активувати імунну систему проти ракових захворювань[9][10]. Близько 20 років тому відбулися перші клінічні випробування ДНК-вакцин, які насамперед повинні були продемонструвати безпечність нового методу. Пацієнтам вводили гени ВІЛ, вірусу грипу, герпесу, гепатиту B, збудника малярії. Результати всіх тестів виявилися цілком обнадійливими: ДНК-вакцини стабільно експресувались, провокували імунну відповідь та не викликали серйозних побічних ефектів, що стало поштовхом для їх подальшого дослідження[11].
Конструювання ДНК-вакцини
За структурою ДНК-вакцина — це вбудована у вектор нуклеотидна послідовність, що кодує певний антиген чи антигени. Вектором в генній інженерії називають молекулу нуклеїнової кислоти, яка слугує для доставки генетичного матеріалу до клітини та забезпечує його реплікацію чи експресію. Раніше для транспортування генів в клітину застосовували вектори на основі вірусів: модифікованого (ослабленого) вірусу натуральної віспи, аденовірусів та ретровірусів. Вірусні вектори є достатньо ефективними, проте мають значну ймовірність розвитку побічних ефектів, пов'язану з відносно високою імуногенністю самого вектора. Тому на сьогодні як вектор частіше використовують бактеріальну плазміду — невелику стабільну кільцеву молекулу ДНК, здатну до автономної реплікації. Сама по собі плазміда не викликає потрібної специфічної імунної відповіді, для цього в неї вшивають гени імуногенних білків. Також ДНК-вакцина повинна містити регуляторні послідовності, необхідні для експресії генів в клітинах еукаріот. Готову ДНК-конструкцію доставляють в бактеріальну клітину, де нарощується кількість її копій. Після цього проводять виділення й очищення плазмід, які несуть потрібну вставку[12].
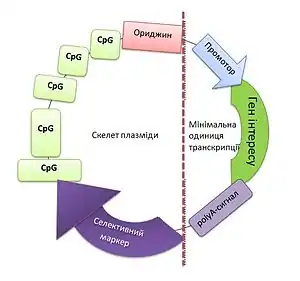
Дизайн плазмідного вектора
Важливим етапом створення ДНК-вакцин є дизайн (конструювання) вектора. Обов'язковими структурами плазмідного вектора є сайти рестрикції, селективний маркер та точка початку реплікації ДНК-вакцини в бактеріальній клітині. Щоби здійснювався синтез антигену, ДНК-вакцина повинна містити промотор і сигнал поліаденілювання. Промотор є важливим фактором ефективності вакцини, оскільки визначає силу імунної відповіді: чим більша експресія гену, що кодує вірусний чи пухлинний антиген, тим сильніша імунна відповідь. Найчастіше використовують промотор вірусу SV40 або цитомегаловірусу (CMV). Для стабілізації мРНК-транскриптів в плазміду вбудовують сигнал поліаденілювання, частіше за все, отриманий з гену гормону росту бика (BGH) або вірусу SV40. Як селективні маркери вибирають бактеріальні гени стійкості до антибіотиків, часто це ген стійкості до канаміцину. При конструюванні ДНК-вакцин найбільш популярною є точка початку реплікації Escherichia coli[13].
Вибір гену для імунізації
Вектор є важливим компонентом ДНК-вакцини, проте її імуногенність визначається саме вставкою — послідовністю ДНК, що кодує антиген. Серед вірусних антигенів для імунізації найкраще підходять білки злиття — це відносно консервативні білки, які забезпечують проникнення вірусу в клітину. Для вакцинації проти грам-позитивних бактерій в плазмідний вектор доцільно вбудовувати гени тих бактеріальних білків, які визначають патогенез захворювання. З-поміж білків грам-негативних бактерій високу імунногеність мають порини[14]. Для терапевтичних протипухлинних ДНК-вакцин використовують білки-маркери ракових клітин[15].
Способи доставки ДНК-вакцин в клітину
Готову вакцину потрібно доставити в організм людини чи тварини, де її точка призначення — антиген-презентуючі клітини (АПК) — макрофаги, дендритні клітини, В-лімфоцити. Тут буде відбуватись синтез і посттрансляційна модифікація антигенну, після чого він буде вбудований в мембрану клітини, щоб привернути увагу імунної системи. Основа проблема полягає в доставці достатньої кількості плазміди в АПК. Методи доставки генетичного матеріалу в клітинну поділяють зазвичай на 2 групи: вірусні і невірусні. Оскільки вірусні вектори мають ряд суттєвих недоліків, в даному розділі представлені лише невірусні методи доставки ДНК-вакцин.
- Схематичне зображення клітинних процесів при введенні ДНК
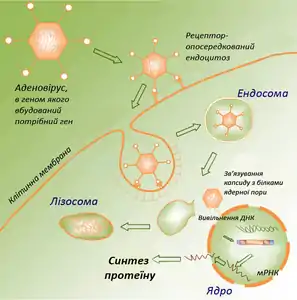 За допомогою аденовірусу
За допомогою аденовірусу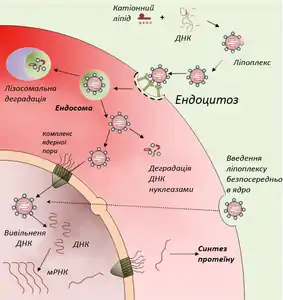 У складі ліпоплексу
У складі ліпоплексу
Мікроін'єкція
На початку 1990-х для введення ДНК в клітину найбільш поширеним були внутрішньом'язові мікроін'єкції, що зумовлено простотою методу. Для цього ДНК розчиняють у воді або ізотонічному розчині, при потребі додають ад'ювант (речовину, що підсилює імунну відповідь). Далі за допомогою тонкої скляної трубки розчин вводять в м'язову тканину, де роль АПК виконують дендритні клітини. Потрапивши в ядро дендритної клітини вакцина починає експресуватись і відбувається синтез білків-антигенів. За допомогою мікроін'єкцій ДНК також можна вводити підшкірно, в тимус, печінку, пухлинну тканину[16], проте саме в м'язовій тканині спостерігається найбільш тривала (до року) експресія ДНК-вакцини[17].
Завдяки високій концентрації клітин Лангерганса (підтип дендритних клітин), привабливою мішенню для ДНК-вакцинації є шкіра[18]. Для інтрадермального (підшкірного) введення використовують масив із мікроголок, довжина яких кілька сотень мікрон. Існують різні варіанти інтрадермальної вакцинації. Простіший включає розпушення масивом мікроголок рогового шару шкіри (зовнішній шар шкіри, зазвичай 10-20 мкм), щоби збільшити її проникність для подальшого місцевого введення розчину ДНК. Ефективнішим є використання мікроголок, покритих сухою вакциною, яка розчиняється вже під шкірою[19].
Ефективність цього методу зазвичай низька, оскільки спочатку ДНК потрапляє в міжклітинний простір, а вже потім включається в клітини.
Електропорація

Електропорація — традиційний підхід для доставки ДНК в бактеріальні клітини і культури клітин, який базується на застосуванні електричного імпульсу. Такий імпульс створює пори в клітинній мембрані, що сприяє входженню негативно зарядженої ДНК. Цей спосіб був запозичений для доставки ДНК-вакцини в організм тварин та людини і дозволяє значно підвищити ефективність звичайної ін'єкції. Прилад для електропорації містить джерело електричного струму та одноразову сітку, яка складається з шприца та голок-електродів. Шприц вводить вакцину в м'язову тканину, а електроди створюють електричне поле, яке полегшує входження ДНК в міоцити і дендритні клітини. На сьогодні розроблені пристрої, які дозволяють підвищити ефективність вакцинації у 1000 разів у порівнянні зі звичайною ін'єкцією. Електропорацію можна застосовувати як для внутрішньом'язового, так і для підшкірного введення ДНК-вакцини. Недоліками є незначна болючість в місці ін'єкції, потреба в спеціалізованих пристроях[18]. Замість електричного поля можна використовувати магнітне. Такі пристрої діють по тому ж принципу, проте у цьому разі процедура є повністю безболісною і менш пошкоджує клітини[20].
Дія електричного поля не лише посилює поглинання ДНК-вакцини клітинами, а й стимулює вироблення імунної відповіді. Застосування електропорації призводить до незначного пошкодження тканини — розвивається локальний запальний процес. Ушкодженні клітини виділяють хемокіни, тому до них направляються макрофаги, лімфоцити та дендритні клітини. Збільшення концентрації імунних клітин у місці введення вакцини підвищує її ефективність[21].
Сонопорація
Сонопорація — метод перенесення чужорідної ДНК в клітини за допомогою ультразвуку. Ультразвук збільшує проникність клітинної мембрани, внаслідок чого екзогенна ДНК легше проникає в клітину. Вперше сонопорація для перенесення генів в клітину була застосована в 1986 році[22]. Цей метод застосовується для введення молекул ДНК в клітини рогівки, мозку, кісткової тканини, нирок, підшлункової залози, ембріональної тканини, скелетних і серцевого м'язів. Відносно інших методів сонопорація є малодослідженою, необхідно ще чимало зусиль, щоб підвищити її ефективність, особливо на рівні цілого організму[16].
Балістична трансфекція
Балістична трансфекція ґрунтується на обстрілюванні (бомбардуванні) органів і тканин мікрочастинками важких металів (золото, вольфрам) діаметром 1-3 мкм покритих молекулами ДНК. Введена таким чином ДНК-вакцина експресується в клітинах-мішенях, а їхні продукти потрапляють у кров. Для надання прискорення частинкам використовуються схожий на стрілецьку зброю пристрій — генний пістолет або генну гармату. Мікрочастинки проходять через клітинні мембрани і переносять генетичну конструкцію безпосередньо у ядро клітини. Глибина проникнення мікрочасток, як правило, невелика — до 1 мм, тому метод застосовують переважно для трансфекції шкіри або прилеглої хрящової тканини. Особливі умови обстрілу дозволяють мікрочастинкам проникати на глибину до 4-5 мм і переносити генні конструкції у волокна поперечно-смугастих м'язів. Зазвичай клітини, що знаходяться безпосередньо по центру пострілу, гинуть, в той час коли в зоні 0,6-1 см від центру знаходяться найбільш вдало протрансформовані клітини. Цю технологію називають також біобалістикою або біолістикою[23].
Перший генний пістолет був створений групою вчених у період 1983 та 1986 роками з метою трансформації клітин рослин. Це був пістолет, розроблений на основі пристрою, для автоматичного забивання цвяхів. На вольфрамову кулю наносили ДНК з репортерним (маркерним) геном і вистрілювали нею в чашку Петрі. Експресія репортерного гену свідчила про ефективність імунізації. На сьогодні для доставки ДНК використовують частинки з золота чи срібла, так як вони є не токсичними для клітини, на відміну від вольфрамових[24].
Під дією високого тиску
В 1999 році були розроблені ін'єкційні прилади, які здатні вводити ДНК-вакцину без використання голки[25]. Такі пристрої працюють завдяки силі Лоренца: невеликий потужний магніт створює значний тиск, проводить в дію поршень, який викидає лікарський препарат зі швидкістю звуку[16]. Змінюючи силу струму можна вибирати глибину ін'єкції і дозувати ліки. Процедура зовсім безболісна і раніше використовувалася для введення інсуліну хворим на діабет та при проведенні масштабних вакцинацій[26]. Суттєвим недоліком цього методу є те, що високий тиск теоретично може змінювати структуру молекул, що вводяться[27]. Тим не менш, дану технологію введення продовжують удосконалювати, і на сьогодні розроблені прилади, які можуть доставити ДНК на глибину до 16 мм[28].
У складі живого бактеріального вектора
Живі бактеріальні вектори — це штами Salmonela, Shigella або Listeria, які несуть мутацію в генах біосинтезу або інвазії, що усуває їх патогенність і здатність зберігати свою життєздатність в організмі господаря чи навколишньому середовищі. Натомість в геном бактерій вбудовують потрібні гени імуногенних протеїнів. Ослаблена бактерія вводиться в організм пероральним шляхом (через рот, шляхом проковтування) або інтроназально (шляхом вприскування в носовий отвір), тому цей спосіб вакцинації не потребує жодного обладнання. Крім того, таке введення стимулює імунну відповідь слизової оболонки, що важливо, оскільки більшість патогенів потрапляють в організм через ротовий і назальний отвори. Минаючи шлунок ослаблена бактерія попадає в тонкий кишечник. Далі бактерія проникає в Пеєрові бляшки — лімфовузли кишечника. Опинившись в середині Пейєрових бляшок, бактерії стають мішенню для макрофагів і піддаються фагоцитозу. В цитоплазмі макрофага відбувається вивільнення бактерією ДНК-вакцини, після чого ДНК потрапляє в ядро, а бактерія знешкоджується імунною системою[18][29].
Упаковка в ліпосоми
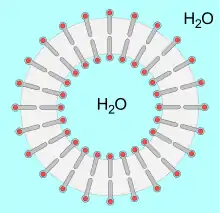

Ліпосома — кулеподібне утворення (близько 100 нм у діаметрі), що складається з подвійного ліпідного шару. Ліпосоми мають порожнину всередині, яка зазвичай заповнена розчинником, але може використовуватись для доставки різноманітних речовин, в тому числі і ДНК-вакцин. Їх гідрофобна оболонка дозволяє їм зливатись з клітинними мембранами і переносити свій вміст усередину клітини. Використання ліпосом розпочалося в 1965 р., і це стало потужним двигуном розвитку біонанотехнологій[30].
Перспективним способом прямого введення ДНК-конструкції в клітини-мішені є доставка генетичної конструкції в складі катіонних ліпосом, побудованих з позитивно заряджених ліпідів. Катіонні ліпосоми із негативно зарядженою молекулою ДНК утворюють ДНК-ліпідний комплекс — ліпоплекс. Переваги застосування таких комплексів — здатність нести великий об'єм інформації, неінфекційність, крім того, вони прості й недорогі у виготовлені[31]. У 2003 р. були створені надзвичайно малі — мілімікронні ліпосоми покриті полімером поліетиленгліколем, які здатні проносити терапевтичну ДНК крізь гемато-енцефалічний бар'єр і доставляти її в нейрони головного мозку, що до цього було неможливим[32].
У складі поліплексів
Для введення в клітину ДНК-конструкцій великих розмірів (>10 т.п.н.) використовують поліплекси — системи, що складаються з позитивно заряджених полімерів (полікатіонів) і негативно заряджених молекул ДНК. Розмір таких комплексів складає менше 100 нм, що, з однієї сторони, не наражає їх на перетравлення макрофагами (оскільки вони реагують на частинки більше 200 нм), а з іншого боку, вони досить великі, щоб не фільтруватись в нирках[33].
Полікатіони конденсують молекулу ДНК в комплекси, таким чином забезпечують її стабільність і захист від дії нуклеаз. Як ДНК-звязуючі полімери можуть служити катіонні білки, синтетичні гомополімери амінокислот (полілізини, поліаргініни), полісахарид хітозан, поліетиленамін. Зазвичай в складі поліплексів полікатіон знаходиться в надлишку, в результаті чого даний комплекс є розчинним та позитивно зарядженим. Якщо до поліплексу пришити ліганд до певного клітинного рецептора, то ДНК-вакцину можна направляти в конкретний тип клітин. Процес доставки генетичного матеріалу в складі поліплексів включає два етапи: позаклітинний (шлях від місця введення до клітин-мішеней) і внутрішньоклітинний (взаємодія з клітинами-мішеней, ендоцитоз, вихід із ендосом, доставка в ядро). Першим бар'єром, який необхідно подолати комплексу, є кров і позаклітинний матрикс. Тому підбираються такі фізико-хімічні параметри поліплексу, щоб збільшити його стабільність, уникнути небажаних взаємодій з білками крові та імунної реакції, викликаної хімічною природою полікатіону. Потрапивши до клітини-мішені, поліплекс адсорбується на плазматичній мембрані, поглинається шляхом ендоцитозу, після чого він повинен покинути ендосому і дисоціювати на катіонний полімер і молекулу ДНК. Вільна ДНК направляється в ядро, а катіонний полімер покидає клітину і виводиться з організму[34].
Метод |
Переваги |
Недоліки |
| Внутрішньом'язові або підшкірні ін'єкції |
|
|
| Електропорація |
|
|
| Генний пістолет |
|
|
| Введення за рахунок високого тиску |
|
|
| Упаковка в ліпосоми |
|
|
Механізм розвитку імунної відповіді
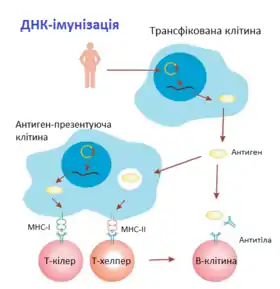
Синтезований в клітині антиген піддається процесингу, після чого відбувається його презентація імунокомпетентним клітинам. Процесинг — це розщеплення антигенного протеїну на імуногенні пептидні фрагменти. Презентація означає подачу фрагмента антигена сполученого з молекулами головного комплексу гістосумісності (MHC) імунокомпетентним клітинам. Розрізняють два найбільш значимих класи цих молекул: МНС класу I (МНС-I) і МНС класу II (МНС-II). Для зв'язування з молекулами кожного класу антиген проходить підготовку в спеціалізованих компартментах клітини. Ендогенні білки-антигени направляються на деградацію в протеасому, після чого презентуються в комплексі з МНС-I на поверхні клітини. Тут при зустрічі їх розпізнають CD8+ T-клітини (Т-кілери), які реалізують цитотоксичну імунну відповідь. Екзогенні білки розщеплюються лізомними протеазами, включаються в склад MHC-II і розпізнаються рецепторамиCD4+ Т-клітин (Т-хелперів). Останні викликають як клітинну, так і гуморальну відповідь.
Шляхи процесингу антигену і форми імунної відповіді | ||||
| Локалізація антигену | Основний інструмент процесингу | Антиген-презентуючий комплекс | Клітини, що розпізнають комплекс антиген-МНС | Імунна відповідь |
|---|---|---|---|---|
| В клітині | Протеасома | МНС-I | Т-кілери | Цитотоксична |
| Поза клітиною | Лізосома | МНС-II | Т-хелпери | Клітинна, гуморальна |
Презентація антигену по шляху МНС-I
.png.webp)
ДНК-вакцинація передбачає ендогенний синтез антигену, тому цей шлях є переважаючим. Процесинг антигену по шляху МНС-I проходить в кілька етапів. Синтезований в ядрі білок транспортується в цитоплазму, розщеплюється протеасомою на короткі пептиди — епітопи, які спеціальними білками-транспортерами антигенів (ТАР, transporter associated with antigen processing) переносяться в ендоплазматичний ретикулум (ЕПР). В ЕПР кожен епітоп сполучається з молекулою MHC-I, після чого утворений комплекс направляється в апарат Гольджі (АГ) на глікозилювання. Звідти комплекс у складі везикули прямує до плазматичної мембрани. Після злиття везикули з плазмалемою комплекс опиняється на поверхні клітини, де розпізнається рецепторами Т-кілерів, які володіють цитотоксичною активністю[35].
Презентація антигену по шляху МНС-II
Основним джерелом пептидів, що зв'язуються з МНС-II є екзогенні білки, які потрапили в клітину з допомогою ендоцитозу. Однак показано, що деякі внутрішньоклітинні білки також можуть бути представленими в комплексі з МНС-II[36]. При цьому новосинтезовані білки після попадання в цитоплазму переносяться в лізосоми, де антиген розщеплюється під дією кислих протеаз. Після цього лізосома, що містить епітопи, зливається з везикулою, яка несе молекулу МНС-II. Всередині об'єднаної везикули утворюється комплекс епітоп-МНС-II, який після злиття везикули з плазмалемою виноситься на поверхню клітини. Тут цей комплекс розпізнається рецепторами Т-хелперів, в результаті чого відбувається їх активація. Це призводить до стимуляції як клітинного (активація Т-кілерів), так і гуморального імунітету (активація В-лімфоцитів).
Традиційна вакцинація розчинними білковими антигенами націлена на мобілізацію T-хелперів. Порівняно низька відповідь Т-хелперів є одним з недоліків ДНК-вакцин. Також нинішнє покоління ДНК-вакцин не здатне індукувати продукцію високих титрів антитіл. Щоби підвищити активацію Т-хелперів, антиген потрібно перенаправити на шлях МНС-II. Для цього в ДНК-вакцину вбудовують сигнал лізосомної локалізації: синтезований антиген буде направлятись в лізосоми, а значить ступатиме на шлях МНС-II[35].
Стратегії підвищення ефективності ДНК-вакцини
Головне питання щодо майбутнього ДНК-вакцин стосується підвищення їх ефективності. На сьогодні проводиться велика кількість досліджень, присвячених оптимізації розроблених ДНК-вакцин. Пошук рішення ведеться в двох напрямах: підвищення експресії вакцини та збільшення імуногенності закодованого антигену.
Оптимізація транскрипційних елементів
Важливим компонентом ДНК-вакцини є промотор. Бактеріальні промотори не підходять для експресії антигенну в клітинах ссавців, тому замість них використовували промотори онкогенних вірусів. Зараз для підвищення безпечності вакцин їх замінили на промотори від неканцерогенних об'єктів, наприклад, людського цитомегаловірусу (CMV). Для більшості ДНК-вакцин цей промотор є оптимальним вибором: він характеризується високою експресією в широкому діапазоні клітин. Для експресії гена в конкретних тканинах, перспективним є використання промоторів, специфічних для цього типу тканин. Наприклад, використання промотора м'язової креатинкінази при внутрішньом'язовому введені призводить до десятикратного збільшення синтезу антитіл й індукції Т-клітинної відповіді, чим використання аналогічної ДНК-вакцини з CMV промотором. Також високу ефективність у міоцитах показав промотор гену десміну, що кодує один із білків цитоскелету. Для підвищення експресії ДНК-вакцини в кератиноцитах (клітини епітеліальної тканини) використовують промотори гену металотіонеїну (білок, що зв'язує важкі метали) або гену гідроксилази вітаміну D3[37][13].
Рівень ініціації транскрипції, як правило, підвищується за рахунок використання сильного промотора та енхансерів, а особливості термінації можуть стати обмежуючим фактором. Ефективність поліаденілювання і процесингу первинного РНК-транскрипту змінюється залежно від послідовності polyA-сигналу. Тобто, послідовність поліаденілування впливає на синтез антигену. Наприклад, широко використовуваний polyA-сигнал вірусу SV40 має меншу ефективність чим сигнал поліаденілювання гену β-глобіну кролика або гену гормону росту бика[13].
Для ефективної трансляції мРНК ссавців повинна так звану послідовність Козак. Вставка цієї послідовності в ДНК-конструкцію може суттєво збільшувати рівень синтезу антигену. Щоб РНК-полімераза не проскочила стоп-кодон гену і не відбувся синтез подовженого протеїну, який не зможе потім набути правильної укладки, ген можна закінчувати подвійним стоп-кодоном[37].
При конструюванні ДНК-вакцини також намагаються оптимізувати її кодони. Процедура оптимізації означає заміну кодонів в послідовності гена таким чином, щоб амінокислотна послідовність білка не змінювалась, але збільшувалась ефективність трансляції його мРНК. Причиною є те, що більшість амінокислот кодуються більш чим одним кодоном. Кожен кодон має свою тРНК і представленість різних тРНК в клітині неоднакова, причому вона також варіює залежно від виду організму. Кодони підбирають таким чином, щоб наявність потрібної тРНК при синтезі антигену не стала лімітуючим фактором[13].[38]
Оптимізація антигену
Хоча сила імунної відповіді корелює з рівнем експресії ДНК-вакцини, проте для кожного антигену існує певне плато, після якого збільшення кількості антигенного протеїну не підвищуватиме продукцію антитіл. Водночас, досягти більш сильної імунної реакції можна за рахунок оптимізації антигену[39]. Наприклад, шляхом об'єднання антигену з лігандом до певного рецептора антиген-презентуючої клітини. Таким лігандом може бути маркерний білок CD40, позаклітинний домен Fms-подібної тирозинкінази-3 або антиген-4 Т-кілерів[40]. За рахунок взаємодії ліганд-рецептор підвищується ефективність захоплення антигенного протеїну АПК.
Полегшення деградації антигену в протеасомі чи лізосомі також стимулюватиме імунну реакцію. Для підсилення протеліотичного розщеплення антигену, в його послідовність вбудовують сигнал убіквітинування[35]. Використання ДНК-вакцин, що кодують, замість цілого антигену, кілька епітопів різного походження, дозволяє значно розширити спектр імунної відповіді[39].
Для протипухлинних ДНК-вакцин ефективною є комбінація «пухлинний антиген + вірусний або бактеріальний антиген». Наприклад, поєднання пухлинного антигену з епітопом токсину правцю значно підвищує активацію Т-кілерів проти ракових клітин[15][41].
Включення ад'ювантів
При застосуванні традиційних вакцин для підвищення імунної відповіді до них додають ад'юванти. ДНК-вакцина має бактеріальне походження, тому вона сама є імуностимулятором. Для посилення імунної відповіді в ДНК-вакцину вбудовують гени ад'юванту або застосовують додаткову плазміду, яка кодує імуностимулюючі білки[42].
Імуностимулююча дія бактеріальних CpG динуклеотидів
Функція плазміди не обмежується доставкою генів в клітини. Ще в 1893 році було виявлено, що суміш бактеріальних лізатів зменшує прогресування ракових пухлин, проте лише в 1983 встановили, що імуностимулюючі властивості лізату зумовлені молекулами ДНК бактерії[43]. У 1995 році показали, що стимуляція імунітету викликана CpG-мотивами бактеріальної ДНК[44]. У бактерій, а також ДНК-вірусів, ці мотиви є неметилованими. В організмі людини і вищих приматів, навпаки, цитозин у складі більшості CpG-динуклеотидів містить метильну групу. Тому неметиловані CpG-мотиви сприймаються людським організмом як патагенасоційовані молекулярні патерни (PAMP, pathogen-associated molecular patterns). РАМР-сполуки розпізнаються Toll-подібними рецепторами, яких залежно від типу ліганда, поділяють на кілька типів. Неметиловані CpG-мотиви розпізнає рецептор TLR-9, розташований на мембранах ендоплазматичного ретикулуму В-лімфоцитів, дендритних клітин і натуральних кілерів. Зв'язування рецептора з неметилованими CpG-мотивами запускає каскад реакцій, в результаті якого індукується синтез прозапальних цитокінів — інтерферону-1 і IL-12[45].
Експресія цитокінів та інших імуномодуляторів
Для ДНК-вакцинації як ад'юванти найчастіше застосовують гени цитокінів. Цитокіни — це клас білкових молекул, що регулюють міжклітинні і міжсистемні взаємодії в організмі, зокрема, функціонування імунної системи. Всі цитокіни, а їх відомо понад 30, можуть модулювати імунну відповідь. Цитокіни IL2, IL-12, інтерферон γ, IL-15, IL-18 і IL-23 мають стимулюючий вплив на Т-хелпери першого класу. До цитокінів, що модулюють дію Т-хелперів другого класу, відносяться: IL-4, IL-5, IL-6, IL-10 I IL-13. Тип цитокіну підбирають згідно того, який тип імунної відповіді хочуть посилити[46].
Відмінності імунної відповіді Т-хелперів 1 і 2 класу | ||
| Відмінності | Т-хелпери 1 | Т-хелпери 2 |
|---|---|---|
| Головна клітина-партнер | Макрофаг | В-клітина |
| Імунна відповідь | Клітинна. Підсилює дію макрофагів. |
Гуморальна.
Стимулює проліферацію В-клітин. |
Досягти підвищення імунної відповіді можна з допомогою хемокінів. Хемокіни — це сімейство цитокінів, які здатні викликати хемотаксис чутливих до них клітин, в тому числі й імунних. Зокрема, рецептори до хемокінів є на антигенперезентуючих клітинах хемокінів. Зв'язування хемокіну зі своїм рецептором призводить до ендоцитозу комплексу антиген-хемокін всередину АПК. Ця стратегія ефективно використовується як при розробці противірусних ДНК-вакцин[47], так і протипухлинних[48].
Функцію ад'юванта також може виконувати білок HSP70 (heat-shock proteins, білки теплового шоку). Імуностимулююча дія HSP70 базується на його здатності виходити в позаклітинний простір і зв'язуватись з рецепторами АПК. Механізм транспорту HSP70 назовні поки остаточно не з'ясований, але швидше за все існує кілька шляхів — екзоцитоз, секреція назовні або вихід через канал[49]. Зв'язування HSP70 зі своїм рецептором призводить до активації дендритних клітин, опосередковує презентацію антигену і стимулює продукцію хемокінів. Оскільки антиген злитий з HSP70, він також потрапляє в позаклітинний простір, тому може презентуватись по шляху МНС-II і активувати В-клітини. Для уникнення аутоімунних реакцій для ДНК-вакцин використовують бактеріальний ген HSP70[50].
Переваги і недоліки ДНК-вакцин
Метод ДНК-вакцинації володіє низкою переваг, найбільш важливою з яких є запуск як гуморальної, так і клітинної імунної відповіді. Вакцини на основі ДНК забезпечують довготривалу експресію антигену і, відповідно, стійку імунну відповідь. До додаткових факторів, що сприяють розвитку ДНК-імунізації, відносять простоту й низьку вартість виробництва вакцини[51].
| Переваги | Недоліки |
|---|---|
|
|
Застосування ДНК-вакцин
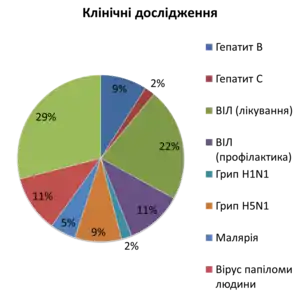
Перші клінічні дослідження ДНК-вакцин, разом безпечністю нового методу, продемонстрували його низьку ефективність. Розуміючи перспективність ДНК-імунізації, наукові лабораторії разом з біотехнологічними компаніями спрямували свої зусилля на оптимізацію нового методу, і вже за кілька років вдалося досягти значного прогресу. У 2005 році перша ДНК-вакцина отримала дозвіл FDA (англ. Food and Drug Administration) для застосування на тваринах. Станом на 2013 р. більше ста ДНК-вакцин проходять клінічні випробовування[52] і чотири ДНК-вакцини є ліцензованими для використання у тваринництві.
ДНК-вакцини у ветеринарії
Усі чотири схвалені FDA вакцини створені на основі плазмід. Для трьох із них рекомендований виробником спосіб введення — внутрішньом'язово, для вакцини LifeTide® — внутрішньом'язова ін'єкція, поєднана з електропорацією. Якщо решта вакцин направлена на активацію імунітету, то для вакцини LifeTide® імуностимулююча дія є додатковою. Продукт вакцини — соматоліберин, гормон який стимулює вивільнення гіпофізом гормону росту і пролактину. Дія останніх двох гормонів у свиней призводить до зростання маси тварин та збільшення кількості виводку[53]. Разом з тим, введення тваринам плазміди, що кодує соматоліберин, стимулює вироблення Т-лімфоцитів, натуральних кілерів[54], отже збільшує імунний опір організму.
| Торгова назва вакцини | Рік ліцензування | Мішень | Тварина | Продукт вакцини | Мета створення вакцини |
|---|---|---|---|---|---|
| West Nile-Innovator® (США) | 2005 | Вірус гарячки Західного Нілу | Коні | Структурний білок вірусу PreM-E | Захист проти вірусу |
| Apex-IHN® (Канада) | 2005 | Збудник інфекційного некрозу гемопоетичної тканини | Риби родини Лососеві | Вірусний глікопротеїн | Підвищення кількості і якості продовольства риби |
| LifeTide® SW 5 (Австралія) | 2008 | Гормон росту | Свині та інша домашня худоба | Соматоліберин свині | Збільшення виводку у свиноматок; значно знижує зниження перинатальної смертності і захворюваності |
| ONCEPT® (США) | 2010 | Меланома | Собаки | Тирозиназа людини | Як альтернатива променевій терапії і операційному втручанню при лікуванні меланоми |
Перспективи ДНК-вакцинації
Протипухлинні ДНК-вакцини
У той час як індукція клітинної і гуморальної імунної відповіді переконливо продемонстрована для чужорідних антигенів, асоційованих з інфекційними захворюваннями, застосування ДНК-вакцин для лікування раку досі було менш успішним. Індукція ефективного протипухлинного імунітету є складним завданням. Клінічні дослідження підтвердили загальну безпеку і низьку токсичність протипухлинних ДНК-вакцин, однак ефективність викликаної ними імунної відповіді виявилася слабкою, а протипухлинна активність, в деяких випадках, взагалі сумнівною[40].
ДНК-вакцини проти вірусних і бактеріальних збудників
Причиною карієсу є локальна зміна pH внаслідок бродіння (гліколізу) вуглеводів, здійснюваного бактеріями[56]. Ученими з Уханського Інституту вірусології (Китай) була розроблена ДНК-вакцина направлена проти одного із збудників карієсу — Streptococcus mutans. Вакцина побудована на основі плазміди і кодує два білки: поверхневий протеїн St. mutans PAc та флагелін, отриманий з бактерії Salmonella, який виконує роль ад'юванта[57]. На стадії доклінічних досліджень вакцину через ніс вводили лабораторним гризунам, після чого у тварин перевіряли рівень імуноглобулінів G в сироватці крові та секреторних імуноглобулінів А в слині. Після проведених досліджень вчені з'ясували, що рівень імунних білків і в крові, і в слині підвищувався, але, що важливіше, при цьому гальмувався ріст колоній Streptococcus mutans на зубній емалі. Тобто, зуби вакцинованих тварин були краще захищені від карієсу.
ДНК-вакцини і лікування аутоімунних захворювань
Цукровий діабет типу 1 характеризується втратою інсулін-продукуючих бета-клітин, розташованих в острівцях Лангерганса підшлункової залози. Головна причина втрати бета-клітин — аутоімунне ураження Т-кілерами[58]. Для того, щоб захистити бета-клітини від гіперактивної функції імунної системи, вчені зі Стенфордського (США)і Лейденського (Нідерланди) університетів, розробили ДНК-вакцину BHT-3021. Вакцина створена на основі плазміди і кодує попередник інсуліну — проінсулін. Це вакцина зворотної дії: якщо звичайні вакцини повинні активувати імунні реакції, то BHT-3021, навпаки, нейтралізує цитотоксичну дію Т-кілерів направлену проти острівців Лангерганса.
У першій фазі клінічних випробувань BHT-3021 показала свою ефективність на групі 80 осіб. Половина з них кожних сім днів протягом 12 тижнів отримувала внутрішньом'язові ін'єкції BHT-3021, а друга половина — плацебо. Після закінчення цього терміну група, яка отримувала вакцину, продемонструвала підвищення рівня С-пептидів в крові, що свідчить про відновлення функції бета-клітин. Ніяких серйозних побічних ефектів у жодного з учасників зафіксовано не було. Дія вакцини зберігалась протягом 2 місяців[59].
Джерела
- Atanasiu P.; Cantarow A., Paschkis K. E. (1950). Production of neoplasms by fractions of mammalian neoplasms.. Cancer Res 10: 775–782.
- Ito Y. (1961). Heat-resistance of the tumongenic nucleic acids of Shope papillomatous.. Virology 12: 596–601.
- Atanasiu P. (1962). Production de tureurs chez le Hamster par inoculation d’acide desoxyribonucleique extrait de cultures de tissus infectees par le virus du polyome.. Acad. Sci. 254: 4228– 4230.
- Orth G. (1964). Infectious and oncogenic effect of DNA extracted from cells infected with polyoma virus.. PrOC. Soc. Exp. Biol. Med. 115: 1090–1095.
- Wolff J. A.; Malone R. W., Williams P., Chong W. (1990). Direct gene transfer into mouse muscle in vivo.. Science 247 (4949): 1465–1468. PMID 1690918.
- Tang D.; Devit M.; Johnston S.A.; Others, (1992). Genetic immunization is a simple method for eliciting an immune response. Nature 356 (6365): 152–154. PMID 1545867. doi:10.1038/356152a0.
- Ulmer J. B.; Donnelly J., Parker S. E., Rhodes, Others, (1993). Heterologous protection against influenza by injection of DNA encoding a viral protein.. Science 259: 1745–1749.
- Wang B; Ugen K. E., Srikantan V., Agadjanyan M. G.; Others, (1992). Gene inoculation generates immune responses against human immunodeficiency virus type 1. Proc Natl Acad Sci U S A. 90 (9): 4156–4160. doi:10.1073/pnas.90.9.4156.
- Conry R. M.; LoBuglio, A. F., Loechel, F., Moore, S. E.; Others, (1995). A carcinoembryonic antigen polynucleotide vaccine for human clinical use. Cancer gene therapy 2 (1): 33–38.
- Chattergoon M; Boyer J, Weiner DB. (1997). Genetic immunization: a new era in vaccines and immune therapeutics. FASEB J. 11 (10): 753–763. PMID 9271360.
- Ferraro B.; Matthew P. Morrow, Natalie A. Hutnick; Others (2011). Clinical Applications of DNA Vaccines: Current Progress. Clin Infect Dis. 53 (3): 296–302. doi:10.1093/cid/cir334.
- Anderson R. J.; Schneider J. (2007). Plasmid DNA and viral vector-based vaccines for the treatment of cancer. Vaccine 25: 24–34. doi:10.1016/j.vaccine.2007.05.030.
- Garmory H. S.; Brown K. A., Titball R. W. (2003). DNA vaccines: improving expression of antigens. Genetic vaccines and therapy 1. doi:10.1186/1479-0556-1-2.
- Супотницкий М. В. (1998). ДНК-иммунизация в профилактике инфекционных заболеваний сельскохозяйственных животных – 1998. – Т. 5. – С. 18-24.. Ветеринария 5: 18–24.
- Rice J.; Dossett M. L., Ohlen C., Buchan S. L., Others (2008). DNA fusion gene vaccination mobilizes effective anti-leukemic cytotoxic T lymphocytes from a tolerized repertoire. European Journal of Immunology 38 (8): 2118–2129. doi:10.1002/eji.200838213.
- Kamimura K.; Suda T., Zhang G., Liu D. (2011). Advances in gene delivery systems. Pharmaceutical medicine 5: 293–306. PMID PMC3245684.
- Wolff J. A.; Ludtke JJ, Acsadi G, Williams P, Jani A (1992). Long-term persistence of plasmid DNA and foreign gene expression in mouse muscle. Hum. Mol. Gen 1: 363–369.
- Cranenburgh R. (2011). DNA Vaccine Delivery. BioPharm International Supplements 24 (10): 12–18.
- Chen X; Kask A. S., Crichton M. L., Others, (2010). Improved DNA vaccination by skin-targeted delivery using dry-coated densely-packed microprojection arrays. J Control Release 148 (3): 327–333. doi:10.1016/j.jconrel.2010.09.001.
- Chen C.; Evans J. A., Robinson M. P., Others, (2010). Genetic immunization is a simple method for eliciting an immune response. Physics in Medicine and Biology 55 (4): 1219–1223. doi:10.1088/0031-9155/55/4/021.
- Kjeken R.; Devit M.; Johnston S.A.; Others, (2008). Recruitment of antigen-presenting cells to the site of inoculation and augmentation of human immunodeficiency virus type 1 DNA vaccine immunogenicity by in vivo electroporation. Journal of Virology 82 (11): 5643–5649. PMID 1545867. doi:10.1128/JVI.02564-07.
- Fechheimer M.; Boylan J. F., Parker S., Others, (1987). Transfection of mammalian cells with plasmid DNA by scrape loading and sonication loading. Proc Natl Acad Sci U S A. 84 (23): 8463–8467. PMID 2446324.
- Абрамова, З.И. (2008). Введение в генетическую инженерию. Казань. с. 110–116.
- Klein, TM et al (1987) High-velocity microprojectiles for delivering nucleic acids into living cells. Nature 327:70-73
- Liu F; Song Y, Liu D. (1999). Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 6 (7): 1258–66. PMID 10455434. doi:10.1038/356152a0.
- [[[Jet injector]] Wikipedia: Jet injector].
- Kumaragurubaran K.; Kaliaperumal K. (2013). DNA vaccine: the miniature miracle. Vet World 6 (4): 228–232. doi:10.5455/vetworld.2013.228-232.
- Taberner A.; Devit M., Hogan C. N., Hunter I. W. (2012). Needle-free jet injection using real-time controlled linear Lorentz-force actuators. Medical engineering & physics 34 (9): 1228–1235. doi:10.1016/j.medengphy.2011.12.010.
- Gentschev I,; Dietrich G, Spreng S, Pilgrim S, Stritzker J, Kolb-Mäurer A, Goebel W. (2002). Delivery of protein antigens and DNA by attenuated intracellular bacteria. Int J Med Microbiol 291: 577–582. PMID 11890559.
- Balazs D. A.; Godbey W. T. (2011). Liposomes for Use in Gene Delivery. Journal of Drug Delivery 2011: 12. doi:[http://dx.doi.org/10.1155%2F2011%2F326497%0A%E2%80%83 10.1155/2011/326497 ].
- Великий Микола. Генна терапія: досягнення, перспективи. Архів оригіналу за 21 вересня 2013. Процитовано 19 вересня 2013.
- Ananthaswamy, Anil (20 березня 2003). Undercover genes slip into the brain. New Scientist. Архів оригіналу за 17 вересня 2011. Процитовано 17 серпня 2010.
- Moghimi S. M.; Hunter A. C., Murray J. C. (2005). Nanomedicine: current status and future prospects. The FASEB Journal 19: 311–330. doi:10.1096/fj.04-2747rev.
- Дурыманов Михаил. Доставка генов в клетку.
- Стародубова Е. С.; Исагулянц М. Г., Карпов В. Л. (2010). Регуляция процессинга иммуногена: сигнальные последовательности и их использование для создания нового поколения ДНК-вакцин. ACTA NATURAE 2 (1): 59–65.
- Klionsky D.; Emr. S. (2000). Autophagy as a regulated pathway of cellular degradation. Science 290: 1717–1721. doi:10.1126/science.290.5497.1717.
- Tang D.; Weiner D. B. (2008). DNA vaccines: ready for prime time?. Nature Reviews Genetics 9 (10): 776–788. doi:10.1038/nrg2432.
- Williams J.A. (2013). Vector Design for Improved DNA Vaccine Efficacy, Safety and Production. Vaccines 1 (3): 225–249. PMID 1545867. doi:10.3390/vaccines1030225.
- Moreno S; Timon M. (2004). DNA vaccination: an immunological perspective. Immunologia 123: 41–55. Архів оригіналу за 21 вересня 2013. Процитовано 20 вересня 2013.
- Shaw D. R.; Strong T. V. (2006). DNA vaccines for cancer. Frontiers in Bioscience 11: 1189–1198.
- Chudley L.; McCann K., Mander A., Tjelle T., Others (2012). DNA fusion-gene vaccination in patients with prostate cancer induces high-frequency CD8+ T-cell responses and increases PSA doubling time. Cancer Immunol Immunother 61: 2161–2170. doi:10.1002/eji.200838213.
- Ulmer J. B.; Wahren B., Liu M. A. (2006). Dna vaccines: recent technological and clinical advanced. Discovery Medicine, 6(33):109-112, 2006 6 (33): 109–112.
- Coley, WB (1991). The treatment of malignant tumors by repeated inoculations of erysipelas. With a report of ten original cases. 1893. Clinical orthopaedics and related research (262): 3–11. PMID 1984929.
- Krieg, AM; Yi, AK; Matson, S; Waldschmidt, TJ; Bishop, GA; Teasdale, R; Koretzky, GA; Klinman, DM (1995). CpG motifs in bacterial DNA trigger direct B-cell activation. Nature 374 (6522): 546–9. PMID 7700380. doi:10.1038/374546a0.
- Entrez Gene: TLR9 toll-like receptor 9.
- Thalhamer, Josef; Weiss, Richard; Scheiblhofer, Sandra (2010). Gene Vaccines. Berlin: Springer. с. 198–203. doi:10.1007/978-3-7091-0439-2.
- Hong Qin; Pramod N. Nehete, Hong He, Others, (2010). Prime-Boost Vaccination Using Chemokine-Fused gp120 DNA and HIV Envelope Peptides Activates Both Immediate and Long-Term Memory Cellular Responses in Rhesus Macaques. Journal of Biomedicine and Biotechnology 2010: 152–154. doi:10.1155/2010/860160.
- Igoucheva, O; Grazzini M., Pidich A., Others, (2013). Immunotargeting and eradication of orthotopic melanoma using a chemokine-enhanced DNA vaccine. Gene Therapy 20 (9): 938–949. doi:10.1038/gt.2013.17.
- Евдонин А. Л.; Медведева Н. Д. (2009). Внеклеточный белок теплового шока 70 и его функции. Цитология 51 (2): 130–137.
- Ebrahimi S. M.; Tebianian M. (2013). Immunotargeting and eradication of orthotopic melanoma using a chemokine-enhanced DNA vaccine. World Applied Sciences Journal 14 (10): 1569–1575.
- Liu, Margaret A. (2011). DNA vaccines: an historical perspective and view to the future. Immunological Reviews 239 (1): 62–84. ISSN 01052896. doi:10.1111/j.1600-065X.2010.00980.x.
- ClinicalTrial.gov: A service of the U.S. National Institutes of Health. Архів оригіналу за 11 червня 2015. Процитовано 6 жовтня 2013.
- Draghia-Akli R.; Ellis K. M., Hill L.-A., P.; Others, (2003). High-efficiency growth hormone releasing hormone plasmid vector administration into skeletal muscle mediated by electroporation in pigs. FASEB J. doi:10.1096/fj.02-0671fje.
- Brown P. A.; Davis W. C., Draghia-Akli R. (1992). Immune-enhancing effects of growth hormone-releasing hormone delivered by plasmid injection and electroporation.. Mol Ther. 10 (4): 644–651. PMID 15451448. doi:10.1038/356152a0.
- Ferraro B.; Morrow, M. P., Hutnick, N. A. (2011). Clinical applications of DNA vaccines: current progress. Clinical infectious diseases 53 (3): 296–303. doi:10.1093/cid/cir334.
- Introduction To Dental Plaque (англійською). Архів оригіналу за 24 серпня 2011. Процитовано 17 березня 2009.
- Shi W. et al. (2012). Flagellin enhances saliva IgA response and protection of anti-caries DNA vaccine. Journal of dental research 91 (3): 249–254.
- Type 1 Diabetes Mellitus. Архів оригіналу за 21 липня 2013. Процитовано 4 серпня 2008.
- Roep B. O.; Solvason, N., Gottlieb, P. A., Abreu, J. R. (2013). Plasmid encoded proinsulin preserves C-peptide while specifically reducing proinsulin-specific CD8 T cells in type 1 diabetes. Sci Transl Med. 5 (191): 191–82. doi:10.1126/scitranslmed.3006103.
Література
- Ferraro B.; Morrow, M. P., Hutnick, N. A. (2011). Clinical applications of DNA vaccines: current progress. Clinical infectious diseases 53 (3): 296–303. doi:10.1093/cid/cir334.
- Tang D.; Weiner D. B. (2008). DNA vaccines: ready for prime time?. Nature Reviews Genetics 9 (10): 776–788. doi:10.1038/nrg2432.
- Irsa Mateen; Saba Irshad (2011). A Review on DNA Vaccines. Journal of Health Science 1 (1): 1–7. doi:10.5923/j.health.20110101.01.
- Hooper JW, Thompson E, Wilhelmsen C, et al. (May 2004). Smallpox DNA vaccine protects nonhuman primates against lethal monkeypox. J. Virol. 78 (9): 33–43. doi:10.1128/JVI.78.9.4433-4443.2004.
- Д.Ю.Логунов,Б.С.Народицкий,А.Л.Гинцбург (2007). Молекулярно-генетические технологии защиты от патогенов. Ремедиум 3. Архів оригіналу за 29 жовтня 2013. Процитовано 25 жовтня 2013.
Посилання
|
|
Ця стаття належить до вибраних статей Української Вікіпедії. |