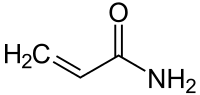
Акриламід
Акри́ламі́д — органічна сполука, амід акрилової кислоти складу CH2CHCONH2. За звичайних умов є білою, твердою речовиною. Має високу розчинність у воді, спиртах. Проявляє сильні нейротоксичні властивості.
| Акриламід | |
|---|---|
 | |
| Назва за IUPAC | проп-2-енамід[1] |
| Інші назви | амід акрилової кислоти, 2-пропенамід |
| Ідентифікатори | |
| Номер CAS | 79-06-1 |
| Номер EINECS | 201-173-7 |
| KEGG | C01659 |
| Назва MeSH | D02.065.122.015 і D02.241.081.069.094.015 |
| ChEBI | 28619 |
| RTECS | AS3325000 |
| SMILES |
C=CC(=O)N[2] |
| InChI |
InChI=1S/C3H5NO/c1-2-3(4)5/h2H,1H2,(H2,4,5) |
| Номер Бельштейна | 605349 |
| Номер Гмеліна | 81842 |
| Властивості | |
| Молекулярна формула | C3H5NO |
| Молярна маса | 71,078 г/моль |
| Густина | 1,122 г/см³ (30 °C) |
| Тпл | 84,5 °C |
| Ткип | 192,6 °C |
| Розчинність (вода) | 2155 г/л (20 °C) |
| Розчинність (бензен) | 3,46 г/л (30 °C) |
| Розчинність (хлороформ) | 26,6 г/л (30 °C) |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-212,1 кДж/моль (тв.) -224,0 кДж/моль (рід.) -130,2 Дж/(моль·K) (газ) |
| Теплоємність, c |
110,6 Дж/(моль·K) (тв.) |
| Небезпеки | |
| ЛД50 | 2250 мг/кг (кролики) |
| Пов'язані речовини | |
| Інші | акрилонітрил, акрилоїлхлорид |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
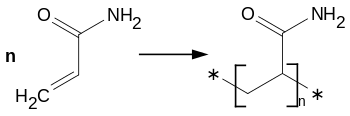
Основна частина акриламіду використовується для синтезу поліакриламіду та деяких кополімерів, що застосовуються як флокулянти, отверджувачі і матеріали покриття.
Фізичні властивості

Акриламід є білою твердою речовиною. Він достатньо стійкий за помірних температур. При нагріванні вище температури кипіння відбувається швидка полімеризація, що супроводжується виділенням значної кількості тепла.
Акриламід має високу розчинність у воді, а також добре розчиняється у спиртах та ацетоні.
| Ацетонітрил | 39,6 | Діоксан | 30 |
| Ацетон | 63,1 | Етанол | 86,2 |
| Бензен | 0,346 | Етилацетат | 12,6 |
| Вода | 215,5 | Метанол | 155 |
| н-Гептен | 0,0068 | Піридин | 61,9 |
| Диметилформамід | 119 | Тетрахлорометан | 0,038 |
| Диметилсульфоксид | 124 | Хлороформ | 2,66 |
Отримання
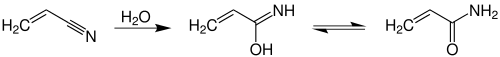
Основні методи синтезу акриламіду базуються на гідратації недорогого і доступного акрилонітрилу:
Протягом тривалого часу основним прицесом добування була кислотна гідратація — у присутності підігрітої до 60 °C сульфатної кислоти. Така взаємодія проводилася за температури 90—100 °C, протягом 1 години. Проблемою цього методу було виділення акриламіду з його солі CH2CHCONH2·H2SO4. Для виділення було запропоновано два шляхи:
- обробка реакційної суміші аміаком із наступним охолодженням, внаслідок чого можна відділити кристали сульфату амонію;
- очищення за допомогою сульфокислотних йонообмінних смол. Проте після розділення утворюються відходи розчину сульфатної кислоти, які забруднюють продукт і підвищують вартість виробництва. Цей спосіб не має комерційного застосування.
У 1960 році був розроблений метод каталітичної гідратації, який мав зменшити кількість відходів та побічних продуктів (однак він був запроваджений лише через десятиліття). На роль каталізатору пропонувалися солі купруму(II), оксид марганцю(IV), нікелево-мідні сплави. На першому повномасшабному виробництві ацетонітрил пропускали через шар мідного каталізатору при 85 °C, отримуючи розчин акриламіду у воді із великим ступенем перетворення і стереоселективністю. За цим методом не утворюється жодних побічних продуктів, однак у випадку забруднення вихідного ацетонітрилу іншими нітрилами, вони також утворювали відповідні аміди. Іншою реакцією, що має місце при перетвореннях, є гідроліз кінцевого акриламіду до акрилової кислоти і аміаку (проте ця реакція зазвичай проходить лише за низьких концентрацій):
У 1985 році компанією Nitto Chemical Industry було започатковано використання біоорганізмів для ферментативного перетворення ацетонітрилу. У реакції, каталізованій нітрилгідрогеназою, застосовувалися роди Bacillus, Bacteridium, Micrococcus, Nocardia і Pseudomonas, а до сфери інтересів новітніх досліджень відносяться бактерії Rhodococcus rhodochrous, котрі можуть продукувати до 20 тис. тон акриламіду на рік. Такий біосинтез проходить при температурі 0—15 °C і pH 7—9 і дає майже виключне перетворення акрилонітрилу із незначними кількостями домішок на кшталт акрилової кислоти.
Акриламід також можна синтезувати деякими іншими методами:
- класичним способом є реакція поміж акрилоїлхлоридом та аміаком:
- акрилоїлізоціанат гідролізується до акриламіду, але із невеликим виходом:
- при амінуванні метилакрилату аміаком утворюється тріамін 3,3',3''-нітрилотриспропіонамід, котрий при нагріванні розкладається із утворенням акриламіду:
Хімічні властивості
Акриламід є двофункціональною сполукою, оскільки має подвійний зв'язок та амідну групу. Він одночасно проявляє слабкі кислотні та осно́вні властивості.
За подвійним зв'язком можливе приєднання багатьох нуклеофілів: аміаку, амінів, фосфінів, в лужному середовищі приєднуються також меркаптани, тіоетери, кетони, нітроалкани та спирти.
У водному розчині амідна група поступово гідролізується до карбоксильної, утворюючи акрилову кислоту. У лужному середовищі дана реакція протікає значно активніше, ніж у кислотному.
Із концентрованою сульфатної кислотою акриламід утворює сіль. При подальшій взаємодії солі зі спиртами можна отримати естери акрилової кислоти:
Акриламід окиснюється гіпохлоритом натрію у лужному середовищі до аміноетену:
Найбільше практичне значення має схильність акриламіду до полімеризації:
Реакції полімеризації та кополімеризації проходять за вільнорадикальним механізмом. Так, акрилат може утворювати кополімери з іншими акрилатами, з метакрилатами та акролеїном, зі стиреном.
Акриламід зазнає дегідратації при дії осушувачів:
Токсичність
Акриламід є сильним нейротоксином і його використання у роботі є небажаним. У твердому агрегатному стані речовина має високу здатність до сублімації, тому представляє більшу загрозу, ніж у рідкому, оскільки є можливість контакту із випаровуваннями та пилом. Характерною особливістю акриламіду є те, що ознаки отруєння проявляються лише після прихованого періоду від кількох днів до тижнів.
До симптомів ураження належать: посилене потовиділення на руках і ногах, оніміння або навіть параліч кінцівок. Контакт акриламіду із очима спричинює кон'юктивальні ураження, пошкодження рогівки ока. Вдихання пари або пилу може призвести до серйозного ураження нервової системи (після прихованого періоду).
При роботі з акриламідом необхідно використовувати респіратор, маску для обличчя, закритий одяг, щільні рукавиці.
Примітки
- IUPAC Provisional Recommendations. — 2004. — P. 37, 43. (англ.)
- ACRYLAMIDE
- Habermann, C. E. Acrylamide // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 1. — P. 132—136. — ISBN 978-0-471-48517-9. — DOI: (англ.)
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Habermann, C. E. Acrylamide // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 1. — P. 132—136. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Greim, H. Acrylic Acid and Derivatives // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)