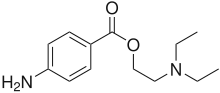
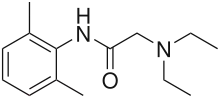
Місцеві анестетики
Місцеві анестетики, або локальні (від грец. an — заперечення і esthesis — чутливість) – лікарські засоби, які знижують, або повністю пригнічують збудливість нервових волокон і блокують проведення імпульсів до центральної нервової системи, що призводить до тимчасової втрати больової та інших видів чутливості у місці їх введення. Є рослинного походження та штучно синтезовані. При введенні великої дози місцевого анестетика можуть маніфестуватись різні ускладнення, загалом тимчасового характеру (наприклад, оніміння та паралічі, які з часом проходять). За класифікацією лікарських засобів місцеві анестетики належать до засобів, які знижують чутливість аферентних нервових закінчень або запобігають їх збудженню.
Історія відкриття та розвиток локальних анестезуючих засобів
.jpg.webp)
Першим місцевим анестетиком став алкалоїд родини тропічних квіткових рослин Еритроксилум, а саме Erythroxylon Coca — кокаїн. Його знеболювальні властивості помітили доволі давно. Корінне населення Південної Америки використовувало листя цих рослин для жування, що призводило до зниження чутливості ротової порожнини, у деяких випадках аж до повного оніміння[1].
Не зважаючи на це, перші офіційні дані про використання кокаїну як знеболювального засобу з'явилися лише в середині 19 століття. У 1855 р. німецьким хіміком Friedrich Gaedike було виділено erythroxylon із листя коки, а Albert Niemann у 1859 році виділив з erythroxylon-у алкалоїд, названий ним “кокаїн”, а в 1879 році лікарем В. К. Анрепом вперше застосовано кокаїн у якості місцевого анестетика.[2] Лікар помітив дію кокаїну під час стажування у Вюрцбурзі (Німеччина), де він вводив розчини цієї речовини різних концентрацій собі під шкіру. Дещо пізніше Анреп експериментально обгрунтував застосування, дозування та методику введення кокаїну і опублікував результати своєї роботи в німецькому журналі Archiv fur Physiologie[3].
Прославився як «батько місцевої анестезії» Карл Роллер, який починаючи з 1884 року почав застосовувати екстракт із листя коки у офтальмології. У цьому ж році В. Бурке застосував кокаїн для блокування проведення імпульсів у нервах ліктьового суглоба, а В. Холстед — у нижньому альвеолярному нерві. У 1885 році Дж. Камінг модифікував методику застосування кокаїну як місцевого анестетику шляхом застосування джгута, який сповільнював всмоктування і виведення кокаїну.
У 1901 році вперше місцевий анестетик застосували разом з адреналіном. Автором методу був Г. Браун — німецький хірург і анестезіолог. Застосування епінефрину зумовлювало звуження судин, і, як результат, сповільнення всмоктування кокаїну, продовження його дії та зниження токсичності[4], одночасно викликаючи підвищення внутрішньосудинного тиску (у тому числі і артеріального).

Відкриття місцевих анестетиків стало поштовхом до виконання досліджень у таких галузях медицини як стоматологія, офтальмологія та інші. У практиці вітчизняної анестезіології перші хірургічні операції із застосуванням кокаїну проводили С. П. Коломнін, І. Н. Кацауров, В. Ф. Войно-Ясенецький, А. І. Лукашевич, О. В. Вишневський та інші.[джерело?]
З часом, реєструвалося все більше випадків виникнення побічних ефектів та тяжких ускладнень у пацієнтів, яким вводили кокаїн. До таких ефектів належали: рухове збудження, тремор, судоми, головний біль, порушення дихання та роботи серця (тахікардія, брадикардія, зниження або підвищення артеріального тиску тощо), пригнічення ЦНС, звикання. У найскладніших випадках неправильне дозування кокаїну могло спричинити смерть пацієнта[5]. Тому, науковці розпочали пошук нових засобів для місцевої анестезії, вплив яких був би більш передбачуваним та менш токсичним.
У 1904 р німецький хімік А.Ейнхорн синтезував прокаїн (Procaine (Novocaine)), який став першим штучним місцевим анестетиком та виявляв набагато менше побічних ефектів, ніж кокаїн. З 1905 року цей препарат почали застосовувати у стоматології[6]. З 1943 року у клінічній практиці почав використовуватися лідокаїн (Lidocaine, Xylocaine), який характеризувався швидшою дією та меншою кількістю ускладнень (у пацієнтів). Впродовж наступних десяти років були синтезовані такі місцеві анестетики, як бупівакаїн, тетракаїн, хлорпрокаїн та інші. Проте, ці препарати також не були ідеальними. 1983 року було зафіксовано 49 випадків кардіотоксичних ефектів, пов'язаних із застосуванням бупівакаїну, що включали 21 смертельний результат.[джерело?] Це поклало початок пошукам та розробці нових місцевих анестетиків сильнішої та тривалішої дії, з мінімальною кардіо- та нейро- токсичністю. Частково ці потреби задовольняють артикаїн та ропівакаїну гідрохлорид[джерело?], проте розробка та синтез місцевих анестетиків нового покоління досі триває.
Хімічна структура та загальні властивості місцевих анестетиків
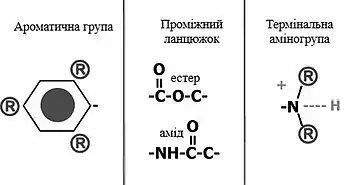
Молекула місцевих анестетиків складається із трьох частин[7][8]:
- Ліпофільної ароматичної групи;
- Проміжного ланцюжка з естерним або амідним зв'язком;
- Термінальної, або кінцевої аміногрупи.
Залежно від хімічної структури засобу, яка визначає його здатність розчинятися в ліпідах, константу іонізації та ступінь зв'язування з білками плазми крові, різняться як загальні властивості місцевих анестетиків, так і їх клінічна ефективність[8].
Ліпофільна ароматична група представлена ароматичним кільцем. Як і свідчить її назва, наявність цієї групи зумовлює хорошу розчинність місцевих анестетиків у ліпідах, яка може бути додатково посилена за допомогою аліфатичних радикалів, розміщених у місцях, позначених на малюнку — (R). Рівень ліпофільності корелює з молярною активністю, або потенцією препарату — активністю хімічної речовини, яка виражається в кількості речовини (концентрації), необхідної для отримання бажаного клінічного ефекту. Це можна пояснити тим, що чим краща розчинність лікарського засобу, тим більша його кількість проникне у нейрони і менша його кількість піддасться розпаду та виведенню .[9] Наприклад, бупівакаїн краще розчинається у ліпідах, ніж лідокаїн, тому для досягнення у пацієнта анестезуючого ефекту зазвичай використовується 0,5 % (5 мг/мл) розчин першого, а другого — 2 % (20 мг/мл) розчин.
Хімічна структура проміжного ланцюжка визначає спосіб біотрансформації лікарського засобу, швидкість його метаболізму, тривалість дії та токсичність. Естери є досить нестабільними у розчинах, швидко піддаються розщепленню естеразами (псевдохолінестераза) плазми крові. Таким чином, вони забезпечують короткочасний анальгезуючий ефект. Основним продуктом розпаду складних ефірів є параамінобензоат, який викликає різного роду алергічні реакції, реакції підвищеної чутливості тощо[10]. Заміщені аміди, навпаки, повільно метаболізуються амідазами печінки. Реакції гіперчутливості на аміди виникають досить рідко. У порівнянні з естерними локальними анестетиками, вони починають діяти швидше, краще проникають в тканини, тривалість анальгезії у них довша, вони менше зв'язуються з білками крові, а отже забезпечують краще знеболення. Тому, використання амідних знеболювальних більш поширене у клінічній практиці[11].
Термінальна аміногрупа може існувати у двох формах — третинній та четвертинній. Третинна форма характеризується наявністю трьох зв'язків у атому нітрогену, а четвертинна, відповідно, чотирьох. Як зазначалося вище, ароматичне кільце визначає загальний ступінь розчинності у ліпідах, проте саме кінцевий амін діє як молекулярний «перемикач», від конформації якого розчинність речовини значно змінюється. Залежно від рН середовища, в якому знаходиться місцевий анестетик, термінальна аміногрупа може бути ліпофільною (третинна форма), або ж гідрофільною (іонізована четвертинна форма)[12]. Така амфіфільність місцевих анестетиків надзвичайно важлива у механізмі їхньої дії.
Під час ін'єкції місцеві анестетики перебувають у четвертинній, водорозчинній формі, однак, це попереджає їхнє проникнення крізь біліпідні мембрани нейронів. Тому, початок дії місцевої анестезії визначається моментом, коли певна частина молекул препарату перейшла у третинну, ліпофільну форму під впливом фізіологічного рН — 7,4. Кількісне значення цієї частки залежить від константи дисоціації (рКа) місцевого анестетику. За визначенням, константа дисоціації являє собою рН, при якому 50 % молекул існує у ліпофільній формі, а інші 50 % — у гідрофільній. pKa всіх місцевих анестетиків є вищою за фізіологічний рівень рН (7,4), тому, під час введення більша частка молекул існує водорозчинній формі[13]. Крім того, кисле середовище, пов'язане із запаленими тканинами, сприяє четвертинній, водорозчинній конфігурації. Це викликає додаткові труднощі при необхідності знеболення інфікованих тканини[14].
Як і інші препарати, локальні анестетики суттєво відрізняються за здатністю зв'язуватися з білками плазми крові. Циркулюючи в кров'яному руслі, вони здатні зв'язуватися з α-1-кислим глікопротеїном. З усіх локальних анестетиків, бупівакаїн характеризується найбільшим відсотком зв'язування з білками.
Класифікація
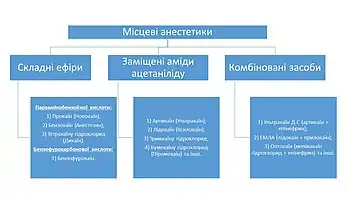
За тривалістю дії:
- короткої (30-45 хв., новокаїн)
- середньої (45-90 хв., лідокаїн, тримекаїн)
- тривалої (від 90 хв., бупівакаїн)
Поділять також за кількістю сполук у розчині:
- поєднані МА (наприклад, убестизин, «синій» ультракаїн)
- моно МА (наприклад, новокаїн, бупівокаїн).
Залежно від природи проміжного ланцюжка молекули місцевого анестетика їх класифікують на:
- складні ефіри
- заміщені аміди кислот
Перелік
Група Естерів
- Бензокаїн (Benzocaine, Americaine, Анестезин)
- Хлоропрокаїн (Chloroprocaine)
- Кокаїн (Cocaine)
- Циклометикаїн
- Dimethocaine (Larocaine)
- Проксиметакаїн (Proxymetacaine, Piperocaine, Propoxycaine, Пропаракаїн)
- Прокаїн (Procaine, Новокаїн(Novocaine))
- Тетракаїн (Тетрокаїн, Tetracaine, Дикаїн (Dicaine), Ametop, Amethocaine, Anethaine, Decicain, Felicain, Foncaine, Intercain, Medicain, Pantocain, Pontocaine, Pontocaine hydrochloride, Rexocaine, Tetracaini hydrochloridum, Tetracaine hydrochloride, Леокаїн)
Група Амідів
- Артикаїн (Articaine, карикаїн, Ультракаїн, Убістезин)
- Бупівакаїн (Bupivacaine, Маркаїн, Мепівокаїн (Mepivacaine), Етідокаїн, Прилокаїн, Лонгокаїн, Сесоркаїн)
- Етидокаїн (Etidocaine)
- Левобупівакаїн (Levobupivacaine, Хірокаїн)
- Лідокаїн (Lidocaine, Lignocaine)
- Мепівакаїн (Mepivacaine, Мепівокаїн)
- Прайлокаїн (Прилокаїн, Prilocaine)
- Ропівакаїн (Наропін, Ropivacaine)
- Цинхокаїн, Совкаїн (Cinchocaine, Оптокаїн, Перкаїн, Цинкаїн, Dibucaine)(токсичний[17])
- Тримекаїн (Trimecaine)
- Ультракаїн; Убістезин
Природні похідні
- Сакситоксин (Saxitoxin)
- Neosaxitoxin
- Tetrodotoxin
- Menthol
- Eugenol
- Кокаїн (Cocaine)
- Spilanthol
Природні місцеві анестетики, що не походять від кокаїну, зазвичай є нейротоксинами, і їх назви мітять суфікс -токсин(-toxin)[18].
Механізм дії
Механізм дії місцевих анестетиків полягає у тому, що вони блокують швидкі потенціал-залежні Na+ канали нервових закінчень та волокон, що унеможливлює розвиток ПД, а також проведення імпульсу до ЦНС.[19] Завдяки гідрофобності молекули, місцевий анестетик проникає у біліпідний шар мембрани нейрона та розташовується там гідрофобною групою до «хвостів» молекул фосфоліпідів, а гідрофільною — до потенціал-залежного Na+ каналу[20]. Важливо, що місцеві анестетики, по-перше, НЕ проходять всередину аксоплазми через сам Na+ канал, а по-друге, що вони НЕ зв'язуються з ним із зовнішньоклітинного боку мембрани. Зв'язування локальних анестетиків з Na+ каналом зумовлює блокаду останнього. Варто зазначити, що така блокада зворотна та тимчасова. Після цього потенціал-залежний Na+ канал не здатен пропускати іони Na+, а отже і не відбувається генерація ПД. Не відбувається генерація ПД тому, що саме притік іонів Na+ всередину нейрона забезпечує деполяризаційну фазу розвитку потенціалу дії, а оскільки надходження іонів Na+ неможливе, то мембрана додатково гіперполяризується завдяки виходу із клітини позитивно заряджених іонів К+. Отже, трансмембранний потенціал знижується, тобто ще більше «віддаляється» від порогового значення — клітина гіперполяризується[21].
Встановлено, що місцеві анестетики блокують не тільки натрієву, але й кальцієву проникність мембрани[22]. Це зумовлює пригнічення активності кальційзалежних АТФ-аз, фосфоліпаз А та С, гальмування виділення нейромедіаторів, порушення окисно-відновних процесів в цитозолі у зв'язку з пригніченням активності цитохромоксидаз, дегідрогеназ, цитохрому С.
Вплив на проведення нервового імпульсу
Проведення збудження по нервових волокнах відбувається стрибкоподібно для мієлінізованих нервових волокон, оскільки потенціал-керовані іонні канали розташовані лише в кілець Ранв'є. Але така передача не обов'язково відбувається від одного сусіднього перехвату на інший, а може «перестрибувати» через 3-4. Це явище називається стрибкоподібним проведенням нервового імпульсу. Відповідно, локальні анестетки унеможливлюють передачу імпульсів по нервових волокнах, блокуючи натрієві канали, ретроградно розташовані по довжині нервового волокна. Блокування понад 5-10 перехватів Ранв'є повністю унеможливлює передачу нервових імпульсів у мієлінізованих волокнах[23]. Проте, за низьких концентрацій анестетику це може і не відбутися, оскільки він швидко руйнується та виводиться.
Дія місцевого анестетика відрізняється в залежності від типу нервового волокна, оскільки різні волокна мають різну чутливість до препарату. Вона залежить від діаметру волокна, його мієлінізації, хімічної структури анестетику тощо. Загалом, А-волокна (мієлінізовані) є більш чутливими у порівнянні з С-волокнами, а аферентні волокна блокуються за нижчих концентрацій місцевоанестезуючих засобів, ніж еферентні[24].
Період напіввиведення та максимальне дозування
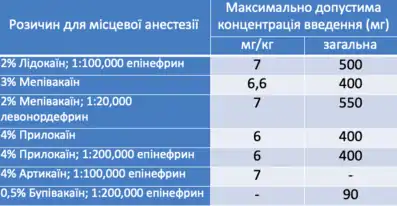
Період напіввиведення місцевих анестетиків з сироватки крові для різних препаратів коливається в межах від 90 хв для лідокаїну, до майже 300 хвилин для засобів, таких як бупівакаїн[25]. Зниження вмісту засобу починається через 20–30 хвилин після досягнення пікової концентрації. Використання вазоконстрикторів подовжує період напіввиведення приблизно на 10-15 хвилин[26].
За оригінальними даними, опублікованими Скоттом[27], підслизова ін'єкція лідокаїну у кількості 400 мг не викликала у пацієнтів токсичних ефектів при стоматологічних втручаннях. Така концентрація місцевого анестетику рівноцінна застосуванню приблизно десятьох стоматологічних картриджів. Під час одного втручання, більше цієї дози місцевого анестетику застосовувати заборонено, але на практиці використовують значно нижчі концентрації препаратів[27]. У таблиці наведено максимальні рекомендовані дози для деяких локальних знеболювальних[28][29].
Додаткове введення місцевих анестетиків, наприклад при тривалому періоді проведення хірургічного втручання, може бути небезпечним, оскільки після першого застосування знеболювального досить складно передбачити періоди пікових концентрацій засобу у крові для кожного додаткового введення. Значна концентрація анестетику може негативно позначитися на здоров'ї пацієнта.
Застосування
- Біль: гострий, хронічний
- Блокади
- Хірургічне лікування
- Діагностичні медичні маніпуляції
- Несистематизовані: встановлення пейсмейкера, імплантаційного дефібрилятора, порту для хімієтерапії, катетерів для гемодіалізу[30]
Ускладнення
Ускладнення, які можуть виникнути при застосуванні місцевих анестетиків різноманітні.
Найчастіше зустрічаються такі:
- Ускладнення загального характеру
- Непритомність
- Колапс
- Ідіосинкразія
- Алергічні реакції, анафілактичний шок
- Інтоксикація анестетиком
- Ускладнення місцевого характеру
- Ушкодження судини (кровотечі)
- Злам голки
- Ішемія шкіри
- Ушкодження нерва, нервового стовбура
- Післяін'єкційні болі та набряк
- Травматична контрактура
- Диплопія
- Нечутливість до дії анестетика (вкрай рідко)
Побічні ефекти
Необгрунтоване дозування та застосування деяких локальних анестетиків, особливо тих, які характеризуються довгою тривалістю дії (бупівакаїн, дикаїн) та тривалим періодом напіввиведення, може призвести до розвитку побічних ефектів, небезпчних для життя та здоров'я пацієнта[31]. Нижче наведено деякі із них.
Тканинна токсичність
Виникнення місцевої тканинної токсичності є можливим при застосуванні усіх сучасних місцевих анестетиків. Найчастіше тканинна токсичність проявляється як ускладнення, пов'язані з неправильним введенням препарату, наприклад травмування голкою тканин, нервів, інтраневральна ін'єкція тощо. Високі концентрації місцевих анестетиків у поєднанні з епінефрином при інтраневральному введенні можуть викликати пошкодження спинного мозку[32].
Алергічні реакції
Алергія на місцеві анестетики, в першу чергу, може розвиватися на препарати складних ефірів. Алергічні реакції на препарати заміщених амідів спостерігаються дуже рідко, проте можуть виникати час від часу . Проявляються у вигляді кропив'янки та інших шкірних висипань, бронхоспазмів, набряків тощо. Зазвичай реакції гіперчутливості розвичаються у відповідь на параамінобензойну кислоту — метаболіт ефірних місцевих анестетиків, та її похідні, наприклад, метилпарабен, сульфаніламідів, бета-лактамів тощо[33].
Системна токсичність
Системна токсичність найчастіше розвивається при випадковому введенні локального анестетику внутрішньовенно, або внутрішньоартеріально. При цьому, його концентрація у плазмі крові значно зростає та через деякий час суттєво перевищує максимально допустиму концентрацію у головному мозку. Місцеві знеболювальні здатні знижувати центральну синаптичну провідність та підсилювати гальмівні процеси в ЦНС. Проявляється системна токсичність у вигляді неспокою, тремору, появою клонічних і тоніко-клонічних судом тощо. Судоми особливо небезпечні, оскільки можуть зумовити виникнення гіпоксії мозку, розвитку якої додатково сприяють порушення скорочення дихальних м'зів (апное)[34]. На фоні гіпоксії місцеві анестетики здатні індукувати процеси закислення тканин (ацидоз), гіперкаліємію тощо. Підвищений ризик виникнення системної токсичності спостерігається під час проведення епідуральної анестезії.
Ураження ЦНС
Шкідливі ефекти локальних анестетиків на головний мозок можуть включати в себе головний біль, запаморочення, сонливість, порушену чутливість. Більш тяжкими проявами ураження ЦНС місцевими анестезуючими засобами є судоми, втрата свідомості, зупинка дихання[35].
Ураження серцево-судинної системи
Слід відзначити, що токсичний вплив на серцевосудинну систему місцевих анестетиків набагато менший ніж загальних анестетиків. Негативний вплив місцевих анестетиків на серцево-судинну систему може проявлятися у вигляді тахікардії, підвищенні артеріального тиску, брадикардії, гіпотонії тощо. При значній інтоксикації може виникнути судинний колапс, тяжка аритмія. Вплив надмірних доз знеболювальних на серцево-судинну систему виявляється також у зниженні збудливості, провідності та сили скорочення міокарда[36]. Бупівакаїн при внутрішньовенному введенні знижує коронарний кровообіг, зменшує опір коронарних судин, зменшує ударний об'єм і тиск у легеневій артерії. Зниження периферичного опору судин зумовлене прямою дією на гладенькі м'язи судин і їх тривалою релаксацією. До проявів токсичної дії місцевих анестетиків слід віднести і їх можливу аритмогенну та кардіодепресивну дію.
Примітки
- Goldstein, Rachel A.; DesLauriers, Carol; Burda, Anthony; Johnson-Arbor, Kelly (2009-02). Cocaine: history, social implications, and toxicity: a review. Seminars in Diagnostic Pathology 26 (1). с. 10–17. ISSN 0740-2570. doi:10.1053/j.semdp.2008.12.001. Процитовано 7 грудня 2020.
- Ю. Л. Кучин та інш., 2016, С.7.
- Nazarov, V. Yu. (2016). Professor Vasiliy Konstantinovich von Anrep. Sudebno-meditsinskaya ekspertiza 59 (4). с. 65. ISSN 0039-4521. doi:10.17116/sudmed201659465-68. Процитовано 7 грудня 2020.
- de Jong, Inge E. M.; Steenbergen, Peter J.; de Kloet, E. Ronald (6 березня 2009). Behavioral sensitization to cocaine: cooperation between glucocorticoids and epinephrine. Psychopharmacology 204 (4). с. 693–703. ISSN 0033-3158. doi:10.1007/s00213-009-1498-3. Процитовано 7 грудня 2020.
- Redman, Melody (2011). Cocaine: What is the Crack? A Brief History of the Use of Cocaine as an Anesthetic. Anesthesiology and Pain Medicine 1 (2). ISSN 2228-7523. doi:10.5812/kowsar.22287523.1890. Процитовано 7 грудня 2020.
- Ayuse, Terumi; Kurata, Shinji; Ayuse, Takao (2020-08).
Successful Dental Treatments Using Procaine Hydrochloride in a Patient Afraid of Local Anesthesia but Consenting for Allergic Testing with Lidocaine: A Case Report
. Local and Regional Anesthesia. Volume 13. с. 99–103. ISSN 1178-7112. doi:10.2147/lra.s268498. Процитовано 7 грудня 2020. - Ю. Л. Кучин та інш., 2016, С.9.
- Vegh, Vladimir; Cizmarik, Jozef; Hahnenkamp, Klaus (2006-10). Is there a place for local anesthetics structurally different from classical amid or ester local anesthetics?. Current Opinion in Anaesthesiology 19 (5). с. 509–515. ISSN 0952-7907. doi:10.1097/01.aco.0000245276.76916.5c. Процитовано 7 грудня 2020.
- Becker, Daniel E; Reed, Kenneth L (1 червня 2012). Local Anesthetics: Review of Pharmacological Considerations. Anesthesia Progress 59 (2). с. 90–102. ISSN 0003-3006. doi:10.2344/0003-3006-59.2.90. Процитовано 7 грудня 2020.
- Breuninger, H. (2001). Local Anesthesia in Children. Tumescent Local Anesthesia. Berlin, Heidelberg: Springer Berlin Heidelberg. с. 204–208. ISBN 978-3-642-63063-7.
- Casati, Andrea; Baciarello, Marco (1 січня 2006). Enantiomeric Local Anesthetics: Can Ropivacaine and Levobupivacaine Improve Our Practice?. Current Drug Therapy 1 (1). с. 85–89. ISSN 1574-8855. doi:10.2174/157488506775268506. Процитовано 7 грудня 2020.
- M. Carness, Jeffrey; J. Lenart, Mark (30 вересня 2020). Current Local Anesthetic Applications in Regional Anesthesia. Topics in Local Anesthetics. IntechOpen. ISBN 978-1-78984-943-1.
- Šimurina, Tatjana (2019). Local Anesthetics and Steroids: Contraindications and Complications - Clinical Update. Acta Clinica Croatica. ISSN 0353-9466. doi:10.20471/acc.2019.58.s1.08. Процитовано 7 грудня 2020.
- Mazoit, JX (1998-01). Techniques d'analgésie conventionnelle: morphiniques et non morphiniques. Indications, effets indésirables et surveillance. Annales Françaises d'Anesthésie et de Réanimation 17 (6). с. 573–584. ISSN 0750-7658. doi:10.1016/s0750-7658(98)80041-5. Процитовано 7 грудня 2020.
- Local Anesthetic Pharmacology. Obstetric Anesthesia Handbook. New York, NY: Springer New York. с. 14–26. ISBN 978-0-387-26075-4.
- Becker, Daniel E.; Reed, Kenneth L. (2006-09). [98:eolap2.0.co;2 Essentials of Local Anesthetic Pharmacology]. Anesthesia Progress 53 (3). с. 98–109. ISSN 0003-3006. doi:10.2344/0003-3006(2006)53[98:eolap]2.0.co;2. Процитовано 5 грудня 2020.
- (рос.)ОБЩИЕ ВОПРОСЫ АНЕСТЕЗИОЛОГИИ И РЕАНИМАЦИИ (С.5,10-11
- (англ.)Neural Blockade in Clinical Anesthesia and Management of Pain, Том 494
- Ю. Л. Кучин та інш., 2016, С.8.
- Mumba, Jesse Musokota; Kabambi, Freddy Kasandji; Ngaka, Christian Tshebeletso (8 лютого 2017). Pharmacology of Local Anaesthetics and Commonly Used Recipes in Clinical Practice. Current Topics in Anesthesiology. InTech. ISBN 978-953-51-2917-2.
- &NA; (2004-09). Lidocaine/prilocaine reduces depot antipsychotic injection-site pain. Inpharma Weekly &NA; (1453). с. 16. ISSN 1173-8324. doi:10.2165/00128413-200414530-00040. Процитовано 7 грудня 2020.
- Thomas, Donna-Ann (2018-10). Local Anesthetics. Oxford Medicine Online. doi:10.1093/med/9780190626761.003.0005. Процитовано 7 грудня 2020.
- Barreveld, Antje; Witte, Jürgen; Chahal, Harkirat; Durieux, Marcel E.; Strichartz, Gary (2013-05). Preventive Analgesia by Local Anesthetics. Anesthesia & Analgesia 116 (5). с. 1141–1161. ISSN 0003-2999. doi:10.1213/ane.0b013e318277a270. Процитовано 7 грудня 2020.
- Ford, Douglas J.; Raj, P. Prithvi; Singh, Pritam; Regan, Karen M.; Ohiweiler, David (1 січня 1984). Differential Peripheral Nerve Block by Local Anesthetics in the Cat. Anesthesiology 60 (1). с. 28–33. ISSN 0003-3022. doi:10.1097/00000542-198401000-00007. Процитовано 7 грудня 2020.
- LeLORIER, JACQUES (1 грудня 1977). Pharmacokinetics of Lidocaine after Prolonged Intravenous Infusions in Uncomplicated Myocardial Infarction. Annals of Internal Medicine 87 (6). с. 700. ISSN 0003-4819. doi:10.7326/0003-4819-87-6-700. Процитовано 7 грудня 2020.
- Abu-Mostafa, N; Al-Showaikhat, F; Al-Shubbar, F; Al-Zawad, K; Al-Zawad, F (2015). Hemodynamic changes following injection of local anesthetics with different concentrations of epinephrine during simple tooth extraction: A prospective randomized clinical trial. Journal of Clinical and Experimental Dentistry. с. e471–e476. ISSN 1989-5488. doi:10.4317/jced.52321. Процитовано 7 грудня 2020.
- Scott, D.B.; Jebson, P.J.R.; Braid, D.P.; Ôrtengren, B.; Frisch, P. (1972-10). FACTORS AFFECTING PLASMA LEVELS OF LIGNOCAINE AND PRILOCAINE. British Journal of Anaesthesia (англ.) 44 (10). с. 1040–1049. doi:10.1093/bja/44.10.1040. Процитовано 7 грудня 2020.
- Gall, H; Kaufmann, R; Kalveram, C (1996-04). Adverse reactions to local anesthetics: Analysis of 197 cases. Journal of Allergy and Clinical Immunology (англ.) 97 (4). с. 933–937. doi:10.1016/S0091-6749(96)80067-4. Процитовано 7 грудня 2020.
- Berkun, Yackov; Ben-Zvi, Amos; Levy, Yaacov; Galili, Dan; Shalit, Meir (2003-10). Evaluation of adverse reactions to local anesthetics: experience with 236 patients. Annals of Allergy, Asthma & Immunology 91 (4). с. 342–345. ISSN 1081-1206. doi:10.1016/s1081-1206(10)61680-8. Процитовано 7 грудня 2020.
- Torpy JM, Lynm C, Golub RM (September 2011). «JAMA patient page. Local anesthesia». JAMA. 306 (12): 1395. doi:10.1001/jama.306.12.1395. PMID 21954483
- Schatz, M (1984-10). Skin testing and incremental challenge in the evaluation of adverse reactions to local anesthetics. Journal of Allergy and Clinical Immunology (англ.) 74 (4). с. 606–616. doi:10.1016/0091-6749(84)90114-3. Процитовано 7 грудня 2020.
- Foster, Craig A.; Aston, Sherrell J. (1983-07). Propranolol-Epinephrine Interaction: A Potential Disaster. Plastic and Reconstructive Surgery (англ.) 72 (1). с. 74–78. ISSN 0032-1052. doi:10.1097/00006534-198307000-00017. Процитовано 7 грудня 2020.
- Adkinson, N. Franklin, Jr. (Newton Franklin), 1943-; Middleton, Elliott, Jr., 1925-1999. (2009). Middleton's allergy : principles & practice. (вид. 7th ed.). Philadelphia, PA: Mosby/Elsevier. ISBN 978-0-323-05659-5. OCLC 228373825.
- Liu, Philip L.; Feldman, Hal S.; Giasi, Robert; Patterson, M. Kay; Covino, Benjamin G. (1983-04). Comparative CNS Toxicity of Lidocaine, Etidocaine, Bupivacaine, and Tetracaine in Awake Dogs Following Rapid Intravenous Administration:. Anesthesia & Analgesia (англ.) 62 (4). с. 375???379. ISSN 0003-2999. doi:10.1213/00000539-198304000-00001. Процитовано 7 грудня 2020.
- Corrigendum. Journal of Neurophysiology 102 (5). 2009-11. с. 3077–3077. ISSN 0022-3077. doi:10.1152/jn.z9k-9775-corr.2009. Процитовано 7 грудня 2020.
- Graf, Bernhard M. (31 липня 2001). The Cardiotoxicity of Local Anesthetics: The Place of Ropivacaine. Current Topics in Medicinal Chemistry (англ.). doi:10.2174/1568026013395164. Процитовано 7 грудня 2020.
Джерела
- Місцеві анестетики: механізм дії, токсичні реакції та їх профілактика. Ю. Л. Кучин, та інш., 2011
- Фармакологія. підручник для студентів стоматологічних факультетів. Чекман І. С., та інш.- Вінниця: Нова Книга, 2014.- 432 с. ISBN 978-966-382-384-3 (C.77-83)
- Місцеві анестетики: сучасний погляд. Ю. Л. Кучин, М. М. Пилипенко, Ю. І. Налапко, Р. Крегг / PainMedicine Journal. - #3, (3), 2016 . - С.7-18. Ел.джерело
- (рос.)Дж. Эдвард Морган-мл., Мэгид С. Михаил. Анестезиология: книга 1-я / Изд. 2-е, испр.— Пер. с англ. — M.—СПб.: Издательство БИНОМ-Невский Диалект, 2001. 396с., ил. Електронне джерело (C.215) Місцеві анестетики
Література
- Анестезіологія та реаніматологія. О. О. Приходько, та інш. (С.401-402)
- Побічна дія засобів для місцевої анестезії при їх клінічному застосуванні / Л. М. Шеремета // Галицький лікарський вісник. — 2014. — Т. 21, число 3. — С. 119—120.
- МУНТЯН О.В. Порівняльна оцінка ефективності засобів та методів місцевого знеболення при лікуванні карієсу зубів та пульпіту / Дисертація на здобуття наукового ступеня к.м.н..- Вінниця, 2016. - 188 с. - Ел.джерело
- Місцеві анестетики: механізм дії, токсичні реакції та їх профілактика. Ю.Л.Кучин, М.М.Пилипенко, Ю.І.Налапко, Р.Крегг / Український журнал екстремальної медицини імені Г.О.Можаєва. - Том 12, No2, 2011. - С.33-47 Ел.джерело
- Місцеве знеболення в стоматології. Профілактика та невідкладні дії при ускладненнях. Фесенко У.А.
- С. В. Зайков, І. П. Кайдашев, Г. Л. Гуменюк (2020). Проблема гіперчутливості до місцевих анестетиків. INFUSION & CHEMOTHERAPY (3): 43–51. doi:10.32902/2663-0338-2020-3-43-51. Процитовано 12 травня 2021.
Посилання
- Анестезувальні препарати // ФЕ
- Лікарські речовини – похідні аміноароматичних кислот та ариламінів 2020
- Застосування місцевої анестезії. Гайдлайн EAPD (Джерело(англ.))