Сахароза
Сахаро́за[2][3][4], іноді цукро́за (від грец. σάκχαρον — «цукор»), також буряковий цукор, тростинний цукор, α-D-глюкопіранозил-β-D-фруктофуранозид, С12Н22О11 — важливий дисахарид. Білий, без запаху, кристалічний порошок з солодким смаком. Найвідоміший і широко застосовується у харчовій промисловості (цукор). Молекула сахарози складається із залишків молекул глюкози і фруктози.
| Сахароза Sucrose | |
|---|---|
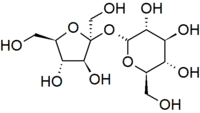 Структурна формула сахарози | |
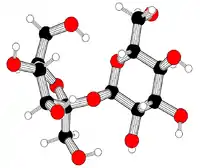 Кульково-паличкова модель сахарози | |
| Назва за IUPAC | (2R,3R,4S,5S,6R)-2-[(2S,3S,4S,5R)-3,4-dihydroxy-2,5-bis(hydroxymethyl)oxolan-2-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol |
| Інші назви | Цукор; Цукроза; β-D-fructofuranosyl-(2→1)-α-D-glucopyranoside; β-(2S,3S,4S,5R)-fructofuranosyl-α-(1R,2R,3S,4S,5R)-glucopyranoside |
| Ідентифікатори | |
| Номер CAS | 57-50-1 |
| PubChem | 5988 |
| Номер EINECS | 200-334-9 |
| Номер EC | 200-334-9 |
| DrugBank | 02772 |
| KEGG | C00089 |
| ChEBI | 17992 |
| RTECS | WN6500000 |
| SMILES |
O1[C@H](CO)[C@@H](O)[C@H](O)[C@@H](O)[C@H]1O[C@@]2(O[C@@H]([C@@H](O)[C@@H]2O)CO)CO |
| InChI |
1/C12H22O11/c13-1-4-6(16)8(18)9(19)11(21-4)23-12(3-15)10(20)7(17)5(2-14)22-12/h4-11,13-20H,1-3H2/t4-,5-,6-,7-,8+,9-,10+,11-,12+/m1/s1 |
| Номер Бельштейна | 1435311 і 90825 |
| Номер Гмеліна | 97695 |
| Властивості[1] | |
| Молекулярна формула | C12H22O11 |
| Молярна маса | 342,30 г/моль |
| Зовнішній вигляд | Білі кристали |
| Густина | 1,587 г/см3 |
| Тпл | 186 °C (розкладається) |
| Розчинність (вода) | 2000 г/л (25 °C) |
| Структура | |
| Кристалічна структура | моноклінна |
| P21 | |
| Небезпеки | |
| MSDS | ICSC 1507 |
| Індекс ЄС | not listed |
| Пов'язані речовини | |
| Пов'язані речовини | Лактоза Мальтоза |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
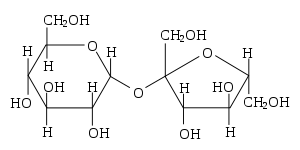
Дуже поширена у природі — синтезується у клітинах усіх зелених рослин і нагромаджується в стеблах, насінні, плодах і коренях рослин. Вміст її в цукровому буряку складає 15-22 %, в цукровій тростині — 12-15 %.[5] Ці рослини є основними джерелами отримання цукрози, звідси виникли і її назви — тростинний цукор і буряковий цукор. Її багато в кленовому і пальмовому соку, в кукурудзі — 1,4-1,8 %, картоплі — 0,6, цибулі — 6,5, моркві — 3,5, дині — 5,9, персиках і абрикосах — 6,0, апельсинах — 3,5, винограді — 0,5 %.[5] Міститься в соку берези та деяких фруктах.
Термін «цукроза» («sucrose») було вперше застосовано в 1857 році англійським хіміком Вільямом Міллером.[6]
Фізичні властивості
Смак солодкуватий. Густина 1,5879 г/см3 (15 °C). Питоме обертання для D-лінії натрію: 66,53 (вода, 35 г/100г; 20 °C). При охолодженні рідким повітрям, після висвітлення яскравим світлом кристал сахарози фосфоресціює.
Кристали сахарози добре розчинні у воді (179 грам на 100 грам при 0 °C і 487 г при 100 °C), погано — у спиртах (0,9 грам на 100 грам при 20 °C), не розчинні в діетиловому ефірі. Цукроза кристалізується без води у вигляді великих моноклінних кристалів.[5]
Піддається гідролізу під дією кислот і ферменту сахарази. В результаті гідролізу розпадається з утворенням молекули глюкози і молекули фруктози. Питоме обертання водного розчину сахарози+66,5о. Фруктоза має сильніше ліве обертання (-92о), ніж глюкоза праве (+52,5о), тому за гідролізу цукрози кут обертання змінюється.[5] Гідроліз сахарози отримав назву інверсії, а суміш утворюваних різних кількостей глюкози і фруктози — інвертним цукром. Після гідролізу сахароза зброджується дріжджами, а при нагріванні вище температури плавлення карамелізується, тобто перетворюється у суміш складних продуктів: карамелана С24Н36О18, карамелена С36Н50О25 і інших, втрачаючи воду.[5] Ці продукти під назвою «колер» використовують у виробництві напоїв і коньяків для забарвлювання готових продуктів.[5]
Використання
Сахароза — цінний харчовий продукт. Її використовують у харчовій та мікробіологічній промисловості для одержання спиртів, лимонної та молочної кислот, поверхнево-активних речовин. Ферментацією цукрози виробляється значний обсяг етилового спирту.
Хімічні властивості
Не проявляє відновлювальних властивостей — не реагує з реактивом Толленса і реактивом Фелінга. Не утворює відкриту форму, тому не проявляє властивостей альдегідів і кетонів.
Наявність гідроксильних груп в молекулі цукрози легко підтверджується реакцією з гідроксидами металів. Якщо розчин сахарози долити до гідроксиду міді(II), утворюється яскраво-синій розчин цукриту міді.
Альдегідної групи в сахарози немає: за нагрівання з аміачним розчином оксиду срібла(I) вона не дає реакцію «срібного дзеркала», за нагрівання з гідроксидом міді(II) не утворює червоного оксиду міді(I). З числа ізомерів цукрози, що мають молекулярну формулу С12Н22О11, можна виділити мальтозу і лактозу.
- Реакція сахарози з водою
Якщо прокип'ятити розчин цукрози з декількома краплями соляної чи сірчаної кислоти і нейтралізувати кислоту лугом, а після цього нагріти розчин, то з'являються молекули з альдегідними групами, які і відновлюють гідроксид міді(II) до оксиду міді(I). Ця реакція показує, що цукроза за каталітичної дії кислоти піддається гідролізу, в результаті чого утворюються глюкоза і фруктоза:
- С12Н22О11 + Н2О → С6Н12O6 (глюкоза) + С6Н12O6 (фруктоза).
- Реакція з гідрооксидом міді
У молекулі сахарози є кілька гідроксильних груп. Тому сполука взаємодіє з гідроксидом міді(II) аналогічно гліцерину і глюкози. За додавання розчину цукрози до осаду з гідроксидом міді(II) він розчиняється, рідина забарвлюється в синій колір. Але на відміну від глюкози цукроза не відновлює гідроксид міді(II) до оксиду міді(I).
Примітки
- Sucrose. International Chemical Safety Card 1507, Geneva: International Programme on Chemical Safety, November 2003
- Губський. Біологічна хімія, 2000. С. 62[недоступне посилання з липня 2019]
- Гонський Я. І., Максимчук Т. П. Біохмія людини: підручник. — Тернопіль: Укрмедкнига, 2001. — 736 с., с. 290 ISBN 966-7364-17-8
- Біохімія: підручник / Л. І. Остапченко та ін. ; упоряд. О. В. Скопенко. — К. :Видавничо-поліграфічний центр «Київський університет», 2012. — 695 с. ISBN 978-966-439-485-4, с. 603
- Скурихин И. М., Нечаев А. П. Все о пище с точки зрения химика: Справ. издание. — М.: Высш.шк. 1991. — 288 с. ISBN 5-06-000673-5
- William Allen Miller, Elements of Chemistry: Theoretical and Practical, Part III. Organic Chemistry (London, England: John W. Parker and son, 1857), сторінки 52 і 54
