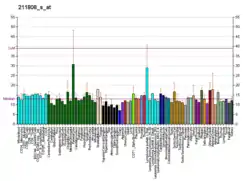
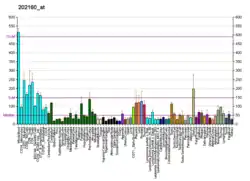
CREBBP
CREBBP (англ. cyclic AMP response element binding protein), CREB-зв'язувальний білок (англ. CREB binding protein) — білок, який кодується однойменним геном, розташованим у людей на короткому плечі 16-ї хромосоми.[4] CREBBP (як і його близький гомолог, EP300, функціонує як транскрипційний коактиватор, тобто за допомогою білок-білкових взаємодій пов'язує різні білкові трансактиватори транскрипції з основним транскрипційним комплексом[5]. Довжина поліпептидного ланцюга білка становить 2 442 амінокислот, а молекулярна маса — 265 351[6]. Вперше дослідники його описали 1993 року[7].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MAENLLDGPP | NPKRAKLSSP | GFSANDSTDF | GSLFDLENDL | PDELIPNGGE | ||||
| LGLLNSGNLV | PDAASKHKQL | SELLRGGSGS | SINPGIGNVS | ASSPVQQGLG | ||||
| GQAQGQPNSA | NMASLSAMGK | SPLSQGDSSA | PSLPKQAAST | SGPTPAASQA | ||||
| LNPQAQKQVG | LATSSPATSQ | TGPGICMNAN | FNQTHPGLLN | SNSGHSLINQ | ||||
| ASQGQAQVMN | GSLGAAGRGR | GAGMPYPTPA | MQGASSSVLA | ETLTQVSPQM | ||||
| TGHAGLNTAQ | AGGMAKMGIT | GNTSPFGQPF | SQAGGQPMGA | TGVNPQLASK | ||||
| QSMVNSLPTF | PTDIKNTSVT | NVPNMSQMQT | SVGIVPTQAI | ATGPTADPEK | ||||
| RKLIQQQLVL | LLHAHKCQRR | EQANGEVRAC | SLPHCRTMKN | VLNHMTHCQA | ||||
| GKACQVAHCA | SSRQIISHWK | NCTRHDCPVC | LPLKNASDKR | NQQTILGSPA | ||||
| SGIQNTIGSV | GTGQQNATSL | SNPNPIDPSS | MQRAYAALGL | PYMNQPQTQL | ||||
| QPQVPGQQPA | QPQTHQQMRT | LNPLGNNPMN | IPAGGITTDQ | QPPNLISESA | ||||
| LPTSLGATNP | LMNDGSNSGN | IGTLSTIPTA | APPSSTGVRK | GWHEHVTQDL | ||||
| RSHLVHKLVQ | AIFPTPDPAA | LKDRRMENLV | AYAKKVEGDM | YESANSRDEY | ||||
| YHLLAEKIYK | IQKELEEKRR | SRLHKQGILG | NQPALPAPGA | QPPVIPQAQP | ||||
| VRPPNGPLSL | PVNRMQVSQG | MNSFNPMSLG | NVQLPQAPMG | PRAASPMNHS | ||||
| VQMNSMGSVP | GMAISPSRMP | QPPNMMGAHT | NNMMAQAPAQ | SQFLPQNQFP | ||||
| SSSGAMSVGM | GQPPAQTGVS | QGQVPGAALP | NPLNMLGPQA | SQLPCPPVTQ | ||||
| SPLHPTPPPA | STAAGMPSLQ | HTTPPGMTPP | QPAAPTQPST | PVSSSGQTPT | ||||
| PTPGSVPSAT | QTQSTPTVQA | AAQAQVTPQP | QTPVQPPSVA | TPQSSQQQPT | ||||
| PVHAQPPGTP | LSQAAASIDN | RVPTPSSVAS | AETNSQQPGP | DVPVLEMKTE | ||||
| TQAEDTEPDP | GESKGEPRSE | MMEEDLQGAS | QVKEETDIAE | QKSEPMEVDE | ||||
| KKPEVKVEVK | EEEESSSNGT | ASQSTSPSQP | RKKIFKPEEL | RQALMPTLEA | ||||
| LYRQDPESLP | FRQPVDPQLL | GIPDYFDIVK | NPMDLSTIKR | KLDTGQYQEP | ||||
| WQYVDDVWLM | FNNAWLYNRK | TSRVYKFCSK | LAEVFEQEID | PVMQSLGYCC | ||||
| GRKYEFSPQT | LCCYGKQLCT | IPRDAAYYSY | QNRYHFCEKC | FTEIQGENVT | ||||
| LGDDPSQPQT | TISKDQFEKK | KNDTLDPEPF | VDCKECGRKM | HQICVLHYDI | ||||
| IWPSGFVCDN | CLKKTGRPRK | ENKFSAKRLQ | TTRLGNHLED | RVNKFLRRQN | ||||
| HPEAGEVFVR | VVASSDKTVE | VKPGMKSRFV | DSGEMSESFP | YRTKALFAFE | ||||
| EIDGVDVCFF | GMHVQEYGSD | CPPPNTRRVY | ISYLDSIHFF | RPRCLRTAVY | ||||
| HEILIGYLEY | VKKLGYVTGH | IWACPPSEGD | DYIFHCHPPD | QKIPKPKRLQ | ||||
| EWYKKMLDKA | FAERIIHDYK | DIFKQATEDR | LTSAKELPYF | EGDFWPNVLE | ||||
| ESIKELEQEE | EERKKEESTA | ASETTEGSQG | DSKNAKKKNN | KKTNKNKSSI | ||||
| SRANKKKPSM | PNVSNDLSQK | LYATMEKHKE | VFFVIHLHAG | PVINTLPPIV | ||||
| DPDPLLSCDL | MDGRDAFLTL | ARDKHWEFSS | LRRSKWSTLC | MLVELHTQGQ | ||||
| DRFVYTCNEC | KHHVETRWHC | TVCEDYDLCI | NCYNTKSHAH | KMVKWGLGLD | ||||
| DEGSSQGEPQ | SKSPQESRRL | SIQRCIQSLV | HACQCRNANC | SLPSCQKMKR | ||||
| VVQHTKGCKR | KTNGGCPVCK | QLIALCCYHA | KHCQENKCPV | PFCLNIKHKL | ||||
| RQQQIQHRLQ | QAQLMRRRMA | TMNTRNVPQQ | SLPSPTSAPP | GTPTQQPSTP | ||||
| QTPQPPAQPQ | PSPVSMSPAG | FPSVARTQPP | TTVSTGKPTS | QVPAPPPPAQ | ||||
| PPPAAVEAAR | QIEREAQQQQ | HLYRVNINNS | MPPGRTGMGT | PGSQMAPVSL | ||||
| NVPRPNQVSG | PVMPSMPPGQ | WQQAPLPQQQ | PMPGLPRPVI | SMQAQAAVAG | ||||
| PRMPSVQPPR | SISPSALQDL | LRTLKSPSSP | QQQQQVLNIL | KSNPQLMAAF | ||||
| IKQRTAKYVA | NQPGMQPQPG | LQSQPGMQPQ | PGMHQQPSLQ | NLNAMQAGVP | ||||
| RPGVPPQQQA | MGGLNPQGQA | LNIMNPGHNP | NMASMNPQYR | EMLRRQLLQQ | ||||
| QQQQQQQQQQ | QQQQQQGSAG | MAGGMAGHGQ | FQQPQGPGGY | PPAMQQQQRM | ||||
| QQHLPLQGSS | MGQMAAQMGQ | LGQMGQPGLG | ADSTPNIQQA | LQQRILQQQQ | ||||
| MKQQIGSPGQ | PNPMSPQQHM | LSGQPQASHL | PGQQIATSLS | NQVRSPAPVQ | ||||
| SPRPQSQPPH | SSPSPRIQPQ | PSPHHVSPQT | GSPHPGLAVT | MASSIDQGHL | ||||
| GNPEQSAMLP | QLNTPSRSAL | SSELSLVGDT | TGDTLEKFVE | GL |
Кодований геном білок за функціями належить до ацилтрансфераз, є активатором, має сайти фосфорилювання. Має сайт для зв'язування з іоном цинку. Задіяний у таких біологічних процесах, як регуляція транскрипції, ацетилювання гістонів та негістонових білків, керування біологічними ритмами, взаємодія хазяїн-вірус тощо.
Локалізований у цитоплазмі, ядрі.
Ген
Ген CREBBP у людини розташований на 16-й хромосомі і займає локус 16p13.3. Ген містить 34 екзони і експресується повсюдно[8], зокрема і на ембріональному етапі розвитку. Ген розташований на мінус-ланцюгові[9]. Довжина гена становить близько 190 тисяч пар основ (kb), транскрипція йде від центромери до теломери. Довжина мРНК становить 8,7 kb, з яких на кодувальну послідовність припадає 7,3 kb[10].
Гомологи CREBBP є у багатьох багатоклітинних організмів, зокрема мух, черв'яків і рослин, однак відсутні в нижчих еукаріот, наприклад, дріжджів[11]. У даніо-реріо патерни експресії CREBBP і його метилування відіграють роль у ході розвитку організму[12]. У ящірки анолісу каролінського експресія CBP різна у двох статей[13].
Структура
CREBBP — це білок з молекулярною масою 265 кДа[14], який складається з 2442 амінокислот. Локалізується в ядрі[10]. За будовою він дуже схожий на гомологічний[10] білок p300, разом з яким CBP становить родину коактиваторів p300-CBP[11].
Значна частина функціональних доменів цих двох білків високо консервативна. Серед цих доменів 4 відомі трансактиваційні домени (TAD):
- Перша цистеїн/гістидин-збагачена ділянка (CH1), у яку входить транскрипційний адаптерний цинковий палець 1 (англ. transcriptional adapter zinc finger 1, TAZ1);
- Домен KIX, який взаємодіє з CREB;
- Ще одна цистеїн/гістидин-збагачена ділянка (СН3), що містить цинковий палець TAZ2 і цинковий палець типу ZZ;
- Коактиваторний зв'язувальний домен ядерних рецепторів (англ. nuclear receptor co-activator binding domain, NCBD), також відомий як інтерферон-зв'язуючий домен (англ. interferon-binding domain, IBiD). Ці TAD забезпечують різні білок-білкові взаємодії CBP з ДНК-зв'язувальними факторами транскрипції, ключовими компонентами транскрипційної машинерії та іншими коактиваторами транскрипції (докладніше див. нижче).
Крім того, і p300, і CBP також містять домен з гістонацетилтрансферазною активністю (НАТ), який ацилює гістони та інші білки. Поруч з ним перебуває бромодомен, який зв'язується з ацильованими амінокислотними залишками лізину і може залучати CBP до специфічних сайтів на хромосомах . Поруч з каталітичною ділянкою розташовується ще одна цистеїн / гістидин-збагачена ділянка (CH2), що включає бромодомен і PHD-палець, який зв'язується з коферментом А. Наявність цього мотиву унікальна для CBP, він відсутній в інших білків з гістонацетилтрансферазною активністю[11][15][16].

Дія на клітинному рівні
Ген CREBBP експресується повсюдно і бере участь у транскрипційній коактиваціі багатьох факторів транскрипції. Білок CREBBP вперше був описаний як ядерний білок, який зв'язується білком CREB. Цей ген, як тепер відомо, відіграє важливу роль в ембріональному розвитку, контролі зростання і підтримці гомеостазу[17]. Показано, що миші, у яких нокаутований ген CREBBP або EP300, який кодує білок Р300, гинуть на ранніх етапах розвитку[18][19]. Крім того, миші, у яких був тільки один функціональний алель кожного з генів CREBBP і EP300 замість двох, також гинули в ході ембріогенезу. Вірогідно, для розвитку ембріона критичне значення має загальний сумарний вміст білків CBP і p300, який в обох випадках становив половину від нормального[18]. На відміну від організму в цілому, окремі клітини можуть розвиватися за відсутності білку CBP або p300. Наприклад, у мишей В- і Т-клітини, позбавлені або CBP, або P300, розвивалися нормально в умовах in vivo, а позбавлені обох білків одночасно гинули[20][21].
CBP, як і p300, підвищує експресію генів-мішеней за допомогою таких основних механізмів:
- Релаксація хроматину в області промоторів за допомогою ацилювання гістонів;
- Рекрутування ключових елементів транскрипційного комплексу, зокрема РНК-полімерази II, до промоторів;
- Функціонування як опорного білка (білка скефолда) для стабілізації взаємодій інших факторів транскрипції з транскрипційним комплексом[22].
| CBP, пов'язаний з CREB, поблизу промотора гена-мішені | |
CBP, як і p300, переважно ацилює N-кінцеві хвости гістонів, а саме залишки K12 (лізин 12) і K15 гістона H2B, K14 і K18 гістона H3 і K5 і K8 гістона H4. Однак CBP ацилює не лише гістони, а й негістонові білки, такі як різні чинники і коактиватори транскрипції. Ці модифікації можуть змінювати білок-білкові взаємодії, взаємодії білків з ДНК, а також ядерну локалізацію білків. Інші важливі партнери CBP і p300 — білки реплікації і репарації ДНК, зокрема, PCNA, FEN1, POLB, TDG. Крім того, CBP і p300 можуть взаємодіяти і з білками, які не мають безпосереднього відношення до хроматину, зокрема, з цикліном Е і циклін-залежною кіназою 2, тим самим беручи участь у регуляції клітинного циклу. CBP і p300 беруть участь в регуляції руйнування транскрипційного фактора p53. Показано, що регіон CH-1 CBP і може проявляти напівубіквітинлігазну активність p53, тим самим безпосередньо впливаючи на його деградацію. Нарешті, CBP, як і p300, можуть ацетилювати білки, пов'язані з ядерним транспортом, зокрема, KPNA2 та імпортин-α7[11].
CBP використовується як білок скефолда багатьма транскрипційними факторами, серед яких JUN, c-myb, MYOD1, E2F1, YY1, а також члени надродини рецепторів стероїдних гормонів (повний список білків, з якими взаємодіє CBP, див. нижче)[23].
Результати останніх (станом на 2009 рік) досліджень показали, що CBP-опосередковане посттрансляційне N-глікозилювання змінює конформацію білків, що взаємодіють з CBP, регулюючи таким чином експресію генів, клітинний ріст і диференціацію[24].
Фізіологічні функції
CBP задіяний у сигнальних шляхах G-білків і через них бере участь у відповіді клітини на зв'язування адреналіну. Деякі G-білки в активованому стані стимулюють аденілатциклазу, внаслідок чого рівень цАМФ у клітині підвищується. цАМФ активує протеїнкіназу А (PKA), яка складається з чотирьох субодиниць: двох регуляторних і двох каталітичних. Зв'язування цАМФ з регуляторними субодиницями викликає звільнення каталітичних субодиниць, які внаслідок цього можуть переміститися в ядро і взаємодіяти з транскрипційними факторами, таким чином впливаючи на експресію генів. Транскрипційний фактор CREB зв'язується з послідовністю ДНК, що має назву елемент відгуку на цАМФ (CRE). Він фосфорилюється протеїнкіназою A по залишку серину (Ser 133) в домені KID. Ця модифікація стимулює взаємодію домену KID CREB з доменом KIX CBP або p300, внаслідок чого посилюється транскрипція генів, підконтрольних CREB, зокрема і тих, які беруть участь у глюконеогенезі. Цей сигнальний шлях запускається при зв'язуванні адреналіну з клітиною-мішенню[25].
Величезна кількість експериментальних даних свідчать про ключову роль ацетилювання гістонів у пластичності синапсів у ссавців (зокрема довготривалої потенціації), пам'яті та поведінкової адаптації до навколишнього середовища. Початкові свідоцтва пов'язані зі спостереженням, що стосуються хворих синдромом Рубінштейна — Тейбі: у них мутації, що зачіпають CBP, призводять до розумової відсталості. Крім того, миші, мутантні за CREBBP, мали порушення довготривалої пам'яті[26]. Подальші експерименти показали, що CBP важливий не для нейронної пластичності, але й для виживання нейронів, пов'язаного з їхньою активністю[27], і нейрогенезом[28].
Порушення з боку імунної системи, які проявляються у пацієнтів з синдромом Рубінштейна — Тейбі, свідчать про важливу роль CBP у функціонуванні імунної системи і запальних процесах. Ймовірно, цей ефект обумовлений ненормально зниженою експресією таких важливих для імунітету білків, як CREB, NF-κB, c-jun, c-Fos, BCL2 і c-Myc, обумовленою відсутністю активності CBP[29]. Справді, регулюючи активність транскрипційних факторів NF-κB і AP-1, які активують гени, пов'язані з хронічним і гострим запаленням, CBP може відігравати важливу роль у контролі запалення на рівні транскрипції[30]. Встановлено, що CBP задіяний в експресії білка CD59, який бере участь у захисті клітин організму від атак з боку системи комплементу[31].
CBP відіграє важливу роль у функціонуванні жіночої репродуктивної системи. На мишах показано, що він необхідний для експресії лютеїнізуючого гормону-бета і підтримки нормальної фертильності[32]. Крім того, CBP необхідний для експресії генів-мішеней лютеїнізуючого гормону під час овуляції[33]. Він також бере участь у клітинній відповіді на зв'язування естрогену[34].
CBP і p300 відіграють важливу роль у функціонуванні фоторецепторів (паличок і колбочок): колбочко-паличковий гомеобоксовий білок (англ. cone-rod homeobox protein, CRX) залучає їх до промоторів необхідних генів, де вони ацетилюють гістони і сприяють їх експресії. Цікаво, що нокаут одного з генів CREBBP і EP300 не чинив майже ніякого ефекту на фоторецепторні клітини, а нокаут обох генів сильно змінював їхню морфологію і функціонування. Такий ефект був пов'язаний зі зниженням ацетилювання гістонів H3 і H4, що є наслідком дисфункції і p300[35].
Показано можливість участі CBP в адипогенезі[36].
Регуляція
Ацетилтрансферазна активність CBP позитивно регулюється фосфорилюванням MAP-кінази MAPK1/MAPK3, Cdk2 і протеїнкіназою А. При цьому фосфорилювання консервативного залишку серину в положенні 89 (S89) протеїнкіназою C-δ знижує ацетилтрансферазну активність CBP. Ацетилтрансферазна активність CBP може змінюватися (як в позитивний, так і в негативний бік) при взаємодії з іншими білками. Наприклад, вона посилюється при взаємодії з такими транскрипційними факторами, як C/EBP-α, NFE2 і HNF-1α і знижується при взаємодії з транскрипційним фактором PU.1. При цьому всі перераховані білки взаємодіють з одним і тим самим сайтом CBP — ділянкою CH3. Механізми того, як білки, які взаємодіють з CBP в одному і тому ж сайті, впливають на його активність протилежним чином, станом на 2017 рік не зрозумілі[11].
Станом на 2017 рік розробляються штучні інгібітори CBP, деякі з яких можуть знайти потенційне застосування в медицині (наприклад, ICG-001 пригнічує ріст ракових клітин у підшлунковій залозі[37]). Інгібітори можуть зв'язуватися, наприклад, з бромодоменом CBP[38][39].
Клінічне значення
Синдром Рубінштейна — Тейбі
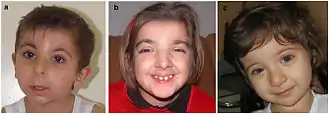
Мутації в гені CREBBP викликають синдром Рубінштейна — Тейбі (RTS)[40]. Однак RTS може розвиватися і при мутаціях гена EP300. Пацієнти з RTS характеризуються множинними вродженими вадами, відставанням у розумовому і післяродовому розвитку, мікроцефалією, характерними лицьовими аномаліями, широкими, часто загостреними пальцями рук і збільшеними пальцями ніг. Частота розповсюдженості цього захворювання становить 1 випадок на 100 тисяч-125 тисяч новонароджених[41]. Зазвичай пацієнти з RTS мають підвищений ризик розвитку пухлин. У людини фенотипи, які проявляються при гаплонедостатності по CREBBP і при дрібних делеціях і мутаціях, що призводять до утворення укороченої форми білка, не розрізняються. У мишей гетерозиготна делеція або вкорочення CBP призводить до фенотипу, який нагадує RTS. Список описаних мутацій CREBBP, що призводять до розвитку RTS, постійно поповнюється[42][43]. У загальному випадку до RTS призводять ті мутації CREBBP, які пригнічують його гістонацетилтрансферазну активність[11].
Гострий мієлоїдний лейкоз
Хромосомні транслокації, що зачіпають CREBBP, пов'язують з гострим мієлоїдним лейкозом (AML)[17][44]. До AML також можуть призводити транслокації в EP300. Ба більше, транслокації, що зачіпають CREBBP і викликають AML, можуть бути наслідком протиракової хіміотерапії (наприклад, при лікуванні раку молочної залози)[45]. У разі цих збалансованих транслокацій 5'-кінець генів MLL, MOZ або MORF зшивається з 3'-кінцем гена CBP або p300, і навпаки. Це призводить до утворення химерних білків, наприклад, MLL-CBP і CBP-MLL. Химерні білки, у яких CBP (p300) зливається з іншим своїм C-кінцем (MLL–CBP, MLL–p300, MOZ–CBP, MOZ–p300, MORF–CBP), мабуть, відіграють ключову роль у розвитку лейкемій, а матричні РНК, що кодують зворотні білки (наприклад, CBP-MLL), у пацієнтів з AML не виявлені. На відміну від RTS, при якому CBP і p300 нефункціональні, в разі описаних вище транслокацій HAT-домени CBP і p300 залишаються інтактними в химерних білках. Однак CBP і p300 починають працювати неправильно (наприклад, вони працюють не з тими послідовностями), тому у випадку AML мають місце мутації набуття, а не втрати функції[11].
Інші ракові захворювання
На відміну від p300, який є класичним супресором пухлин, ситуація з CBP менш зрозуміла. З одного боку, схильність до пухлиноутворення у пацієнтів з RTS, а також той факт, що і CBP, і p300 є мішенями вірусів, що змінюють ДНК (аденовірус, SV40, вірус папіломи людини), говорить про те, що CBP теж може функціонувати як пухлинний супресор. Однак у тих пухлинних клітинах, у яких були мутації в CREBBP, мутованою виявився тільки один аллель, інший залишився інтактним і функціональним. Це суперечить уявленню про CBP як про класичний пухлинний супресор[11]. Роль CBP показано в таких видах раку, як рак товстої кишки[46], легень[47][48], підшлункової залози[37] та інших ракових захворюваннях.
Встановлено, що CBP-залежний сигнальний шлях Wnt / β-Катенін перебуває в постійно активованому стані в ракових клітинах, що стійкі до дії протипухлинного препарату доксорубіцину. Порушення взаємодії CBP з β-катеніном, що зупиняє роботу сигнального шляху, фармакологічним шляхом може відновити чутливість ракових клітин до цього препарату і поліпшити прогноз для пацієнта[49]. Крім того, показано, що інгібітор комплексу CREB-CBP, нафтол-AS-TR-фосфату, можна застосовувати для лікування раку легень[50].
Порушення з боку нервової системи
Багато нейродегенеративних захворювань людини (хорея Гантінгтона (HD), синдром Кенеді та інші) пов'язані з подовженням області поліглутамінових повторів у певних білках (зокрема, гантінгтіні в разі HD і андрогеновому рецепторі при синдромі Кенеді), яке призводить до утворення нерозчинних агрегатів. Вони можуть зв'язуватися з поліглутаміновими трактами нормальних білків, зокрема, CBP, який має ділянку з 18 залишків глутаміну (залишки 2199—2216) у своєму Q-збагаченому C-кінці. При зв'язуванні з такими агрегатами відбувається інактивація CBP, яка, мабуть, і обумовлює їх токсичність: ектопічна надекспресія CBP зменшувала смертність клітин в культурі, викликану утворенням глутамінових агрегатів. Експерименти з дрозофілами показали, що розвиток нейродегенеративного фенотипу пригнічувався при обробці інгібіторами деацетилаз, що є доказом необхідності гістонацетилтрансферазної функції CBP для запобігання розвитку нейродегенеративних захворювань[11].
Показано участь CBP (і p300) в апоптозі нейронів, який відбувається при хворобі Альцгеймера (AD). Передбачається, що при цьому CBP руйнується каспазою-6, що знижує рівень ацетилювання гістонів. Цікаво, що збільшення вмісту CBP пов'язане з раннім розвитком AD. Продемонстровано, що опосередковане пресеніліном-1 розрізання N-кадгеринів призводило до утворення пептиду N-Cad / CTF2, який в цитоплазмі зв'язується з CBP і сприяє його протеасомному руйнуванню. Зменшення кількості CBP призводить до пригнічення транскрипції генів, які активуються CREB. Варто відзначити, що мутації пресеніліна-1 спостерігаються при сімейних формах AD, причому вони можуть призводити як втрати, так і набуття функції CBP[11]. Крім того, показано, що CBP функціонує як регулятор циркадних ритмів, і його руйнування, індуковане бета-амілоїдом, призводить до порушення циркадних ритмів при AD[51]. Є дані, що свідчать про зв'язок CBP з розвитком бічного аміотрофічного склерозу. Передбачають, що препарати, які компенсують втрату функції CBP, можна застосовувати в лікуванні нейродегенеративних захворювань[52].
Є дані, що порушення гістонацетилтрансферазної активності CBP викликає проблеми при формуванні довготривалої пам'яті[53].
CBP може бути залучений у розвиток деяких психіатричних порушень. Дослідження 2012 року показало, що однонуклеотидні поліморфізми в гені CREBBP можуть бути асоційовані з розвитком шизофренії[54], значного депресивного розладу і біполярного афективного розладу і впливати на відповідь пацієнтів на лікування[55]. Ба більше, поліморфізми в цьому гені можуть бути пов'язані з чутливістю до наркотичних речовин, наприклад, героїну, а також алкоголю, і слугувати факторами розвитку звикання до них[56]. В прилеглому ядрі CBP регулює індуковане кокаїном ацетилювання гістонів і необхідний для розвитку поведінкових реакцій, пов'язаних з вживанням кокаїну[57].
Інші захворювання
CBP і p300 часто є мішенями вірусів[23]. Наприклад, показано, що коров'ячий білок вірусу гепатиту B підсилює транскрипцію генів, підконтрольних CRE, діючи на шлях CRE/CREB/CBP[58].
У 2012 році було показано участь CBP в розвитку муковісцидоз а[59].
Взаємодії з іншими білками
У таблиці нижче перераховані ключові білки, які взаємодіють з різними доменами CREBBP[16].
| Домен | Білки, які з ним взаємодіють | Група |
|---|---|---|
| TAZ1 | TBP p53 FOXO3 HIF1A CITED2 STAT2[16] | загальний транскрипційний фактор транскрипційний фактор транскрипційний фактор транскрипційний фактор транскрипційний фактор транскрипційний фактор |
| KIX (сайт c-Myb) | CREB c-Myb p53 FOXO3a[16] | транскрипційний фактор транскрипційний фактор транскрипційний фактор транскрипційний фактор |
| KIX (сайт MLL) | MLL p53 FOXO3a HTLV-1HBZ C-jun E2A HTLV-1 Tax | транскрипційний фактор транскрипційний фактор транскрипційний фактор транскрипційний фактор транскрипційний фактор транскрипційний фактор Вірусний білок |
| KIX (два сайти) | p53 FOXO3a | транскрипційний фактор транскрипційний фактор |
| KIX (сайт зв'язування невідомий) | BRCA1 SREBP | транскрипційний фактор транскрипційний фактор |
| бромодомен | Гістон H4 p53 | гістон транскрипційний фактор |
| TAZ2 | E1A TFIIB KAT2B GCN5 p53 FOXO3a STAT1 MEF2 | білок аденовірусу Загальний транскрипційний фактор Коактиватор Коактиватор транскрипційний фактор транскрипційний фактор транскрипційний фактор транскрипційний фактор |
| NCBD (IBid) | p53 IRF3 ACTR[16] | транскрипційний фактор транскрипційний фактор Коактиватор |
| Мотиви LXXLL | Ретиноїдний X-рецептор Естрогеновий рецептор Андрогенний рецептор[16] | ядерний рецептор Ядерний рецептор Ядерний рецептор |
Література
- Yang X.-J., Ogryzko V.V., Nishikawa J., Howard B.H., Nakatani Y. (1996). A p300/CBP-associated factor that competes with the adenoviral oncoprotein E1A.. Nature 382: 319 — 324. PubMed DOI:10.1038/382319a0
- Bex F., Yin M.-J., Burny A., Gaynor R.B. (1998). Differential transcriptional activation by human T-cell leukemia virus type 1 Tax mutants is mediated by distinct interactions with CREB binding protein and p300.. Mol. Cell. Biol. 18: 2392 — 2405. PubMed DOI:10.1128/MCB.18.4.2392
- Zhang W., Bieker J.J. (1998). Acetylation and modulation of erythroid Krueppel-like factor (EKLF) activity by interaction with histone acetyltransferases.. Proc. Natl. Acad. Sci. U.S.A. 95: 9855 — 9860. PubMed DOI:10.1073/pnas.95.17.9855
- Johnston H., Kneer J., Chackalaparampil I., Yaciuk P., Chrivia J. (1999). Identification of a novel SNF2/SWI2 protein family member, SRCAP, which interacts with CREB-binding protein.. J. Biol. Chem. 274: 16370 — 16376. PubMed DOI:10.1074/jbc.274.23.16370
- Doucas V., Tini M., Egan D.A., Evans R.M. (1999). Modulation of CREB binding protein function by the promyelocytic (PML) oncoprotein suggests a role for nuclear bodies in hormone signaling.. Proc. Natl. Acad. Sci. U.S.A. 96: 2627 — 2632. PubMed DOI:10.1073/pnas.96.6.2627
- Chen H., Lin R.J., Xie W., Wilpitz D., Evans R.M. (1999). Regulation of hormone-induced histone hyperacetylation and gene activation via acetylation of an acetylase.. Cell 98: 675 — 686. PubMed DOI:10.1016/S0092-8674(00)80054-9
Примітки
- Захворювання, генетично пов'язані з CREBBP переглянути/редагувати посилання на ВікіДаних.
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:2348 (англ.). Процитовано 11 вересня 2017.
- PMID 9343424 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - UniProt, Q92793 (англ.). Процитовано 11 вересня 2017.
- PMID 8413673 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - NCBI. CREBBP CREB binding protein [ Homo sapiens (human) ].
- GenAge entry for CREBBP (Homo sapiens).
- Jean-Loup Huret. CBP (CREB-binding protein) // Atlas of Genetics and Cytogenetics in Oncology and Haematology. — 2000. — DOI:.
- PMID 15313412 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 26260685 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 26363452 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 7606928 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 15479634 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 23307074 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - Entrez Gene: CREBBP (CREB-binding protein).
- PMID 9590171 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10906457 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 16428436 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 16424387 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10887150 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 9238849 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 19578754 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 11483993 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 21673711 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 12909086 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 21847097 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 23643710 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 12168567 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 24338025 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 22508984 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 24878634 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 22083956 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 23922782 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 26113042 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 25082960 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 26043365 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 26125948 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 7630403 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 23162289 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 26275701 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 25805166 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 12619164 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 25548695 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 26217075 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 26318425 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 24551300 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 25968898 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 25897662 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 25888034 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 15313413 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 15207240 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 22198373 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 22386572 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 21752352 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 22114264 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 25936964 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 22467641 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота.