Azotobacter
Azotobacter — рід звичайно рухомих, овальних або сферичних вільноживучих грам-негативних бактерій-діазотрофів, що в несприятливих умовах формують оточені товстою стінкою цисти та можуть виробляти значну кількість капсулярного слизу. Представники роду знайдено перш за все у нейтральних та лужних ґрунтах[1][2], у водних оточеннях і в асоціації з деякими рослинами[3][4]. Представники роду мають кілька важливих метаболічних здібностей, зокрема вони фіксують азот, прететворюючи його на аміак. Деякі види Azotobacter мають найвищу швидкість метаболізму серед всіх відомих організмів.
? Azotobacter | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Циста Azotobacter | ||||||||||||||
| Біологічна класифікація | ||||||||||||||
| ||||||||||||||
Види | ||||||||||||||
| ||||||||||||||
Посилання | ||||||||||||||
| ||||||||||||||
Представники Azotobacter широко вивчаються і як модельний організм, і через можливе застосування у біотехнології. Їх унікальна система трьох ферментів нітрогеназ робить цих бактерій дуже цікавими для вчених, що вивчають фіксацію азоту. Вони потенційно можуть застосовуватися для виробництва альгінової кислоти, штучної фіксації азоту[5][6] та виробництва деяких біополімерів.
Перший представник роду, Azotobacter chroococcum, був відкритий і описаний в 1901 році голландським мікробіологом і ботаніком Мартінусом Бейєрінком. Зараз до складу роду входять шість видів.
Біологічні властивості
Морфологія

Клітини бактерій роду Azotobacter середнього розміру (1—2 мікрон в діаметрі), зазвичай овальні, але володіють плеоморфізмом, тобто можуть мати різну форму — від паличкоподібної до сферичної. На мікроскопічних препаратах клітини можуть розташовуватися поодинці, парами, неправильними скупченнями або, зрідка, ланцюжками різної довжини. Також можуть формувати сплячі форми — цисти, тоді як справжніх спор не утворюють.
В культурі клітини рухомі за допомогою численних джгутиків[7]. За погіршенням умов клітини втрачають рухливість, набувають майже кокоподібної форми і утворюють товстий шар слизу, що формує капсулу клітини. На форму клітини також впливає наявність деяких хімічних компонент середовища — пептон, наприклад, викликає плеоморфізм та індукує утворення так званих «грибоподібних» кліток. Індукуючий вплив на плеоморфізм в культурах представників роду у складі пептону надає амінокислота гліцин[8].
При мікроскопії в клітинах спостерігаються включення, частина з яких забарвлюється багатьма барвниками (наприклад, залізним гематоксиліном), а частина залишається безбарвною. На початку 20 століття вважалося, що зафарбовані включення є «репродуктивними гранулами» (гонідіями) і беруть участь в розмноженні клітини, виконуючи роль своєрідних «зародокових клітин»[9], хоча пізніше ця гіпотеза була спростована[10]. Зараз відомо, що зафарбовані гранули складаються з волютину (типу нуклеопротеїнів), а безбарвні є краплями жиру. Оскільки ніякої іншої функції гранул показано не було, вважається, що вони є резервним джерелом живлення[11].
Цисти
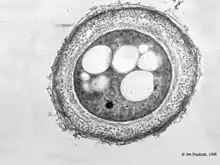
Цисти представників роду Azotobacter стійкіші до дії несприятливих факторів зовнішнього середовища, ніж вегетативні клітини — так, цисти в два рази стійкіші до дії ультрафіолетового випромінювання, стійкіші до висушування, гамма-випромінювання, сонячної радіації, дії ультразвуку, проте не є стійкими до дії високих температур[12].
Формування цист (інцистування) індукується зміною концентрації поживних речовин в живильному середовищі і додаванням деяких органічних речовин (наприклад етанолу, н-бутанолу і β-гідроксибутірату). Цисти рідко утворюються в рідких живильних середовищах[13]. Утворення цист супроводжується метаболічними змінами, зокрема змінами в катаболізмі, диханні і біосинтезі макромолекул[14]. В процесі утворення цисти беруть участь багато білків клітини, зокрема певне значення мають альдегіддегідрогеназа[15] та регулятор відповіді AlgR[16].
Циста Azotobacter — сферичне тіло, що складається з так званого центрального тіла: зменшеної копії вегетативної клітини з великою кількістю вакуолей, і двошарової оболонки, внутрішня частина якої називається інтима і має волокнисту будову[17], а зовнішня називається екзина і представлена рівною структурою, що оточує цисту та має гексагональну кристалічну будову[18]. Екзина частково гідролізуєтся трипсином і стійка до дії лізоциму, на відміну від центрального тіла[19]. Центральне тіло може бути ізольоване в життєздатному стані деякими хелатуючими агентами[20]. Головними компонентами зовнішньої оболонки цисти є алкілрезорціноли, що складаються з довгих аліфатичних ланцюжків і ароматичних кілець, ці речовини зустрічаються також у інших бактерій, тварин і рослин[21].
Проростання цист
Цисти Azotobacter є сплячими формами клітини, необхідними для переживання несприятливих умов зовнішнього середовища, але не призначеними для розмноження. Після відновлення сприятливих умов, таких, як значення кислотності, температури і наявності доступного джерела вуглецю, цисти проростають, в результаті чого утворюються вегетативні клітини, що знов розмножується шляхом бінарного поділу. При проростанні цист екзина цисти ушкоджується, і вивільняється велика вегетативна клітина.
При спостереженні першою проявою проростання спор є поступове зниження переломлення світла цистами, помітне при фазово-контрастній мікроскопії або вимірюванні розсіяння світла. Проростання цист — повільний процес, що триває близько 4—6 годин, впродовж яких центральне тіло збільшується і відбувається захоплення гранул волютину, що раніше знаходилися в інтимі. Потім екзина лопається і вегетативна клітина характерної підковоподібної форми вивільняється з екзини[22]. При проростанні цисти знову відбуваються метаболічні зміни. Відразу після збільшення концентрації джерела вуглецю цисти починають поглинати кисень і виділяти діоксид вуглецю, зокрема швидкість дихання підвищується до максимальних значень через 4 години після збільшення концентрації глюкози. Біосинтез білків і РНК також починається після збільшення концентрації джерела вуглецю у середовищі, проте активізація синтезу макромолекул відбувається повільніше після збільшення концентрації джерела вуглецю. Так, синтез ДНК і фіксація азоту ініціюються через 5 годин після збільшення концентрації глюкози у безазотному живильному середовищі[23].
Під час проростання цист відбуваються зміни і в інтимі, видимі на електронно-мікроскопічних знімках. Інтима складається з вуглеводів, ліпідів і білків та займає майже такий же об'єм клітини, що і центральне тіло. Під час проростання цист інтима гідролізується та використовується клітиною для синтезу її компонентів[24].
Фізіологічні властивості
Бактерії Azotobacter отримують енергію в ході окислювально-відновних реакцій, використовуючи як донора електорону органічні сполуки. Для росту їм необхідний кисень, але вони здатні рости при знижених концентраціях кисню, утворюють каталазу і оксидазу. Здатні використовувати різні вуглеводи, спирти і солі карбонових кислот як джерела вуглеця. Ці бактерії — діазотрофи (азотфіксатори), здатні фіксувати принаймні 10 мг азоту на грам спожитої глюкози, фіксація азоту залежить від наявності іонів молібдену, відсутність молібдену може бути частково заміщена іонами ванадію. Як джерело азоту можуть використовувати нітрати, іони амонію і амінокислоти. Оптимальна кислотність для росту і фіксації азоту — pH 7,0—7,5, але клітини здатні рости в діапазоні pH від 4,8 до 8,5[25]. Можливий також залежний від водню міксотрофний ріст представників роду на безазотному живільному середовищі, що містить манозу. Оскільки водень доступний в ґрунті, ймовірно міксотрофія цих бактерій відбувається і в природних умовах[26].
Культуральні властивості
Представники роду Azotobacter здатні використовувати вуглеводи (наприклад манітол, цукрозу, глюкозу), спирти (зокрема етанол і бутанол) і солі органічних кислот, зокрема і бензоати, як джерело вуглецю і енергії. Представники роду ростуть на безазотистих середовищах, призначених для виділення вільноживучих азотфіксуючих і олігонітрофільних організмів, наприклад на середовищі Ешбі, що містить джерело вуглецю (манітол, сахароза або глюкоза) і необхідні мікроелементи (джерело фосфора, сірки і т. д.), або на середовищі Федорова, що містить більше мікроелементів[27], а також у рідкому середовищі Бейєрінка.
На твердих живильних середовищах представники роду утворюють плоскі, слизисті колонії пастоподібної консистенції діаметром 5—10 мм, в рідких живильних середовищах утворюють біоплівки. Характерна також пігментація, колонії представників роду можуть бути забарвлені в темно-коричневий, зелений та інші кольори, або можуть бути безбарвними, залежно від штаму. Бактерії Azotobacter є мезофільними мікроорганізмами і ростуть при температурі 20—30 °C[28].
Пігменти
Багато представників роду Azotobacter синтезують різноманітні пігменти. Наприклад, типовий вид роду Azotobacter chroococcum виробляє темнокоричневий водорозчинний пігмент (у видовому епітеті якраз відображена ця здатність) меланін. Продукція меланіну у A. chroococcum спостерігається при високих рівнях дихання під час фіксації азоту і, імовірно, також захищає нітрогеназну систему від дії кисню при аероадаптації[29]. Інші види роду також продукують пігменти від жовто-зеленого до пурпурного кольору[30]. Також представники роду здатні виробляти флюоресцентний пігмент, що випромінює жовто-зеленим кольором, і пігмент, що випромінює біло-блакитним кольором[31].
Геном
Частково завершено визначення нуклеотидної послідовності хромосоми Azotobacter vinelandii штаму AvOP. Хромосома A. vinelandii — кільцева молекула ДНК розміром 5342073 пар основ, що містить 5043 генів, з яких 4988 кодують білки, вміст ГЦ становить 65 %[32]. Відмічена також зміна плоїдності бактерій Azotobacter в міру «старіння» культур: кількість хромосом в клітинах та вміст ДНК збільшується в стаціонарній фазі, де бактерії можуть містити понад 100 копій хромосоми на клітину. При пересіванні на свіже живильне середовище первинний вміст ДНК (одна копія) відновлюється[33]. Крім хромосомної ДНК, у представників роду також знайдені плазміди[34] та показана можливість трансформації бактерій екзогенною плазмідою[35].
Систематика
Рід Azotobacter був вперше описаний в 1901 році голландським мікробіологом і ботаніком, одним із засновників екологічної мікробіології Мартінусом Бейєрінком на основі вперше виділеного та описаного їм виду Azotobacter chroococcum, першого відомого аеробного вільноживучого діазотрофа[36].

В 1903 році Ліпман (Lipman) описав вид Azotobacter vinelandii Lipman, 1903, а роком пізніше Azotobacter beijerinckii Lipman, 1904, названий їм на ім'я самого Мартінуса Бейєрінка. В 1949 році радянський мікробіолог Микола Олександрович Красильников описав вид Azotobacter nigricans Krasil'nikov, 1949, в 1981 році розділений Томпсоном (Thompson) и Скерманом (Skerman) на два підвиди:Azotobacter nigricans subsp. nigricans Krasil'nikov, 1949 і Azotobacter nigricans subsp. achromogenes Thompson and Skerman, 1981, в тому же році Томпсон і Скерман описали вид Azotobacter armeniacus Thompson and Skerman, 1981[37]. В 1991 році Пейдж (Page) і Шивпрасад (Shivprasad) описали мікроаерофільний, залежний від іонів натрію аеротолерантний вид Azotobacter salinestris Page and Shivprasad 1991[38].
Спочатку рід відносили до родини Azotobacteraceae Pribram, 1933, проте пізніше він був перенесений до родини Pseudomonadaceae, засновуючись на молекулярно-систематичних дослідженнях нуклеотидних послідовностей 16S рРНК. У 2004 році було проведене філогенетичне дослідження, яке виявило, що Azotobacter vinelandii входить до одної клади з бактерією Pseudomonas aeruginosa[39], а в 2007 році було зроблене припущення про близькість родів Azotobacter, Azomonas і Pseudomonas та про можливу синонімічність[40].
До роду Azotobacter раніше також відносили види Azotobacter agilis (в 1938 році перенесений Виноградським до роду Azomonas), Azotobacter macrocytogenes (перенесений в 1981 році до роду Azomonotrichon, а в 1982 році, із скасуванням Azomonotrichon, до роду Azomonas) і Azotobacter paspali (перенесений в 1981 році до роду Azorhizophilus).
Розповсюдження
Представники роду поширені повсюдно в нейтральних і слаболужних ґрунтах, але не виділяються з кислих ґрунтів[41]. Також вони були знайдені і в екстремальних умовах ґрунтів північного і південного полярних регіонів, незважаючи на короткі місцеві вегетаційні сезони і відносно низькі значення pH, — у арктичному регіоні в глині і суглинках (зокрема торф'яних і піскових суглинках), в антарктичному регионе — у ґрунті узбережжя[42]. Чисельність Azotobacter в ґрунті не дуже велика, так в ґрунтах Індії вони не перевищують 10-100 тис./г ґрунту. Чисельність цих бактерій сильно залежить від наявності інших мікроорганізмів: існують як мікроорганізми, що стимулюють ріст Azotobacter, так і ті, що запобігають їх інтенсивному росту[43]. В сухих ґрунтах бактерії Azotobacter здатні зберігатися у вигляді цист до 24 років[44].
Також бактерії Azotobacter були виділені з водних середовищ, зокрема з прісноводних водойм[45], солоневатих боліт[46]. Деякі представники роду асоційовані з рослинами та були знайдені в ризосфері, вступаючи з рослинами в певні взаємовідносини[47] — кілька штамів роду були виділені з різосфери мангрових дерев, спільно з іншими азотфіксуючими та денітрифікуючими бактеріями[48].
Деякі штами Azotobacter також були знайдені в коконах дощових черв'яків Eisenia fetida[49].
Фіксація азоту
Бактерії Azotobacter є вільноживучими діазотрофами, тобто здатні фіксувати атмосферний азот, але на відміну від класичних діазотрофів роду Rhizobia, зазвичай не вступають в симбіотичні відносини з рослинами, хоча з цього правила є кілька виключень в межах роду[50]. Фіксація азоту інгібується наявністю доступних джерел зв'язаного азоту, наприклад іонів амонію або нітратів[51].
Представники роду мають повний комплекс ферментів, необхідних для здійснення фіксації азоту: ферредоксини, гідрогенази і найважливіші ферменти — нітрогенази. Процес фіксації азоту енергозалежний і вимагає притоку енергії у вигляді АТФ. Також цей процес украй чутливий до присутності кисню, тому у представників Azotobacter виробився особливий механізм захисту від дії кисню — так званий дихальний захист, що здійснюється шляхом значної інтенсифікації дихання, найбільшої серед всіх відомих бактерій, що дуже значно знижує концентрацію кисню в клітинах[52]. Також ці бактерії мають специфічний для них білок Shethna, що захищає нітрогеназу та бере участь в запобіганні смерті клітини, викликаній кисневим стресом: мутанти, що не виробляють цей білок, гинуть за умовами наявності кисню під час фіксації азоту (тобто за умовами відсутності джерела зв'язаного азоту в середовищі)[53]. Певну роль в процесі фіксації азоту бактеріями Azotobacter грають також іони гомоцитрату[54].
Нітрогенази Azotobacter
Нітрогеназний комплекс є найважливішим ферментом, що бере участь у фіксації азоту. У представників роду виявлено кілька типів нітрогеназ — Mo-Fe-нітрогеназа[55] і альтернативні нітрогенази: ванадій-залежна[56][57][58], активніша, ніж Mo-Fe-нітрогеназа за умовами низьких температур (у дослідженнях ефективна фіксація азоту не припинялася V-нітрогеназою при зниженні температур до 5 °C, за цими умовами активність V-нітрогенази знизилася в 10 разів менше, ніж у Mo-Fe-нітрогенази[59]), і Fe-залежна, менш активна, ніж звичайна Mo-залежна нітрогеназа[60][61].
Важливу роль в утворенні активної нітрогенази грає визрівання Р-домену Mo-Fe-нітрогенази[62], а попередник Mo-Fe-кофактору нітрогенази[63], шаперон GroEL, грає важливу роль у завершенні формування нітрогенази[64]. Регуляція активності нітрогенази може здійснюватися утворенням комплексів аргініну[65]. Синтез нітрогенази здійснюється під контролем групи т. з. nif-генів[66]. Фіксація азоту регулюється nifLA опероном, один з продуктув якого, NifA, регулює транскрипцію nif-генів, а NifL має антагоністичну дію по відношенню до дії NifA у відповідь на поглинений азот і залежно від рівня надходження кисню до клітини, експресія оперону nifLA регулюється за механізмом позитивної регуляції[67]. NifL є флавопротеїном, що модулює активацію транскрипції генів фіксації азоту шляхом редокс-залежного перемикання[68]. Двокомпонентна регуляторна система, що складається з двох білків (енхансера NifA і рецептора NifL), створюючих комплекси між собою, є атиповою для представників роду, але не поширеною серед інших організмів системою регуляції експресії генів[69].
Значення
Азотистий обмін ґрунту
Фіксація азоту грає велику роль в кругообігу азоту в природі. Зокрема, фіксація азоту є найважливішим джерелом азоту, а представники роду Azotobacter грають важливу роль в кругообігу азоту ґрунту, здійснюючи фіксацію молекулярного азоту. Також представники роду синтезують деякі біологічно активні речовини, у тому числі і деякі фітогормони, наприклад ауксини[70], тим самим стимулюючи ріст та розвиток рослин[71] і являючись біологічним стимулятором росту рослин і синтезуючи фактори, необхідні для їх росту[72]. Екзополісахариди представників роду сприяють мобілізації важких металів в ґрунті, сприяючи самоочищенню ґрунтів, забруднених такими металами, як кадмій, ртуть і свинець[73]. Деякі представники роду Azotobacter також здібні до біодеградації деяких ароматичних сполук, що містять хлор, наприклад 2,4,6-трихлорфенолу, що раніше використовувався як інсектицид, фунгіцид і гербіцид, проте має мутагенну і канцерогенну дію та є ксенобіотиком і типовим компонентом забруднення сільськогосподарських ґрунтів[74]. Також Azotobacter виробляє деякі речовини, що запобігають росту певних патогенів рослин, таких як Alternaria, Fusarium і Helminthosporium, таким чином виступаючи в ролі агенту біологічної боротьби зі шкідниками[43].
Використання людиною
Завдяки своїй здатності фіксувати молекулярний азот, тим самим підвищуючи родючість ґрунтів і стимулюючи ріст рослин, бактерії Azotobacter широко використовуються в сільському господарстві[75], особливо в колишньому СРСР[43], зокрема для отримання азотних біодобрив, в тому числі азотобактерину[76], також представники роду виробляють такі полісахариди як альгінова кислота (E400)[77][78][79], що використовується в медицині як антацид, в харчовій промисловості як добавка до мозорива і кремів та в біоабсорбції металів[80] і полі-3-гідроксибутірат[81]. Azotobacter beijerinckii синтезує рестриктазу Abe I, що розпізнає асиметричну семинуклеотидну послідовність CCTCAGC[82].
Примітки
- Gandora V., Gupta R. D., Bhardwaj K. K. R. (1998). Abundance of Azotobacter in great soil groups of North-West Himalayas. Journal of the Indian Society of Soil Science 46 (3): 379—383.
- Martyniuk S., Martyniuk M. (2003). Occurrence of Azotobacter Spp. in Some Polish Soils. Polish Journal of Environmental Studies 12 (3). Архів оригіналу за 15 липня 2011. Процитовано 24 грудня 2008. Проігноровано невідомий параметр
|peages=(довідка) - Tejera N., Lluch C., Martínez-Toledo M. V., González-López J. (2005). Isolation and characterization of Azotobacter and Azospirillum strains from the sugarcane rhizosphere. Plant and Soil 270 (1—2): 223—232.
- Kumar R., Bhatia R., Kukreja K., Behl R. K., Dudeja S. S., Narula N. (2007). Establishment of Azotobacter on plant roots: chemotactic response, development and analysis of root exudates of cotton (Gossypium hirsutum L.) and wheat (Triticum aestivum L.). Journal of Basic Microbiology 47 (5): 436—439.[недоступне посилання з травня 2019]
- Clementi F. 1997. Alginate production by Azotobacter vinelandii.
- Dixon R and Kahn D. 2004. Genetic regulation of biological nitrogen fixation. Nat Rev Microbiol. 2(8):621-31. (pdf, 463kb)
- Baillie A., Hodgkiss W., Norris J. R. (1962). Flagellation of Azotobacter spp. as Demonstrated by Electron Microscopy. Journal of Applied Microbiology 25 (1): 116—119.[недоступне посилання з травня 2019]
- Vela G. R., Rosenthal R. S. (1972). Effect of Peptone on Azotobacter Morphology. Journal of Bacteriology 111 (1): 260—266.
- Jones D. H. (1920). Further Studies on the Growth Cycle of Azotobacter. Journal of Bacteriology 5 (4): 325—341.
- Lewis I. M. (1941). The cytology of bacteria. Bacteriological Reviews 5 (3): 181–230.
- Lewis I. M. (1937). Cell Inclusions and the Life Cycle of Azotobacter. Journal of Bacteriology 34 (2): 191–205.
- Socolofsky M. D., Wyss O. (1962). Resistance of the Azotobacter Cyst. Journal of Bacteriology 84: 119—124.
- Layne J. S., Johnson E. J. (1964). Natural Factors Involved in the Induction of Cyst Formation in Azotobacter. Journal of Bacteriology 87 (3): 684—689.
- Sadoff H. L. (1975). Encystment and Germination in Azotobacter vinelandii1. Microbiological Reviews 39 (4): 516—539.
- Gama-Castro S., Núñez C., Segura D. , Moreno S., Guzmán J., and Espín G. (2001). Azotobacter vinelandii Aldehyde Dehydrogenase Regulated by ς54: Role in Alcohol Catabolism and Encystment. Journal of Bacteriology 183 (21): 6169—6174.
- Núñez C., Moreno S., Soberón-Chávez G., Espín G. (1999). The Azotobacter vinelandii Response Regulator AlgR Is Essential for Cyst Formation. Journal of Bacteriology 181 (1): 141–148.
- Pope L. M., Wyss O. (1970). Outer Layers of the Azotobacter vinelandii Cyst. Journal of Bacteriology 102 (1): 234—239.
- Page W. J., Sadoff H. L. (1975). Relationship Between Calcium and Uronic Acids in the Encystment of Azotobacter vinelandiil. Journal of Bacteriology 122: 145—151.
- Lin L. P., Sadoff H. L. (1969). Preparation and Ultrastructure of the Outer Coats of Azotobacter vinelandii Cysts. Journal of Bacteriology 98 (3): 1335—1341.
- Parker L. T., Socolofsky M. D. (1968). Central Body of the Azotobacter Cyst. Journal of Bacteriology 91 (1): 297—303.
- Funa N., Ozawa H., Hirata A., Horinouchi S. (2006). Phenolic lipid synthesis by type III polyketide synthases is essential for cyst formation in Azotobacter vinelandii. Proceedings of the National Academy of Sciences of the United States of America 103 (16): 6356–6361.
- Development and germination of the Azotobacter cyst. Journal of Biophysical and Biochemical Cytology (10): 555—565. 1961. Проігноровано невідомий параметр
|auhtor=(довідка) - Loperfido B., Sadoff H. L. (1973). Germination of Azotobacter vinelandii Cysts: Sequence of Macromolecular Synthesis and Nitrogen Fixation. Journal of Bacteriology 112 (2): 841–846.
- Lin L. P., Pankratz S., Sadoff H. L. (1978). Ultrastructural and physiological changes occurring upon germination and outgrowth of Azotobacter vinelandii cysts. Journal of Bacteriology 135 (2): 641–646.
- George M. Garrity, ред. (2005). Bergey's Manual of Systematic Bacteriology. The Proteobacteria (вид. 2nd Edition). New York: Springer. с. 2816. ISBN 0-387-95040-0. Проігноровано невідомий параметр
|part=(довідка) - Wong T.-Y., Maier R. J. (1985). H2-Dependent Mixotrophic Growth of N2-Fixing Azotobacter vinelandii. Journal of Bacteriology 163 (2): 528–533.
- Под общей ред. проф. Г. Л. Селибера, ред. (1962). Большой практикум по микробиологии. Москва: Высшая школа. с. 190—191.
- Теппер Е. З., Шильникова В. К., Переверзева Г. И. (1979). Практикум по микробиологии (вид. 2-е изд., перераб. и доп.). Москва: Колос. с. 216.
- Shivprasad S., Page W. J. (1989). Catechol Formation and Melanization by Na+-Dependent Azotobacter chroococcum: a Protective Mechanism for Aeroadaptation?. Applied and Environmental Microbiology 55 (7): 1811–1817.
- Jensen H. L. (1954). The Azotobacteriaceae. Bacteriological Reviews 18 (4): 195–214.
- Johnstone D. B. (1955). Azotobacter Fluorescence. Journal of Bacteriology 69 (4): 481–482.
- Azotobacter vinelandii AvOP, unfinished sequence, whole genome shotgun sequencing project, NCBI
- Maldonado R., Jimenez J., Casadesus J. (1994). Changes of Ploidy during the Azotobacter vinelandii Growth Cycle. Journal of Bacteriology 176 (13): 3911—3919.
- Maia M., Sanchez J. M., Vela G. R. (1988). Plasmids of Azotobacter vinelandii. Journal of Bacteriology 170 (4): 1984—1985.
- Glick B. R., Brooks H. E., Pasternak J. J. (1985). Transformation of Azotobacter vinelandii with Plasmid DNA. Journal of Bacteriology 162 (1): 276—279.
- Beijerinck M. W. (1901). Ueber Oligonitrophile Mikroben. Zentralblatt für Bakteriologie, Parasitenkunde, Infektionskrankheiten und Hygiene. Abteilung II 7: 561—582.
- Thompson, J.P., and Skerman, V.B.D. (1980). Azotobacteraceae: the taxonomy and ecology of the aerobic nitrogen-fixing bacteria. London: Academic Press. с. 405.
- Page W. J., Shivprasad S. (1991). Azotobacter salinestris sp. nov., a sodium-dependent, microaerophilic, and aeroadaptive nitrogen-fixing bacterium. International Journal of Systematic Bacteriology 41 (3): 369—376.[недоступне посилання з лютого 2019]
- Rediers H., Vanderleyden J., De Mot R. (2004). Azotobacter vinelandii: a Pseudomonas in disguise?. Microbiology (150): 1117—1119.
- Young J. M., Park D.-C. (2007). Probable synonymy of the nitrogen-fixing genus Azotobacter and the genus Pseudomonas. International Journal of Systematic and Evolutionary Microbiology 57: 2894—2901.
- Yamagata U., Itano A. (1923). Physiological Study of Azotobacter chroococcum, beijerinckii and vinelandii types. Journal of Bacteriology 8 (6): 521—531.
- Boyd W. L., Boyd J. W. (1962). Presence of Azotobacter species in Polar Regions. Journal of Bacteriology 83 (2): 429–430.
- Azotobacter. Agriculture Resource Center of India. Архів оригіналу за 21 червня 2013. Процитовано 17 січня 2009.
- Moreno J., Gonzalez-Lopez J., Vela G. R. (1986). Survival of Azotobacter spp. in Dry Soils. Applied and Environmental Microbiology 51 (1): 123—125.
- Johnstone D. B. (1967). Isolation of Azotobacter Insignis From Fresh Water. Ecology 48 (4): 671—672.
- Dicker H. J., Smith D. W. (1980). Enumeration and Relative Importance of Acetylene-Reducing (Nitrogen-Fixing) Bacteria in a Delaware Salt Marsh. Applied and Environmental Microbiology 39 (5): 1019—1025.
- van Berkum P., Bohlool B. (1980). Evaluation of Nitrogen Fixation by Bacteria in Association with Roots of Tropical Grasses. Microbiological Reviews 44 (3): 491—517.
- Flores-Mireles A. L., Winans S. C., Holguin G. (2007). Molecular Characterization of Diazotrophic and Denitrifying Bacteria Associated with Mangrove Roots. Applied and Environmental Microbiology 73 (22): 7308–7321.
- Zachmann J. E., Molina J. A. E. (1993). Presence of Culturable Bacteria in Cocoons of the Earthworm Eisenia fetida. Applied and Environmental Microbiology 59 (6): 1904—1910.
- Kass D. L., Drosdoff M., Alexander M. (1971). Nitrogen Fixation by Azotobacter paspali in Association with Bahiagrass (Paspalum notatum). Soil Science Society of America Journal (35): 286—289. Архів оригіналу за 24 липня 2008. Процитовано 15 січня 2009.
- Bürgmann H., Widmer F., Sigler W. V, Zeyer J. (2003). mRNA Extraction and Reverse Transcription-PCR Protocol for Detection of nifH Gene Expression by Azotobacter vinelandii in Soil. Applied and Environmental Microbiology 69 (4): 1928—1935.
- Берцова Ю. В., Демин О. В., Богачев А. В. (2005). Дыхательная Защита Нитрогеназного Комплекса у Azotobacter vinelandii. Успехи биологической химии (Сб.) 45: 205—234. Архів оригіналу за 22 липня 2011. Процитовано 15 січня 2009.
- Maier R. J., Moshiri F. (2000). Role of the Azotobacter vinelandii Nitrogenase-Protective Shethna Protein in Preventing Oxygen-Mediated Cell Death. Journal of Bacteriology 182 (13): 3854—3857.
- Durrant M. C., Francis A., Lowe D. J., Newton W. E., Fisher K. (2006). Evidence for a dynamic role for homocitrate during nitrogen fixation: the effect of substitution at the α-Lys426 position in MoFe-protein of Azotobacter vinelandii. Biochemistry Journal 397 (2): 261–270.
- Howard J. B., Rees D. C. (2006). How many metals does it take to fix N2? A mechanistic overview of biological nitrogen fixation. Proceedings of the National Academy of Sciences of the United States of America 103 (46): 17088–17093.
- Bellenger J. P., Wichard T., Kraepiel A. M. L. (2008). Vanadium Requirements and Uptake Kinetics in the Dinitrogen-Fixing Bacterium Azotobacter vinelandii. Applied and Environmental Microbiology 74 (5): 1478–1484.
- Rüttimann-Johnson C., Rubio L. M., Dean D. R., Ludden P. W. (2003). VnfY Is Required for Full Activity of the Vanadium-Containing Dinitrogenase in Azotobacter vinelandii. Journal of Bacteriology 185 (7): 2383–2386.
- Robson R. L., Eady R. R., Richardson T. H., Miller R. W., Hawkins M., Postgate J. R. (1986). The alternative nitrogenase of Azotobacter chroococcum is a vanadium enzyme. Nature (322): 388—390.
- Miller R. W., Eady R. R. (1988). Molybdenum and vanadium nitrogenases of Azotobacter chroococcum. Low temperature favours N2 reduction by vanadium nitrogenase.. Biochemistry Journal 256 (2): 429–432.
- Fallik E., Chan Y.-K., Robson R. L. (1991). Detection of Alternative Nitrogenases in Aerobic Gram-Negative Nitrogen-Fixing Bacteria. Journal of Bacteriology 173 (1): 365—371.
- Pau R. N., Mitchenall L. A., Robson R. L. (1989). Genetic evidence for an Azotobacter vinelandii nitrogenase lacking molybdenum and vanadium. Journal of Bacteriology 171 (1): 124–129.
- Hu Y., Fay A. W., Lee C. C., Ribbe M. W. (2007). P-cluster maturation on nitrogenase MoFe protein. Proceedings of the National Academy of Sciences of the United States of America 104 (25): 10424–10429.
- Hu Y., Fay A. W., Lee C. C., Ribbe M. W. (2005). Identification of a nitrogenase FeMo cofactor precursor on NifEN complex. Proceedings of the National Academy of Sciences of the United States of America 102 (9): 3236—3241.
- Ribbe M. W., Burgess B. K. (2001). The chaperone GroEL is required for the final assembly of the molybdenum-iron protein of nitrogenase. Proceedings of the National Academy of Sciences of the United States of America 98 (10): 5521—5525. PMID 11331775.
- Martinez-Argudo I., Little R., Dixon R. (2004). A crucial arginine residue is required for a conformational switch in NifL to regulate nitrogen fixation in Azotobacter vinelandii. Proceedings of the National Academy of Sciences of the United States of America 101 (46): 16316—16321. PMID 15534211.
- Curatti L., Brown C. S., Ludden P. W., Rubio L. M. (2005). Genes required for rapid expression of nitrogenase activity in Azotobacter vinelandii. Proceedings of the National Academy of Sciences of the United States of America 102 (18): 6291—6296. PMID 15845763.
- Mitra R., Das H. K., Dixit A. (2005). Identification of a Positive Transcription Regulatory Element within the Coding Region of the nifLA Operon in Azotobacter vinelandii. Applied and Environmental Microbiology 71 (7): 3716—3724. PMID 16000781.
- Hill S., Austin S., Eydmann T., Jones T., Dixon R. (1996). Azotobacter vinelandii NifL is a flavoprotein that modulates transcriptional activation of nitrogen-fixation genes via a redox-sensitive switch. Proceedings of the National Academy of Sciences of the United States of America 93 (5): 2143—2148. PMID 8700899.
- Money T., Barrett J., Dixon R., Austin S. (2001). Protein-Protein Interactions in the Complex between the Enhancer Binding Protein NifA and the Sensor NifL from Azotobacter vinelandii. Journal of Bacteriology 183 (4): 1359—1368. PMID 11157949.
- Ahmad F., Ahmad I., Khan M. S. (2005). Indole Acetic Acid Production by the Indigenous Isolates of Azotobacter and Fluorescent Pseudomonas in the Presence and Absence of Tryptophan. Turkish Journal of Biology 29: 29—34.
- Oblisami G., Santhanakrishan P., Pappiah C. M., Shabnugavelu K. G. Effect of Azotobacter Inoculant And Growth Regulators on the Growth of Cashew. Acta Horticulturae (ISHS) 108: 44—49.
- Rajaee S., Alikhani H. A., Raiesi F. (2007). Effect of Plant Growth Promoting Potentials of Azotobacter chroococcum Native Strains on Growth, Yield and Uptake of Nutrients in Wheat. Journal of Science and Technology of Agriculture and Natural Resources 11 (41): 297.[недоступне посилання з лютого 2019]
- Chen J. H., Czajka D. R., Lion L. W., Shuler M. L., Ghiorse W. C. (1995). Trace metal mobilization in soil by bacterial polymers. Environmental Health Perspectives 103 (1): 53—58.
- Li D. Y., Eberspächer J., Wagner B., Kuntzer J., Lingens F. (1991). Degradation of 2,4,6-trichlorophenol by Azotobacter sp. strain GP1. Applied and Environmental Microbiology 57 (7): 1920—1928.
- edited by Neeru Narula, ред. (2000). Azotobacter in Sustainable Agriculture. New Delhi. с. 162. ISBN 81-239-0661-7.
- Волова Т. Г. (1999). У Под ред. академика И. И. Гительзона. Биотехнология. Новосибирск: Издательство СО РАН. с. 190—193. ISBN 5-7692-0204-1. Проігноровано невідомий параметр
|part=(довідка)[недоступне посилання з лютого 2019] - Galindo E., Peña C., Núñez C., Segura D., Espín G. (2007). Molecular and bioengineering strategies to improve alginate and polydydroxyalkanoate production by Azotobacter vinelandii. Microbial Cell Factories 6 (7).
- Page W. J., Tindale A., Chandra M., Kwon E. (2001). Alginate formation in Azotobacter vinelandii UWD during stationary phase and the turnover of poly-ß-hydroxybutyrate. Microbiology (147): 483—490.
- Ahmed M., Ahmed N. (2007). Genetics of Bacterial Alginate: Alginate Genes Distribution, Organization and Biosynthesis in Bacteria. Current Genomics 8 (3): 191–202.
- Emtiazia G., Ethemadifara Z., Habibib M. H. (2004). Production of extra-cellular polymer in Azotobacter and biosorption of metal by exopolymer. African Journal of Biotechnology 3 (6): 330—333.
- Pettinari M. J., Vázquez G. J., Silberschmidt D., Rehm B., Steinbüchel A., Méndez B. S. (2001). Poly(3-Hydroxybutyrate) Synthesis Genes in Azotobacter sp. Strain FA8. Applied and Environmental Microbiology 67 (11): 5331—5334.
- Vitkute J., Maneliene Z., Janulaitis A. (1998). Abe I, a restriction endonuclease from Azotobacter beijerinckii, which recognizes the asymmetric heptanucleotide sequence 5[prime]-CCTCAGC-3[prime](-/-2). Nucleic Acids Research 26 (21): 4917—4918.
Посилання
- Азотобактер (Azotobacter) // ВУЕ
- Азотобактер // УРЕ
- Azotobacter. MicrobeWiki. Архів оригіналу за 21 червня 2013. Процитовано 17 січня 2009. — The student-edited microbiology resource (англ.)
- J. P. Euzéby. Azotobacter Beijerinck 1901. List of Prokaryotic names with Standing in Nomenclature. Архів оригіналу за 21 червня 2013. Процитовано 17 січня 2009. (англ.)
- Azotobacter.org. Архів оригіналу за 21 червня 2013. Процитовано 17 січня 2009. — Сайт проекту дослідження геному Azotobacter vinelandii (англ.)
- Amy Crum. Azotbacter. Soil microbiology/CSES 4684. Архів оригіналу за 21 червня 2013. Процитовано 17 січня 2009. (англ.)
- Azotobacter vinelandii. John Innes Centre — Molecular Microbiology Department. Архів оригіналу за 21 червня 2013. Процитовано 17 січня 2009. (англ.)
- Azotobacter vinelandii. JGI. Архів оригіналу за 21 червня 2013. Процитовано 17 січня 2009. (англ.)
- Iwao Watanbe (JICA/Cantho Univ. expert Mar-Apr. 2000) (30 березня 2000). Biological Nitrogen Fixation and its Use in Agriculture. Lecture in Cantho University, Vietnam. Архів оригіналу за 21 червня 2013. Процитовано 17 січня 2009. (англ.)
- Azotobacter. Microbiology Video Library. MicrobiologyBytes. Архів оригіналу за 21 червня 2013. Процитовано 17 січня 2009. (англ.)
|
|
Ця стаття належить до добрих статей української Вікіпедії. |