Ізохоричний процес
Ізохори́чний або ізохо́рний проце́с (від грец. isos — рівний, та грец. chora — простір, зайняте місце) — це термодинамічний процес, який відбувається при сталому об'ємі. У газах та рідинах здійснюється дуже просто. Для цього досить нагрівати (охолоджувати) речовину у посудині, яка не змінює свого об'єму.
| Частина серії статей на тему: | ||||||||
| Термодинаміка | ||||||||
|---|---|---|---|---|---|---|---|---|
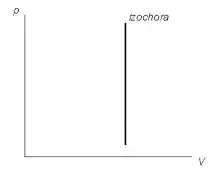 Графік ізохоричного процесу на діаграмі (p, V) | ||||||||
|
Розділи |
||||||||
|
||||||||
|
Властивості
|
||||||||
|
Властивості матерії
|
||||||||
|
Рівняння
|
||||||||
|
Історія
|
||||||||
|
| ||||||||
При ізохоричному процесі тиск ідеального газу прямопропорційний його температурі. Закон Шарля:
- ,
де Т — термодинамічна температура; p — тиск газу.
У реальних газах закон Шарля не виконується тому, що частина теплоти, яку отримує система, витрачається на збільшення енергії взаємодії частинок.
На графіках зображується лініями, які називаються ізохорами. Для ідеального газу вони є прямими у всіх діаграмах, які пов'язують параметри T (температура), V (об'єм) і p (тиск).
Внутрішня енергія та кількість теплоти при ізохоричному процесі
З визначення роботи слідує, що зміна роботи при ізохоричному процесі дорівнює:
Щоб визначити повну роботу процесу проінтегруємо даний вираз. Оскільки об'єм сталий, то:
- ,
Але такий інтеграл дорівнює нулю. Отже, при ізохоричному процесі газ роботи не виконує:
- .
Графічно довести це набагато простіше. З математичної точки зору, робота процесу — це площа під графіком. Але графік ізохоричного процесу є перпендикулярним до осі абсцис. Таким чином, площа під ним дорівнює нулю.
Зміна внутрішньої енергії ідеального газу може бути знайдена за формулою:
- ,
де і — число ступенів вільності, яке залежить від кількості атомів у молекулі (3 для одноатомної (наприклад, водень), 5 для двоатомної (наприклад, кисень) і 6 для триатомної і більше (наприклад, молекула водяної пари)).
З визначення та формули теплоємності, формулу для внутрішньої енергії можна переписати у вигляді:
- ,
де — молярна теплоємність при сталому об'ємі.
Застосуваши перше начало термодинаміки можна знайти кількість теплоти при ізохоричному процесі:
Але при ізохоричному процесі газ не виконує роботу. Тобто, має місце рівність:
- ,
тобто вся теплота, яку отримує газ йде на зміну його внутрішньої енергії.
Ентропія ізохоричного процесу
Оскільки у системі при ізохоричному процесі відбувається теплообмін із зовнішнім середовищем, то відбувається зміна ентропії. З визначення ентропії випливає:
Вище вже було виведено формулу для визначення кількості теплоти. Перепишемо її у диференціальному вигляді:
- ,
де ν — кількість речовини, — молярна теплоємність при сталому об'ємі. Отже, мікроскопічна зміна ентропії при ізохоричному процесі може бути визначена за формулою:
Або, якщо проінтегруємо останній вираз, повна зміна ентропії після проходження процесу:
У цьому випадку виносити вираз молярної теплоємності при сталому об'ємі за знак інтегралу не можна, оскільки вона є функцією, яка залежить від температури.
