Вільна енергія Гельмгольца
Ві́льна ене́ргія Гельмго́льца — термодинамічний потенціал, який визначає рівноважні термодинамічні характеристики системи в залежності від об'єму та температури.
| Частина серії статей на тему: | ||||||||
| Термодинаміка | ||||||||
|---|---|---|---|---|---|---|---|---|
 Теплова машина Карно | ||||||||
|
Розділи |
||||||||
|
||||||||
|
Властивості
|
||||||||
|
Властивості матерії
|
||||||||
|
Рівняння
|
||||||||
|
Історія
|
||||||||
|
| ||||||||
Можна показати, що рівноважний стан системи багатьох часток при визначеному об'ємі та сталій температурі визначається мінімумом вільної енергії Гельмгольца[1].
Назва вільна енергія народилася в ті часи, коли створювалася теорія теплових машин. Дослідження показали, що нагрітий газ при охолодженні, що не роби, не віддає всю свою енергію. Ту частку енергії газу, яку можна було відібрати й перетворити в корисну роботу, стали називати вільною енергією.
Як і будь-яка інша енергія, вільна енергія в класичній фізиці визначається з точністю до довільної сталої. Проте, виходячи із квантово-механічних уявлень, можна встановити природну точку відліку. При абсолютному нулі температури, вільна енергія збігається з енергією основного стану квантово-механічної системи.
Основні співвідношення
Вільна енергія F визначається як
- ,
де T — температура, S — ентропія, а E — внутрішня енергія системи.
Зміна вільної енергії дорівнює роботі, виконаній над тілом при ізотермічному процесі
Диференціал вільної енергії дорівнює
- .
У випадку системи із змінним числом частинок, диференціал вільної енергії отримує додатковий член
- ,
де μ — хімічний потенціал, N — число частинок.
Визначення характеристик системи
Термодинамічні характеристики системи визначаються через похідні від вільної енергії. Наприклад, якщо потрібно визначити тиск у газі чи в рідині при певній температурі, можна скористатися формулою:
- .
Аналогічно, якщо об'єм газу фіксований, то його ентропія визначається формулою
- .
Якщо виділити якийсь об'єм у газі при умовах вільного обміну атомами із сусідніми об'ємами, то при сталій температурі його хімічний потенціал визначається як похідна від вільної енергії за кількістю частинок
Зв'язок із статистичною сумою
У статистичній фізиці найчастіше розглядається канонічний ансамбль Гібса, тобто набір однакових за складом систем із визначеним об'ємом і при заданій температурі — саме в тих умовах, для яких використовується вільна енергія.
Ймовірність pn реалізації стану n із енергією En в такому ансамблі визначається формулою
- .
Вільна енергія F знаходиться із умови нормування ймовірності.
- ,
де статистична сума Z дорівнює
Вирази для вільної енергії деяких термодинамічних систем
Для класичного ідеального одноатомного газу вільна енергія дорівнює
Залежність вільної поверхневої енергії від потенціалу поверхні мінералу
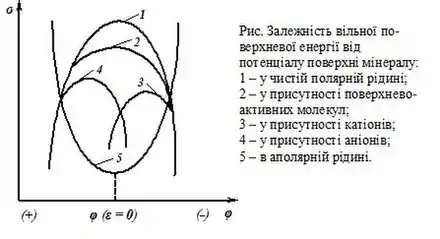
Заряд ε поверхні й термодинамічний потенціал φ, що ним визначається, відіграють велику роль при взаємодії реагентів і молекул води з мінералом. Так, наприклад, негативний заряд поверхні утруднює адсорбцію аніонів і полегшує адсорбцію катіонів поверхнево-активних речовин, які різко знижують значення вільної поверхневої енергії, особливо при потенціалах більш негативних, ніж потенціал точки максимуму (рис. крива 3). Позитивний заряд поверхні приводить до протилежної дії (рис. крива 4). Адсорбція молекул поверхнево-активних речовин і зменшення вільної поверхневої енергії досягають максимального значення в області потенціалів, близьких потенціалу нульового заряду (рис. крива 2). Адсорбція аніонів унеможливлюється при достатньо великому негативному, а катіонів — позитивному заряду поверхні. Адсорбція молекул утруднюється при зростанні заряду будь-якої полярності (рис. криві 2 — 4).
За значенням величини вільної поверхневої енергії та залежно від концентрації йонів і молекул поверхнево-активних речовин у розчині можна розрахувати (за рівнянням Гіббса) їхню абсорбцію на досліджуваній поверхні. За залежністю вільної поверхневої енергії від потенціалу можна визначити поверхневу щільність заряду, а за залежністю адсорбції від потенціалу — орієнтацію молекул в адсорбційному шарі й характер їхньої взаємодії між собою.
Дипольні молекули води можуть закріплюватися (адсорбуватися) на поверхні мінералу в результаті електростатичного притягання їх зарядженими йонами поверхні, міжмолекулярної взаємодії з поверхнею, утворення водневих і координаційних зв'язків з йонами або молекулами поверхневого шару. Структура гідратних шарів на поверхні мінералу при цьому визначатиметься кількісним співвідношенням різнойменних зарядів, на яких можуть закріплюватися та взаємно розташовуватися молекули води.
Примітки
- О. С. Гамеева «Физическая и коллоидная химия», — М.:"Высшая школа", 1969, с. 106
Джерела
- Базаров И. П. Термодинамика. — М. : Высшая школа, 1991. — 376 с.
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Квасников И. А. Теория равновесных систем: Термодинамика // Термодинамика и статистическая физика. — М. : URSS, 2012. — Т. 1. — 328 с.
- Ландау Л. Д., Лифшиц Е. М. Статистическая физика. Часть 1 // Теоретическая физика. — М. : Физматлит, 2005. — Т. 5. — 616 с.
- Сивухин Д. В. Термодинамика и молекулярная физика // Общий курс физики. — М. : Физматлит, 2002. — Т. 2. — 576 с.
