Реакції відновлення в біологічних системах
Відновлення — це процес, що супроводжується утворенням нових зв'язків з Гідрогеном і включає в себе перенесення електронів до органічного субстрату. Відновлення є протилежним процесу окиснення, тобто процесу видалення Гідрогену з утворенням кратного зв'язку або нового зв'язку між атомом Карбону і гетероатомом, більш електронегативним, ніж Гідроген, наприклад, Оксигену, Нітрогену, Сульфуру.
В окисно-відновних процесах змінюється ступінь окиснення атому Карбону.
Реакції відновлення в біоорганічній хімії
В біоорганічній хімії велике значення мають реакції відновлення, які є складовою частиною різних біохімічних процесів в біологічних системах, а в промисловості використовуються для синтезу цінних біоорганічних сполук.
Для відновлення органічних сполук можуть бути використані майже всі відновники. Частіше за все використовують водень (Н2) в присутності гетерогенних каталізаторів, гідриди металів та активні метали (Na або Zn). В біологічних системах роль донора водню грають різноманітні коферменти, наприклад НАДН, НАДФН та ФАДН2.
Найбільш загальним способом відновлення ненасичених вуглець-вуглецевих зв'язків є каталітичне гідрування.
В біологічних системах часто протікають реакції відновлення різних азотовмісних сполук, наприклад нітрилів і амідів карбонових кислот, в результаті яких утворюються первині аміни:
- R-C~N + H2 → R-CH2-NH2
- R-C(=O)-NH2 + H2 → R-CH2-NH2
Примітка: C~N — потрійний звязок в молекулі нітрилу.
В деяких яскраво забарвлених харчових продуктах можуть бути барвники на основі аніліну. Постійне вживання в їжу таких продуктів може призвести до серйозних наслідків, оскільки анілін — яскраво виражений відновник має високу біохімічну активність; окислюючись він утворює в організмі людини різні токсичні сполуки. Промислове добування аніліну з нітробензолу є типовою реакцією відновлення (більш відома як реакція Зініна):
- C6H5-NO2 + H2,Ni → C6H5-NH2 (відновлення нітробензолу до аніліну)
Одним з учасників ферментативних процесів відновлення є похідне 1,4-дигідропиридина — НАДН, що в при відновленні утворює НАД+ в різних окисно-відновних реакціях у складі таких складних циклів як цикл Кребса, Кальвіна та ін. Наприклад, при участі НАДН протікає in vivo реакція перетворення альдегідів у спирти:
- НАДН + Н+ + R-C(=O)-H → R-CH2-OH + НАД+
Взагалі відновлення карбонільних сполук (альдегідів, кетонів, складних естерів) призводить до утворення відповідних спиртів:
- R-C(=O)-H + [H] → R-CH2-OH
- R-C(=O)-R^ + [H] → R-CH(OH)-R^
- R-C(=O)-O-R^ + [H] → R-CH2-OH + R^OH
Чільне місце в біоорганічній хімії посідає відновленн] моносахаридів (альдоз, кетоз). При відновленні альдоз отримується лиш один поліол, кетоз — суміш двох поліолів. Наприклад, при відновленні D-фруктози борогідридом натрію (NaBH4) утворюються D-глюцит (сорбітол) і D-маніт.
Важливою є реакція відновлювального амінування, яка протікає в організмі в процесі біосинтезу α-амінокислот. Процес відбувається за схемою приєднання—відщеплення і полягає в отриманні α-амінокислот з альдегідів та кетонів, з утворенням проміжного продукту — іміну, який потім відновлюється до аміну:
- R(H)=O + NH3 - H2O → R-C(H)=NH + H2 → R-CH2-NH2
- R=O(R^) + NH3 - H2O → R-C(R^)=NH + H2 → R-C(R^)H-NH2
Друга стадія цього процесу в промислових умовах потребує каталізатору — Ni, в живих організмах ця реакція потребує коферменту НАД·H2 та НАДФ·H:
- R-C(R^)=NH + НАД·H2 → R-C(R^)H-NH2 + НАД+
Окислювально-відновні коферменти
Всі оксидоредуктази потребують коферментів. Вони можуть діяти в розчинній формі (Р) або у вигляді простетичної групи (П). Окислювально-відновні реакції, поряд з переносом електронів, часто включають перенесення одного або двох протонів. Тому зазвичай прийнято говорити про перенесення відновлювальних еквівалентів. Стандартний потенціал Е'0 простетичної групи може значно відрізнятися в залежності від оточення в молекулі ферменту.
Піридиннуклеотиди НАД+ (NAD+) і НАДФ+ (NADP+) широко поширені як коферменти дегідрогеназ. Вони переносять гідрид—іон (2е- і 1 H+ і діють завжди в розчинній формі. НАД+ передає відновлювальний еквівалент з катаболического шляху в дихальному ланцюзі і тим самим бере участь в енергетичному обміні. HАДФ+, навпаки, є найважливішим відновником при біосинтезі.
Нікотинамідаденіндинуклеотид (НАДН, NADН) — кофермент, присутній у всіх живих клітинах, входить до складу ферментів групи дегідрогеназ, які каталізують окислювально-відновні реакції; виконує функцію переносника електронів і водню, які приймає від окислюваних речовин. Відновлена форма (NADH) здатна переносити їх на інші речовини. Відмінність його від іншого найважливішого кофермент]]у — нікотинамідаденіндинуклеотидфосфата, або NADP, в тому, що останній містить в молекулі ще один залишок фосфорної кислоти, пов'язаної з 21-вуглецевим атомом рибози.
НАДФ·H— -оксидаза, або NADPH-оксидаза (NOX), Никотинамідаденіндинуклеотидфосфат — клітинний мембрано-зв'язаний мультимолекулярний ферментний комплекс, що локалізується на плазматичній мембрані і в деяких органелах . Особливо збагачені цим ферментом фагоцитарні клітини, такі як макрофаги. Ці оксидази беруть участь у клітинній протимікробній захисній системі, а також у клітинної проліферації, диференціювання і регуляції експресії генів. Існує ціла група NADPH — оксидаз, які розрізняються по складу субодиниць, клітинної специфічності, регуляції та іншими[параметрами.
Флавінові коферменти ФМН і ФАД знайдені в дегідрогеназі, оксидазі і монооксигеназі . Зазвичай обидва з'єднання ковалентно пов'язані з ферментами. Активною групою обох коферментів є флавін (ізоалоксазина), що має сполучену систему з трьох кілець, яка може при відновленні приймати два електрони і два протона. У ФМН до флавіну приєднаний фосфорильований поліол рібіт . ФАД складається з ФМН , пов'язаного з АМФ. Обидва сполуки є функціонально близькими коферментами.
У ліпоєвої кислоті функцію окислювально—відновного центру виконує внутрішньомолекулярний дисульфідний місток. Активна ліпоєва кислота ковалентно пов'язана із залишком лізину (R ') молекули ферменту. Ліпоєва кислота насамперед бере участь в окислювальному декарбоксилюванні 2-кетокислот. Дисульфідний місток також міститься в пептидному коферменті глутатіоні
Функція убіхінону (коферменту Q4) як переносника відновного еквівалента в дихальному ланцюзі має велике значення для живих організмів. При відновленні хінон перетворюється на ароматичний гідрохінон (убіхінол). Подібні системи хінон/гідрохінон беруть участь в реакціях фотосинтезу. До цього класу окислювально -відновних систем належать також вітаміни Е і К.
Група гема є окислювально-відновним кофактором в дихального ланцюга, фотосинтезу, а також може бути у складі монооксигенази і пероксидази. На відміну від гемоглобіну в цих випадках іон заліза змінює валентність.
Редокс-потенціал як основна характеристика окисно—відновних реакцій в біологічних системах
Здатність відновника віддавати електрони окисника виражається величиною окисно-відновного потенціалу (стандартного відновного потенціалу), або редокс-потенціалу. Як стандарт в усьому світі прийнятий редокс—потенціал реакції
- Н2 → 2Н+ + 2е-
який при тиску газоподібного водню в 1 атмосферу при концентрації іонів Н+ рівній 1 моль/літр (що відповідає рН = 0) і при 25 °C умовно прийнятий за нуль. В умовах значення рН , прийнятого як стандарт при біохімічних розрахунках, тобто при рН 7,0, редокс-потенціал (Е'0) водневого електрода (системи Н2 — 2Н+) дорівнює -0,42 В.
Значення редокс-потенціалу (Е'0) для деяких окислювально-відновних пар, що грають важливу роль при переносі електронів в біологічних системах:
| Відновник | Окисник | Е'0, В |
|---|---|---|
| Н2 | 2Н+ | -0,42 |
| НАД·Н + Н+ | НАД+ | —0,32 |
| НАДФ·Н + Н+ | НАДФ+ | -0,32 |
| Флавопротеїн (відновл.) | Флавопротеїн (окисл.) | -0,12 |
| Кофермент Q·Н2 | Кофермент Q | +0,04 |
| Цитохром в (Fe2+) | Цитохром в (Fe3+) | +0,07 |
| Цитохром C1 (Fe2+) | Цитохром C1 (Fe3+) | +0,23 |
| Цитохром а (Fe2+) | Цитохром а (Fe3+) | +0,29 |
| Цитохром а3 (Fe2+) | Цитохром а3 (Fe3+) | +0,55 |
| Н2О | ½О2 | +0,82 |
Система з більш негативним редокс-потенціалом має більшу здатність віддавати електрони системі з більш позитивним редокс-потенціалом. Наприклад, пара НАД·Н/НАД+, редокс-потенціал якої дорівнює -0,32 В віддаватиме свої електрони окислювально-відновної парі флавопротеїн (відн.)/флавопротеїн (окисн.), що має потенціал −0,12 В, тобто більш позитивний. Велика позитивна величина редокс-потенціалу окисно — відновної пари вода/[кисень (+0,82 В) вказує на те, що у цієї пари здатність віддавати електрони (тобто здатність утворювати молекулярний кисень) виражена дуже слабо.
Реакції відновлення у фотосинтезі
Реакції відновлення беруть участь в окисно-відновних циклах в процесі фотосинтезу. Фотоси́нтез — процес синтезу органічних сполук з вуглекислого газу та води з використанням енергії світла й за участю фотосинтетичних пігментів. Загальне рівняння фотосинтезу виглядає так:
- 6СО2 + 12Н2О + 18АТФ + 12НАДФ·Н → С6Н12О6 + 18АДФ + 18Н3РО4+ + 12НАДФ
Темнова фаза фотосинтезу (більш відома як цикл Кальвіна) є складним циклом перетворення. Вона складається з трьох стадій:
- Карбоксиляція
- Відновлення
- Регенерація акцептора CO2
Однією з найважливіших реакцій цього циклу є реакція відновлення дифосфогліцеринової кислоти під дією ферменту тризофосфатдегідрогенази за рахунок НАДФ·Н з утворенням 3-фосфогліцеринового альдегіду:
- H2O3-O-C(H2)-(H)C(OH)-C=O-O-{P} + C21H29N7O17P3 • Н → H2O3-O-C(H2)-(H)C(OH)-C(H)=O + C21H29N7O17P3
Під дією гліцеральдегід-1,3-фосфатдегідрогенази дифосфогліцеринова кислота відновлюється НАД(Ф)·H (у рослин і ціанобактері; у пурпурних і зелених бактерій відновником є НАД·H) паралельно з відщепленням одного залишку фосфорної кислоти. Утворюється гліцеральдегід-3-фосфат (фосфогліцеральдегід, ФГА, тріозофосфат) Таким чином 3-фосфогліцериновий альдегід в результаті складних реакцій, які каталізуються ферментами іде на синтез фруктозо-6-фосфату (основний продукт фотосинтезу, попередник глюкози) та рібулозо-5-фосфату, який в свою чергу перетворюється на рибулозо-1,5-дифосфат, котрий приєднує СО2 і цикл повторюється.
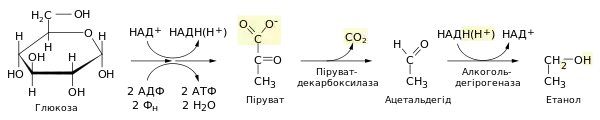
Реакції відновлення у процесі гліколізу (під час спиртового бродіння)
Гліко́ліз — це цикл окисно — відновних реакцій який призводить до перетворення глюкози в піруват з утворенням АТФ та НАДН. Загальне рівняння гліколізу виглядає так:
- С6Н12О6 + 2НАД+ + 2Н3РО4 + 2АДФ → 2ПВК + 2АТФ + 2НАД·Н + 2Н2О
Окремим випадком гліколізу, що протікає в біологічній системі дріжджів в анаеробних умовах є спиртове бродіння. Під час спиртового бродіння розщеплення глюкози починається гліколітичним шляхом (за винятком бактерії Zymomonas mobilis, у якої глюкоза метаболізує по шляху Ентнера-Дудорова[1]). У гліколітичних глюкоза розщеплюється і окиснюється до двох молекул пірувату, відбувається субстратне фосфорилювання двох молекул АДФ із утворенням АТФ, а також відновлюються до НАДH дві молекули НАД+. За аеробних умов НАДH знову окиснюється віддаючи електрони через ряд посередників на молекулярний кисень, і тоді знову може бути використаний у процесі гліколізу. В анаеробних умовах регенерація НАД+ відбувається у кінцевих етапах бродіння, під час яких акцептором електронів є сам піруват або його похідні: у випадку спиртового бродіння — ацетальдегід[2].
Ацетальдегід утворюється із пірувату шляхом декарбоксилювання (відщеплення вуглекислого газу), яке каталізується піруватдекарбоксилазою. Цей фермент потребує присутності іонів Mg2+ та містить ковалентно приєднаний кофермент тіамінпірофосфат[3].
Найважливішою реакцією в цьому циклі є відновлення ацетальдегіду до етилового спирту завдяки перенесенню гідрид-іона із НАДH, утвореного у гліколізі[4]. Реакція відбувається за участі ферменту алкогольдегідрогенази, що містить в активному центрі іон цинку, який поляризує карбонільну групу субстрату полегшуючи приєднання гідриду[3][5]:
Література
- Тюкавкіна Н. А. Бауков Ю. І. «Біоорганічна хімія» , Москва «Дрофа» 2004, 544с 2.
- Тюкавкіна Н. А., Артем'єва Н. Н. «Керівництво до лабораторних робіт з біоорганічної хімії», Москва, «Дрофа» 2008, 318с.
- Корольов А. П., Грідіна С. Б., Зінкевич Є. П. «Основи біохімії, частина 4: навчальний посібник Кемеровського технологічного інституту харчової промисловості» — Кемерово, 2004. — 92 с.
- Ю.Овчинніков «Біоорганічна хімія» — М.: «Просвещение», 1987. — 816 c.
- Сєвєрін. «Біохімія підручник для ВУЗів» — М., 2003. — 779 с.
- Маррі Р., Греннер Д. Биохимия человека — М.: «Мир», 1993. — 1-2 т.
- Комов В. П., Шведова В. Н. Біохимія / В. П. Комов — М.: Дрофа, 2004.
Примітки
- Гудзь et al, 1991, с. 105.
- Nelson et al, 2008, с. 546.
- Nelson et al, 2008, с. 547.
- Prescott, 2002, с. 179.
- Berg et al, 2007, с. 447.
