Генна регуляторна мережа
Генна регуляторна мережа (ГРМ) — це набір молекулярних регуляторів що взаємодіють один з одним, а також з іншими речовинами в клітині та керують рівнем гена експресії матричної рибонуклеїнової кислоти (мРНК) та білків. Це відіграє важливу роль в морфогенезі, створенні структурою тіла, яка в свою чергу є основною еволюційною біологією розвитку.
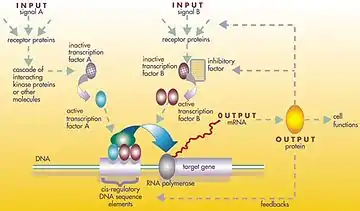
Регуляторами можуть бути дезоксирибонуклеїнова кислота (ДНК), РНК, білки та їх об'єднання. Взаємодія може бути як прямою, так і непрямою (через розшифровану РНК або білки). Взагалі, кожна молекула мРНК намагається створити конкретний білок або набір білків. У деяких випадках цей білок буде структурним, та буде накопичуватися на клітинній мембрані або всередині клітини, щоб надати йому специфічні структурні властивості. В інших випадках білок буде являти собою фермент, тобто мікро-машину, що каталізує певні реакцію, такі як несправність джерела живлення або токсин. Деякі білки служать лише для активації інших генів, і це є фактори транскрипції, що відіграють основну роль в регуляторних мережах або каскадах. Шляхом зв'язування з промоторною областю на початку інших генів, вони їх активують, ініціюючи вироблення іншого білка, і так далі. Деякі фактори транскрипції гальмують перетворення.
В одноклітинних організмах регуляторна мережа реагує на зовнішнє середовище, оптимізуючи клітину в даний момент часу для виживання в цьому середовищі. Таким чином, клітини дріжджів, опиняючись в цукровому розчині, активують гени, щоб зробити ферменти, які обробляють цукор до алкоголю.[1] Цей процес, який ми пов'язуємо з виноробством, це те, що робить дріжджову живою, даючи їй енергію для розмноження, що при нормальних обставинах буде сприяти підвищенню її перспективи виживання.
У багатоклітинних тварин такий самий принцип використовується для обслуговування каскадного гену, та контролю форми тіла.[2] Щоразу, коли клітина ділиться на дві такі ж клітини, маючи такий самий геном, вони можуть різнитися лише генами, що мають відношення до синтезу білків. Іноді самопідтримується петля зворотного зв'язку, що гарантує, що клітина зберігає свою ідентичність і передає її. Менш зрозумілим, є механізм, за допомогою якого eпігенетика модифікації хроматину може забезпечити клітинну пам'ять шляхом блокування або дозволом транскрипції. Головною особливістю багатоклітинних тварин є використання градієнту морфогену, що фактично забезпечує систему визначення місця розташування, що повідомляє клітині, де в організмі людини вона знаходиться, і якого роду клітиною їй стати. Ген, який включений в одну клітину може зробити продукт, який залишає клітку і дифундує через сусідні клітини, проникаючи в них і включаючи гени тільки тоді, коли вони присутні вище певного порогового рівня. Ці клітини, таким чином, індуковані в нову ціль, і, можуть навіть генерувати інші морфогені, що генерують зворотній сигнал до вихідної клітини. Довші відстані морфогени можуть використовувати для активного процесу сигнальної трансдукції. Така сигналізація контролює ембріональний розвиток, побудову плану тіла з нуля через ряд послідовних кроків. Вони також контролюють і підтримують дорослі тіла через процеси зворотного зв'язку, а втрата такого зворотнього зв'язку, через мутації, може бути відповідальна за проліферацію клітин, яка розглядається в такому захворюванні як злоякісна пухлина. Паралельно з цим процесом побудови структури, каскадний ген активує гени, що створюють структурні білки, що надають кожній клітині фізичні властивості яких вони потребують.
Загальні уявлення
На одному рівні, біологічні клітини можна розглядати як «частково змішані мішки» біологічних хімічних речовин — в обговоренні ГРМ, ці хімічні речовини в основному є мРНК і білками, що виникають з експресії генів. Ці мРНК і білки взаємодіють один з одним з різним ступенем специфічності. Деякі дифундують навколо клітини. Інші зв'язуються з клітинними мембранами, та взаємодіють з молекулами. Проте інші проходять крізь клітинні мембрани та стають посередниками для довгих сигналів до інших клітин в багатоклітинних організмах. Ці молекули і їх взаємодії входять до складу регуляторної мережі генів.
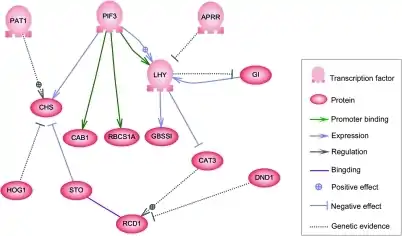
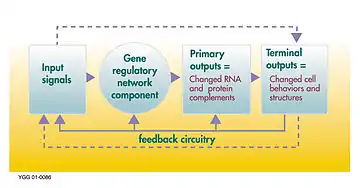
Вузлами цієї мережі є білки, що відповідають їх мРНК і білкам (білковим комплексам). Вузли, що лежать уздовж вертикальних ліній пов'язані з навколишнім середовищем клітин, в той час як інші, вільно плавають і можуть дифундувати. Маються на увазі гени послідовності ДНК, що транскрибуються в мРНК, білки. Ребра між вузлами представляють собою окремі молекулярні реакції, білок+білок і білок+мРНК за допомогою яких продукти одного гена впливають на іншого, хоча відсутність експериментально отриманої інформації часто має на увазі, що деякі реакції не моделюються на такому тонкому рівні детально. Ці взаємодії можуть бути індуктивними, зі збільшенням концентрації одного ведучого до збільшення іншого, або інгібіторними, зі збільшенням однієї провідної до зменшення іншого. Ряд ребер вказує на ланцюжок таких залежностей, з періодом відповідних петель зворотного зв'язку. Мережева структура являє собою абстракцію динаміки хімічної системи, що описує різноманіття форм, в яких одна речовина впливає на всі інші з якими вона контактує. На практиці такі ГРМ виводяться з біологічної літератури по даній системі і являють собою квінтесенцією колективного знання про множину суміжних біохімічних реакцій.[3]
Гени можна розглядати як вузли мереж, з вхідними білками, такими як фактори транскрипції, і вихідними, що показують рівень експресії гена. Вузол також може розглядатися як функція, що може бути отримана шляхом об'єднання основних функцій на входах (в булевій мережі, описаної нижче ці булеві функції, як правило, І, АБО, НІ). Ці функції були інтерпретовані як вид виконання обробки інформації в клітці, що визначає поведінку стільникового зв'язку. Основними драйверами в клітинах є концентрації деяких білків, які визначають як просторове (місце розташування всередині клітини або тканини) і тимчасові (клітинного циклу або стадії розвитку) координати осередку, як свого роду «клітинна пам'ять». У генній мережі тільки починають розуміти, і це наступний крок для біології, який полягає в тому, щоб спробувати вивести функції для кожного генного вузла, щоб зрозуміти поведінку системи вищого рівня складності, від гена сигнального шляху до клітини або тканини.
Математичні моделі ГРМ були розроблені, щоб захопити поведінку модельованої системи, а в деяких випадках сформулювати передбачення, що підтверджуються експериментальними спостереженнями. У деяких інших випадках, моделі довели, що можуть зробити нові передбачення, які можуть бути перевірені експериментально, таким чином, пропонуються нові підходи до аналізу експерименту, які іноді не будуть враховуватися при розробці протоколу експериментальної лабораторії. Найбільш поширений метод моделювання передбачає використання звичайних диференціальних рівнянь (ДР). Були використані кілька інших перспективних методів моделювання, в тому числі логічних мереж: мереж Петрі, Байєсовські мережі, графічні Гауссовські моделі, стохастичність і обчислення процесів. З іншого боку, методи були запропоновані для створення моделей ГРМ, що найкраще описують набір спостережень часових рядів. Останнім часом було показано, що сигнал ChIP-seq модифікації гістонів більш корельований з урахуванням транскрипційних факторів, мотивів промоутерів в порівнянні з рівнем РНК.[4] Отже, передбачається, що тимчасові ряди модифікації гістонів ChIP-seq можуть забезпечити більш надійну інференцію ГРМ в порівнянні з методами, заснованими на рівні експресії.
Будова та розвиток
Глобальні характеристики
Зазвичай вважають, що ГРМ складається з декількох високозв'язаних вузлів та великої кількості слабо пов'язаних вершин, вкладених в ієрархічну безмасштабну топологічну мережу.[5] Це узгоджується з тим, що більшість генів обмежена плейотропією і діє в рамках регуляторних модулів.[6] Вважають, що ця структура розвивається переважно за рахунок прикріплення дуплікаційних генів до більш високосв'язних генів.[5] Останні дослідження показали, що зазвичай природний відбір йде на користь мереж з рідкісним зв'язком. [7]
Існують два основні способи завдяки яким мережа може еволюціоністи, обидва з яких можуть відбуватися одночасно. Перший, мережева топологія може бути змінена шляхом додавання або віднімання вершин (генів) або частин мережі (модулів), що можуть бути виражені в різних контекстах. Хорошим прикладом є Hippo сигнальний шлях дрозофіли. Сигнальний шлях Hippo контролює мітотичне зростання і постміотичні клітинні диференціювання.[8] Останнім часом було виявлено, що мережа сигнального шляху Hippo діє в залежності від цих двох функцій що, в свою чергу, змінюють поведінку сигнального шляху Hippo. Це говорить про те, що сигнальний шлях Hippo працює як зберігаючий регуляторний модуль, який може бути використаний для декількох функцій в залежності від ситуації.[8] Таким чином, зміна топології мережі може дозволити зберігати модуль для обслуговування декількох функцій і змінити кінцевий результат мережі. Другий спосіб мережі може розвиватися за рахунок зміни сил взаємодії між вузлами, наприклад, як сильно транскрипційний фактор може зв'язуватися з цис-регуляторним елементом. Було показано, що така зміна міцності мережевої периферії лежить в основі варіацій вульв в залежності від виду, що обумовлює формування черв'яків Caenorhabditis. [9]
Локальні характеристики.
ГРМ має велику кількість певних повторюваних підмереж, що називаються мережеві мотиви. Мережеві мотиви можна розглядати як повторюванні топологічні моделі, розподілені великі мережі на невеликі блоки. Попередній аналіз показав кілька типів мотивів, які з'являлися частіше в ГРМ, ніж в випадково згенерованих мережах.[10][11][12] Як приклад, один такий мотив називається прямою подачею петлі, що складається з трьох вузлів. Цей мотив є найбільш поширеним серед всіх можливих мотивів, складених з трьох вузлів.[12]
Було запропоновано слідувати конвергентній еволюції збагачених мотивів, припускаючи, що вони є «оптимальними конструкціями» для деяких цілей регулювання.[13] Наприклад, моделювання показує, що пряма подача петлі здатна координувати зміни в вузлі А (з точки зору концентрації і активності) і динаміки експресії вузла С, створюються різні поведінки.[14][15] Система утилізації галактози кишкової палички містить попереджувальну петлю, що прискорює активацію використання галактози оперона galETK, та потенційно полегшує метаболічний перехід до галактози, коли глюкоза виснажена.[16] Випереджаючий цикл у використання арабінози системою кишкова паличка затримує активацію арабіноза, катаболізму оперона і транспортерів, потенційно уникає непотрібного метаболічного переходу через тимчасові зміни вгору за течією сигнальних шляхів.[17] Таким самим чином в сигнальному шляху Wnt з шпорковою жабою, попереджувальна петля діє як детектор складних змін, що відповідають кратній зміні, а не абсолютній, в рівні бета-катенін, потенційно збільшуючи стійкість до коливань в бета-катенін рівні.[18] Слідуючи гіпотезі конвергентної еволюції, збагачення прямої подачі петлі буде адаптація для швидкого реагування на шумовий опір. Недавнє дослідження показало, що дріжджі, вирощені в умовах розвинених мутацій постійної глюкози, в глюкозі сигнальних шляхів і регуляції шляху зростання, піддаються регуляторним компонентам, що реагують на зміни навколишнього середовища і середовище необов'язково має бути постійним.[19]
З іншого боку, деякі дослідники припустили, що збагачення мережевих мотивів не є адаптивним.[20] Іншими словами, ГРМ можуть розвиватися в подібні структури без специфічного відбору на запропонованій поведінці введення-виведення. Підтримка цієї гіпотези часто виходить з теоретичного моделювання. Наприклад, коливання в розмаїті мотивів прямої подачі петель в моделі, яка імітує еволюцію ГРМ випадкове переформування вузлів може свідчити про те, що збагачення енкріменту прямої подачі петель є побічним ефектом еволюції.[21] В іншій моделі еволюції ГРМ, відношення частот дуплікації генів і стирання гена показали великий вплив на топології мереж: деякі відносини призводять до зростання прямої подачі петель і створення мереж, що показують особливості ієрархічної шкали вільних мереж.
Бактеріальні регуляторні мережі
Регуляторні мережі дозволяють бактерії пристосуватися майже до кожної екологічної ніші на землі.[22][23] Мережа взаємодій між різними типами молекул, включаючи ДНК, РНК, білків і метаболітів, використовується бактеріями для досягнення регуляції експресії генів., Основна функція регуляторних мереж у бактерій, це контроль реагування на зміни навколишнього середовища, наприклад: стану харчування і навантаження на навколишнє середовище.[24] Складна організація мереж дозволяє мікроорганізмам координувати і інтегрувати багато екологічних сигналів.[22]
Моделювання
Поєднання звичайних диференціальних рівнянь
Звичайна спільна модель такої мережі з великою кількістю пов'язаних звичайних диференціальних рівнянь (ДУ) або стохастичних ДУ, що описують кінетику реакції складових частин. Припустимо, що наша регуляторна мережа має вузлів, і нехай представляють концентрації відповідних речовин в момент часу . Тоді тимчасова еволюція системи може бути описана наближено:
Де функції виражають залежність від концентрацій інших речовин, присутніх в клітці. Функції в кінцевому рахунку, отримуються з основних принципів хімічної кінетики або простих виразів, отриманих наприклад з, ферментативної кінетики Міхаеліса — Ментен. Отже, функціональні форми зазвичай вибираються у вигляді поліномів низького порядку або рівняння Гілла, які слугують анзацом для реальної молекулярної динаміки. Такі моделі потім вивчаються за допомогою динамічної системи. Системо-специфічна інформація, як константи швидкості хімічної реакції і чутливості, кодуються як постійні параметри.[25]
Вирішуючи для нерухомої точки системи:
для всіх , отримуємо (можливо декілька) профіль концентрації білків і мРНК, які теоретично стійкі (хоча і не обов'язково стійкі). Таким чином стаціонарні стани дисипативних систем кінетичних рівнянь, відповідають потенційним типам клітин і осцилюючих рішень наведеного вище рівняння природних циклічних типів клітин. Математичну стабільність цих атракторів зазвичай можна охарактеризувати знаком вищих похідних в критичних точках, а потім відповідністю біохімічної стабільності профілю концентрації. Критичні точки і біфуркації в рівняннях відповідають критичним точкам осередків, в яких малі стани або параметри обурення можуть перемикати систему між одним з декількох стійких диференційованих долей. Траєкторії відповідають розгортанню біологічних шляхів і перехідним рівнянням для короткострокових біологічних подій.
Логічні мережі
У наступному прикладі показано, як логічна мережа може моделювати ГРМ разом з генними продуктами і речовинами з навколишнього середовища, які впливають на них. Стюарт Кауфман був одним з перших біологів, хто використовував метафору логічних мереж для моделювання ГРМ.[26][27]
- Кожен ген, кожен вхід, і кожен вихід представлений вузлом в орієнтованому графі, в якому є стрілка від одного вузла до іншого існує тоді і тільки тоді, коли існує причинно-наслідковий зв'язок між цими двома вузлами.
- Кожен вузол в графі може знаходитися в одному з двох станів: увімкнено або вимкнено.
- За отримання гена, «увімкнено» відповідає ген експресування; для входів і виходів, «вимкнено» відповідає присутність речовини.
- Час розглядається дискретно. На кожному кроці, новий стан вузла є логічною функцією попередніх станів вузлів зі стрілками, що вказують на нього.
Справедливість моделі може бути перевірена шляхом порівняння результатів моделювання з даними спостережень часових рядів. Часткова перевірка логічної моделі мережі також може виходити з тестування передбачення існування ще невідомого регуляторного зв'язку між двома специфічними факторами транскрипції, кожні з яких є вузлами моделі.[28]
Безперервні мережі
Безперервні мережеві моделі ГРМ є продовженням логічних мереж, описаних вище. Вузли до сих пір представляють гени і зв'язки між ними регуляторних впливів на експресію генів. Гени в біологічних системах відображаються безперервним діапазоном рівніі активності, і було доведено, що з використанням безперервного подання захоплюється кілька властивостей генів регуляторних мереж, яких немає в логічній моделі.[29] Формально більшість з цих підходів схожа на штучні нейронні мережі, входи вузла підсумовуються і результат слугує вхідними даними для функції сигмовидної області[30], але білки дійсно часто контролюють експресію генів синергетичним, тобто нелінійним, способом.[31] Тим не менш, у даний час існує безперервна модель мережі[32], що дозволяє угруповати входи вузла таким чином реалізуючи інший рівень регулювання. Ця модель ближче до рекурентної нейронної мережі більш високого порядку. Та ж модель була використана, для імітування еволюції диференціації клітин[33] і навіть багатоклітинного морфогенезу.[34]
Стохастичні генні мережі
Останні експериментальні результати[35] [36] показали, що експресія гена є випадковим процесом. Таким чином, багато авторів на даний час використовують імовірнісний формалізм.[37] Роботи по одній експресії генів[38] і малих синтетичних генних мереж[39][40], такі як генетичний тумблер Тім Гарднер і Джим Коллінз, представили додаткові експериментальні дані по фенотипічній мінливості і стохастичному характеру експресії генів. Перші версії стохастичних моделей експресії генів, що брали участь тільки в миттєвих реакціях і управлялися за допомогою алгоритму Гіллеспі.[41] Так як деякі процеси, такі як транскрипції генів, включають в себе багато реакцій і не можуть бути правильно змодельовані як миттєві реакції на одній стадії, було запропоновано змоделювати ці реакції як один крок множинних запізнілих реакцій, з тим щоб врахувати час, необхідний для весь процес буде завершення.[42]
Звідси, був запропонований набір реакцій[43], що дозволяє генерувати ГРМ. Потім вони змоделювали з використанням модифікованої версії алгоритму Гіллеспі, який може імітувати кілька реакцій з затримкою за часом (хімічних реакцій, в яких кожен з продуктів забезпечує затримку за часом, який визначає, коли він буде випущений в системі як «готовий продукт»).
Наприклад, основна транскрипції гена, може бути представлена наступною однокроковою реакцією:
Крім того, там компроміс між шумом в експресії генів, швидкістю, з якою гени можуть перемикатися, і метаболічними витратами, що пов'язані з їх функціонуванням. Більш конкретно, для будь-якого заданого рівня метаболізму вартості, існує оптимальний компроміс між шумом і швидкістю обробки даних і збільшення метаболічної вартості призводить до поліпшення швидкості шуму компромісів.[44][45][46]
У недавній роботі запропонований імітатор (SGNSim, Стохастичних генних мереж Simulator)[47], що можуть моделювати ГРМ де транскрипції і трансляції моделюються з затримкою за часом подій і їх динаміка приводиться в рух за допомогою алгоритму стохастичного моделювання, та в змозі мати справу з декількома затримками за часом подій.
Затримки по часу можна зробити з декількох розподілів і швидкостей реакцій, від складних функцій або від фізичних параметрів. SGNSim може генерувати ансамблі ГРМ в межах набору заданих користувачем параметрів, таких як топологія. Він також може бути використаний для моделювання конкретних ГРМ і системи хімічних реакцій. Генетичні збурення, такі як ген стирання, ген надекспресією, вставки, зсуву рамки мутації можуть також бути змодельовані. ГРМ створюється з графа з необхідною топології, накладаючи вхідні-ступені та вихідні-ступені розподілів. Активність гена промотора впливає на продукти експресії генів, що діють як вхідні сигнали, у вигляді мономерів або об'єднані в мультимери і встановлені в ролі прямої або непрямої. Потім кожен прямий вхід призначений на розташування оператору і різні фактори транскрипції можуть бути дозволені, чи ні, щоб конкурувати за таке ж розташування, в той час як непрямі виходи наведені на цілі. І, нарешті, функція присвоюється кожному гену, що визначає реакцію гена на комбінацію чинників транскрипції (стану промотора). Передавальні функції (тобто гени, що відповідають на комбінацію вхідних сигналів) можуть бути віднесені до кожної комбінації стану промотора, як хотілося б.
В іншій недавній роботі, були розроблені великомасштабні моделі генних регуляторних мереж, акцент був на синтетичних біологічних додатках. Ця модель біомолекулярних взаємодій використовувалася для моделювання в транскрипції, трансляції, регулювання та індукції ГРМ, спрямовуючи конструкцію синтетичних систем.[48]
Інші роботи
Одна з інших робот була зосереджена на прогнозуванні рівнів експресії генів у ГРМ. Підходи, які використовуються для моделювання ГРМ були обмежені, щоб їх можна було інтерпретувати в спрощені варіанти мережі. Наприклад, логічні мережі були використані через їх простоту і здатність обробляти дані, але є втрати даних з бінарним представленням генів. Крім того, штучні нейронні мережі можуть бути опущені через інтерпретацію, та використовувати приховані прошарки таким чином, що вони втратять здатність моделювати вищі кореляції порядку в даних. Використовуючи модель, яка не вимушена інтерпретуватися, можна отримати більш точну модель. Можливість передбачення експресії генів дає можливість більш точно досліджувати, як наркотики впливають на систему генів, а також для виявлення, які гени взаємопов'язані в процесі. Це була заохочувальна мрія, яка сприяла конкуренції[49] за найкращі алгоритми прогнозування.[50] Деякі інші недавні дослідження використовували штучні нейронні мережі з прихованим прошарком.[51]
Див. також
Примітки
- Transcriptional Regulatory Networks in Saccharomyces cerevisiae. Young Lab.
- Davidson E, Levin M; Levin (April 2005). Gene regulatory networks. Proc. Natl. Acad. Sci. U.S.A. 102 (14): 4935. PMC 556010. PMID 15809445. doi:10.1073/pnas.0502024102.
- Florian Leitner, Martin Krallinger, Sushil Tripathi, Martin Kuiper, Astrid Lægreid and Alfonso Valencia, Mining cis-Regulatory Transcription Networks from Literature, Proceedings of BioLINK Special Interest Group, 5–12, ISBM/ECCB, 2013
- Vibhor Kumar, Masafumi Muratani, Nirmala Arul Rayan, Petra Kraus, Thomas Lufkin, Huck Hui Ng and Shyam Prabhakar, Uniform, optimal signal processing of mapped deep-sequencing data, Nature biotechnology, 2013
- Barabasi, A.; Oltvai, Z. N. (2004). Network biology: understanding the cells' functional organization. Nature Reviews Genetics 5 (2): 101–113. PMID 14735121. doi:10.1038/nrg1272.
- Wagner, G. P.; J. Zhang (2011). The pleiotropic structure of the genotype-phenotype map: the evolvability of complex organisms. Nature Review Genetics 12: 204–213. doi:10.1038/nrg2949.
- Robert D Leclerc (August 2008). Survival of the sparest: robust gene networks are parsimonious. Molecular Systems Biology 4 (1): 213. PMC 2538912. PMID 18682703. doi:10.1038/msb.2008.52.
- Jukam; Xie, D. B.; Rister, J.; Terrell, D.; Charlton-Perkins, M.; Pistillo, D.; Gebelein, B.; Desplan, C. та ін. (2013). Opposite feedbacks in the Hippo pathway for growth control and neural fate. Science 342: 211–219. doi:10.1126/science.1238016.
- Hoyos, E.; Kim, K.; Milloz, J.; Barkoulas, M.; Penigault, J.; Munro, E.; Felix, M. (2011). Quantitative variation in autocrine signaling and pathway crosstalk in the Caenorhabditis vulva network. Current Biology 21 (7): 527–538. PMID 21458263. doi:10.1016/j.cub.2011.02.040.
- Shen-Orr, Shai S.; Milo, Ron; Mangan, Shmoolik; Alon, Uri (1 травня 2002). Network motifs in the transcriptional regulation network of Escherichia coli. Nature Genetics 31 (1): 64–68. ISSN 1061-4036. PMID 11967538. doi:10.1038/ng881.
- Lee, Tong Ihn; Rinaldi, Nicola J.; Robert, François; Odom, Duncan T.; Bar-Joseph, Ziv; Gerber, Georg K.; Hannett, Nancy M.; Harbison, Christopher T. та ін. (25 жовтня 2002). Transcriptional Regulatory Networks in Saccharomyces cerevisiae. Science 298 (5594): 799–804. ISSN 0036-8075. PMID 12399584. doi:10.1126/science.1075090.
- Boyle, Alan P.; Araya, Carlos L.; Brdlik, Cathleen; Cayting, Philip; Cheng, Chao; Cheng, Yong; Gardner, Kathryn; Hillier, LaDeana W. та ін. (28 серпня 2014). Comparative analysis of regulatory information and circuits across distant species. Nature 512 (7515): 453–456. ISSN 0028-0836. PMC 4336544. PMID 25164757. doi:10.1038/nature13668.
- Conant, Gavin C; Wagner, Andreas (1 січня 2003). Convergent evolution of gene circuits. Nature Genetics 34 (3): 264–6. PMID 12819781. doi:10.1038/ng1181.
- Mangan, S.; Alon, U. (14 жовтня 2003). Structure and function of the feed-forward loop network motif. Proceedings of the National Academy of Sciences 100 (21): 11980–11985. ISSN 0027-8424. PMC 218699. PMID 14530388. doi:10.1073/pnas.2133841100.
- Goentoro, Lea; Shoval, Oren; Kirschner, Marc W.; Alon, Uri (12 листопада 2009). The Incoherent Feedforward Loop Can Provide Fold-Change Detection in Gene Regulation. Molecular Cell 36 (5): 894–899. ISSN 1097-2765. PMC 2896310. PMID 20005851. doi:10.1016/j.molcel.2009.11.018.
- Mangan, S.; Itzkovitz, S.; Zaslaver, A.; Alon, U. (10 березня 2006). The Incoherent Feed-forward Loop Accelerates the Response-time of the gal System of Escherichia coli. Journal of Molecular Biology 356 (5): 1073–1081. PMID 16406067. doi:10.1016/j.jmb.2005.12.003.
- Mangan, S; Zaslaver, A; Alon, U (21 листопада 2003). The Coherent Feedforward Loop Serves as a Sign-sensitive Delay Element in Transcription Networks. Journal of Molecular Biology 334 (2): 197–204. PMID 14607112. doi:10.1016/j.jmb.2003.09.049.
- Goentoro, Lea; Kirschner, Marc W. (12 листопада 2009). Evidence that Fold-Change, and Not Absolute Level, of β-Catenin Dictates Wnt Signaling. Molecular Cell 36 (5): 872–884. ISSN 1097-2765. PMC 2921914. PMID 20005849. doi:10.1016/j.molcel.2009.11.017.
- Kvitek, Daniel J.; Sherlock, Gavin (21 листопада 2013). Whole Genome, Whole Population Sequencing Reveals That Loss of Signaling Networks Is the Major Adaptive Strategy in a Constant Environment. PLoS Genet 9 (11): e1003972. PMC 3836717. PMID 24278038. doi:10.1371/journal.pgen.1003972.
- Lynch, Michael (1 січня 2007). The evolution of genetic networks by non-adaptive processes. Nature Reviews Genetics 8 (10): 803–813. doi:10.1038/nrg2192.
- Cordero, Otto X.; Hogeweg, Paulien (1 жовтня 2006). Feed-Forward Loop Circuits as a Side Effect of Genome Evolution. Molecular Biology and Evolution 23 (10): 1931–1936. ISSN 0737-4038. PMID 16840361. doi:10.1093/molbev/msl060.
- Filloux, AAM (editor) (2012). Bacterial Regulatory Networks. Caister Academic Press. ISBN 978-1-908230-03-4.
- Gross, R; Beier, D (editor) (2012). Two-Component Systems in Bacteria. Caister Academic Press. ISBN 978-1-908230-08-9.
- Requena, JM (editor) (2012). Stress Response in Microbiology. Caister Academic Press. ISBN 978-1-908230-04-1.
- Chu D, Zabet NR, Mitavskiy B; Zabet; Mitavskiy (April 2009). Models of transcription factor binding: sensitivity of activation functions to model assumptions. J. Theor. Biol. 257 (3): 419–29. PMID 19121637. doi:10.1016/j.jtbi.2008.11.026.
- Kauffman, Stuart (1993). The Origins of Order. ISBN 0-19-505811-9.
- Kauffman SA (1969). Metabolic stability and epigenesis in randomly constructed genetic nets. Journal of Theoretical Biology 22 (3): 437–467. PMID 5803332. doi:10.1016/0022-5193(69)90015-0.[недоступне посилання з 01.01.2017]
- Lovrics A, Gao Y, Juhász B, Bock I, Byrne HM, Dinnyés A, Kovács KA (November 2014). Boolean modelling reveals new regulatory connections between transcription factors orchestrating the development of the ventral spinal cord. PLOS ONE 9 (11): 11430. PMC 4232242. PMID 25398016. doi:10.1371/journal.pone.0111430.
- Vohradsky J (September 2001). Neural model of the genetic network. J. Biol. Chem. 276 (39): 36168–73. PMID 11395518. doi:10.1074/jbc.M104391200.[недоступне посилання]
- Geard N, Wiles J; Wiles (2005). A gene network model for developing cell lineages. Artif. Life 11 (3): 249–67. PMID 16053570. doi:10.1162/1064546054407202.
- Schilstra MJ, Bolouri H (2 січня 2002). Modelling the Regulation of Gene Expression in Genetic Regulatory Networks. Biocomputation group, University of Hertfordshire. Архів оригіналу за 13 жовтня 2007. Процитовано 11 січня 2017.
- Knabe JF, Nehaniv CL, Schilstra MJ, Quick T (2006). Evolving Biological Clocks using Genetic Regulatory Networks. Proceedings of the Artificial Life X Conference (Alife 10). MIT Press. с. 15–21.
- Knabe JF, Nehaniv CL, Schilstra MJ (2006). Evolutionary Robustness of Differentiation in Genetic Regulatory Networks. Proceedings of the 7th German Workshop on Artificial Life 2006 (GWAL-7). Berlin: Akademische Verlagsgesellschaft Aka. с. 75–84.
- Knabe JF, Schilstra MJ, Nehaniv CL (2008). Evolution and Morphogenesis of Differentiated Multicellular Organisms: Autonomously Generated Diffusion Gradients for Positional Information. Artificial Life XI: Proceedings of the Eleventh International Conference on the Simulation and Synthesis of Living Systems. MIT Press.
- Elowitz MB, Levine AJ, Siggia ED, Swain PS; Levine; Siggia; Swain (August 2002). Stochastic gene expression in a single cell. Science 297 (5584): 1183–6. PMID 12183631. doi:10.1126/science.1070919.
- Blake WJ, KAErn M, Cantor CR, Collins JJ; Kaern; Cantor; Collins (April 2003). Noise in eukaryotic gene expression. Nature 422 (6932): 633–7. PMID 12687005. doi:10.1038/nature01546. Архів оригіналу за 10 червня 2012. Процитовано 9 квітня 2019.
- Arkin A, Ross J, McAdams HH; Ross; McAdams (August 1998). Stochastic kinetic analysis of developmental pathway bifurcation in phage lambda-infected Escherichia coli cells. Genetics 149 (4): 1633–48. PMC 1460268. PMID 9691025.
- Raser JM, O'Shea EK; O'Shea (September 2005). Noise in Gene Expression: Origins, Consequences, and Control. Science 309 (5743): 2010–3. PMC 1360161. PMID 16179466. doi:10.1126/science.1105891.
- Elowitz MB, Leibler S; Leibler (January 2000). A synthetic oscillatory network of transcriptional regulators. Nature 403 (6767): 335–8. PMID 10659856. doi:10.1038/35002125.
- Gardner TS, Cantor CR, Collins JJ; Cantor; Collins (January 2000). Construction of a genetic toggle switch in Escherichia coli. Nature 403 (6767): 339–42. PMID 10659857. doi:10.1038/35002131.
- Gillespie DT (1976). A general method for numerically simulating the stochastic time evolution of coupled chemical reactions. J. Comput. Phys. 22 (4): 403–34. doi:10.1016/0021-9991(76)90041-3.
- Roussel MR, Zhu R; Zhu (November 2006). Validation of an algorithm for delay stochastic simulation of transcription and translation in prokaryotic gene expression. Phys Biol 3 (4): 274–84. PMID 17200603. doi:10.1088/1478-3975/3/4/005.
- Ribeiro A, Zhu R, Kauffman SA; Zhu; Kauffman (November 2006). A general modeling strategy for gene regulatory networks with stochastic dynamics. J. Comput. Biol. 13 (9): 1630–9. PMID 17147485. doi:10.1089/cmb.2006.13.1630.
- Zabet NR, Chu DF; Chu (June 2010). Computational limits to binary genes. Journal of the Royal Society Interface 7 (47): 945–954. PMC 2871807. PMID 20007173. doi:10.1098/rsif.2009.0474.
- Chu DF, Zabet NR, Hone ANW; Zabet; Hone (May–Jun 2011). Optimal Parameter Settings for Information Processing in Gene Regulatory Networks. BioSystems 104 (2–3): 99–108. PMID 21256918. doi:10.1016/j.biosystems.2011.01.006.
- Zabet NR (September 2011). Negative feedback and physical limits of genes. Journal of Theoretical Biology 248 (1): 82–91. PMID 21723295. doi:10.1016/j.jtbi.2011.06.021.
- Ribeiro AS, Lloyd-Price J; Lloyd-Price (March 2007). SGN Sim, a stochastic genetic networks simulator. Bioinformatics 23 (6): 777–9. PMID 17267430. doi:10.1093/bioinformatics/btm004.
- Kaznessis YN (2007). Models for synthetic biology. BMC Syst Biol 1: 47. PMC 2194732. PMID 17986347. doi:10.1186/1752-0509-1-47.
- The DREAM Project. Columbia University Center for Multiscale Analysis Genomic and Cellular Networks (MAGNet).
- Gustafsson M, Hörnquist M; Hörnquist (2010). Gene Expression Prediction by Soft Integration and the Elastic Net—Best Performance of the DREAM3 Gene Expression Challenge. PLoS ONE 5 (2): e9134. PMC 2821917. PMID 20169069. doi:10.1371/journal.pone.0009134.
- Smith MR, Clement M, Martinez T, Snell Q (2010). Time Series Gene Expression Prediction using Neural Networks with Hidden Layers. Proceedings of the 7th Biotechnology and Bioinformatics Symposium (BIOT 2010). с. 67–69.
Джерела
- Bolouri, Hamid Bower, James M. (2001). Computational modeling of genetic and biochemical networks. Cambridge, Mass: MIT Press. ISBN .
- Kauffman SA (1969). «Metabolic stability and epigenesis in randomly constructed genetic nets». J. Theor. Biol. 22: 434–67.
Посилання
- Plant Transcription Factor Database and Plant Transcriptional Regulation Data and Analysis Platform
- Open source web service for GRN analysis
- BIB: Yeast Biological Interaction Browser
- Graphical Gaussian models for genome data — Inference of gene association networks with GGMs
- A bibliography on learning causal networks of gene interactions — regularly updated, contains hundreds of links to papers from bioinformatics, statistics, machine learning.
- https://web.archive.org/web/20060907074456/http://mips.gsf.de/proj/biorel/ BIOREL is a web-based resource for quantitative estimation of the gene network bias in relation to available database information about gene activity/function/properties/associations/interactio.
- Evolving Biological Clocks using Genetic Regulatory Networks — Information page with model source code and Java applet.
- Engineered Gene Networks
- Tutorial: Genetic Algorithms and their Application to the Artificial Evolution of Genetic Regulatory Networks
- BEN: a web-based resource for exploring the connections between genes, diseases, and other biomedical entities
- Global protein-protein interaction and gene regulation network of Arabidopsis thaliana
