Гідроенергетика градієнта солоності
Гідроенергетика градієнта солоності, молекулярна гідроенергетика градієнта солоності, осмотична гідроенергетика (англ. salinity gradient hydropower, molecular salinity gradient hydropower, osmotic power) — міждисциплінарна наука та галузь, складова частина молекулярної гідроенергетики, яка вивчає та використовує градієнт солоності природних та антропогенних розчинів для вироблення, накопичення, транспортування та розподілу електричної енергії.
Як наука гідроенергетика градієнта солоності ввібрала в себе методології молекулярної фізики, хімічної кінетики, електрокінетики, електрохімії мембран, гідродинаміки та термодинаміки. Її поява асоціюється з фізико-хімічними методами очистки та опріснення води для промислових і господарсько-питних потреб, очищення та демінералізації стоків, обезводнення нафтопродуктів тощо.
Об'єктами досліджень гідроенергетики градієнта солоності є енергетичний потенціал градієнта солоності, розчини різної солоності природного, антропологічного та інженерного походження, мембранні рушії, їх енергетичні параметри та характеристики, молекулярні технології та системи гідроенергетики градієнта солоності, іншими словами, способи та технічні засоби перетворення енергії градієнта солоності в електричну енергію безпосередньо або опосередковано.
Гідроенергетика градієнта солоності є також складовою частиною класичної гідроенергетики, в основі якої лежать закони гідродинаміки, що описують рух нестисливої рідини та її взаємодію з твердими тілами, а також закони гідростатики, що оцінюють рівновагу рідини та її дію на занурені в нею тіла. Тож, при розрахунках параметрів та характеристик складових елементів та систем гідроенергетики градієнта солоності поряд з енергетичними характеристиками малих частинок всередині та на межі фаз, як правило, застосовуються також макроскопічні параметри (швидкість, тиск, густина) потоків рідини (флюїду).[1]
Історія
Різноманіття атомів та молекул а також хімічних зв'язків між ними породжує в природі трансформаційні процеси та розмаїття енергетичних станів у гідросфері, до яких відноситься також і градієнт солоності води. Енергія градієнта солоності проявляється через фізичне явище осмосу в переміщенні великих мас води різної щільності й солоності в морях та океанах. супроводжується енергетичними перетвореннями, розсіюванням та втратою енергії. У разі використання високотехнологічних рішень можна виділити корисну енергію та перетворити її в електричну енергію. Відзначимо, що градієнт солоності є відновлюваним джерелом енергії, його відновлення пов'язано з річним колообігом води в природі. Атомістично-молекулярна та йонно-молекулярна природа енергії, яка виділяється при змішуванні розчинів різної солоності, вочевидь, потребує співвимірних атомістично-молекулярних та йонно-молекулярних технологій освоювання цієї енергії.
Перші обережні припущення Паттле[2], Нормана[3], Лоеба та ін.[4] про можливість використання градієнта солоності для виробництва енергії відкрили дорогу аналітичним та експериментальним дослідженням Лі та ін.[5], Сеппали та Лампінена, Поста та ін.[6], Торсена та Холта, Ніжмейжера та Метца, Ачіллі та Чайдреса[7], Таніоки та ін., Уіпа та Елімелеха, Логана та Елімелеха, Щацле та Бізмана, Чіполліна та Мікале[8], Туаті та ін.[9], які стосуються фізики та хімії градієнта солоності, його енергетичного потенціалу, технологій забарного осмосу та зворотного електродіалізу для виробництва електричної енергії з градієнта солоності. Запропоновані авторами схемні рішення енергогенеруючих систем та окремих компонентів фактично зумовили появу пілотних електростанцій і, що не менш важливо, заклали основу молекулярної гідроенергетики градієнта солоності.
Ефективне перетворення та вивільнення енергії градієнта солоності, скажімо, водних розчинів різної концентрації речовини, може бути здійснено зокрема, за допомогою фізичних та хімічних явищ осмосу та зворотного електродіалізу, які виникають на межі фаз. Поряд з вище названими явищами для створення молекулярних систем відновлюваної гідроенергетики градієнта солоності застосовні також фізичні явища змочування, адгезії, когезії, капілярного ефекту, адсорбції, абсорбції тощо в рідинах та їх розчинах а ще поєднання цих ефектів. Звідсіля витікає і поділ молекулярних систем гідроенергетики градієнта солоності на осмотичні, електродіалізні, ємнісні тощо. Названі типи систем можуть інтегруватися з молекулярними системами гідроенергетики міжфазної поверхні, зокрема, з гідроадзезійними та гідроабсорбційними системами. Класифікація молекулярних технологій та систем гідроенергетики градієнта солоності є умовною, бо на практиці вони нерідко інтегруються.
Схеми, конструкції, параметри та характеристики елементів та систем гідроенергетики градієнта солоності досліджуються в рамках молекулярної фізики, фізики та хімії поверхні, молекулярної гідродинаміки, термодинаміки та електродинаміки.
Осмотичні технології та системи гідроенергетики градієнта солоності (енергетичні технології та системи забарного осмосу)
Молекулярна гідроенергетична технологія забарного осмосу (англ. molecular pressure retarded osmosis hydropower technology або PRO hydropower technology) — сукупність способів та технічних засобів, які забезпечують виробництво та накопичення електричної енергії, використовуючи енергію градієнта солоності в процесі забарного осмосу.
Основні поняття
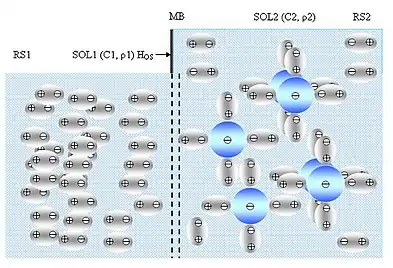
Осмос — відоме фізичне явище, яке характерне для дисперсних систем. Він доставляє капілярами воду та поживні речовини до найвіддаленіших гілок дерева, регулює обмін речовин в організмі живих істот. Здавен люди використовують гігроскопічні особливості кам'яної солі для зберігання їжі. Одним із різновидів дисперсної системи є розчин — суміш кількох речовин (рис. 6.1). Одна речовина в розчині є переважаючою й зветься розчинником або дисперсійним середовищем (англ. dispersion medium) DM, а решта — розчинені домішки або дисперсна фаза (англ. dispersed phase) DP.
За розмірами частинок розчини поділяють на справжні (звичайні), колоїдні (колоїднодисперсні або ультрамікрогетерогенні), мікрогетерогенні та грубодисперсні або суспензії.
Справжні розчини є сумішшю розчинника та розчиненої речовини, речовина подрібнена на окремі молекули або йони. Розмір частинок — r ≈ 10–9 м. Справжнім розчинам притаманна взаємодія між частинками розчинника й розчиненої речовини, фільтруванням їх розділити неможливо. Вони стійкі в часі, не старіють, можуть існувати нескінченно довго, якщо не відбувається хімічних реакцій. Як правило, вони є оптично прозорими.
У колоїдних (колоїднодисперсних або ультрамікрогетерогенних) розчинах частинки речовини є агрегаціями з кількох молекул розміром 10–9 м < r < 10–7 м. Частинки проходять через паперові фільтри, але затримуються пергаментними. Колоїдні розчини відносно стійкі, проте, згодом старіють. Вони є оптично прозорими й виявляють ефект Тіндаля — дозволяють візуальне спостереження променя світла при проходженні його крізь розчин.
Грубодисперсні розчини (суспензії) мають розміри частинок r > 10–4 м.
Дисперсні системи мають велику поверхню поділу між фазою та середовищем і велику поверхневу енергію Гіббза. Вони характеризуються процесами адсорбції, коагуляції (злипання дисперсних частинок) та утворення макроструктур. Ці процеси знижують поверхневу енергію. Частинки колоїднодисперсних систем майже не осідають. У той же час, частинки мікрогетерогенних та грубоодисперсних систем осідають відносно швидко.
Механізм розчинення є фізико-хімічним процесом. При розчиненні речовини відбувається її фізичне роздрібнення, яке супроводжується поглинанням або виділенням теплоти й навіть утворенням нових речовин. У процесі розчинення можна виділити три стадії: сольватація (гідратація), йонізація та дифузія. Сольватація — це взаємодія частинок розчинної речовини з молекулами розчинника або гідратація у випадку водних розчинів. Йонізація — процес руйнування кристалічної ґратки речовини. Йони або молекули, які оточені молекулами розчинника, називаються сольватами або, у випадку водних розчинів, гідратами. У результаті сольватації відбувається виділення тепла за рахунок утворення нових зв'язків між частинками, а в результаті йонізації — поглинання тепла (енергія витрачається на руйнування зв'язків між частинками в кристалічній ґратці). Загальний тепловий ефект процесу розчинення дорівнює сумі двох названих теплових ефектів. Дифузія — розподіл сольватованих частинок в об'ємі розчинника.
Розчинені речовини знижують хімічний потенціал розчинника.
Осмос — однобічна дифузія розчинника з високим хімічним потенціалом у розчин з низьким хімічним потенціалом через пористу мембрану, що є непроникною для розчиненої речовини. За допомогою осмотичного тиску в системі розчинник–розчин підтримується термодинамічна рівновага. Осмотичний тиск чисельно дорівнює надлишковому зовнішньому тискові, який треба докласти з боку розчину, щоб припинити осмос.
Якщо дві рідини з різною концентрацією розчину помістити поряд (рис. 6.2), розділивши їх напівпроникною мембраною, так що вона пропускатиме розчинник, а не речовину, бо молекули розчинника менші за молекули розчиненої речовини, рівень більш концентрованого розчину зростатиме. Більш концентрований розчин буде втягувати розчинник із менш концентрованого розчину, тобто осмотичний тиск розчину вирівнює тиск між розчином та розчинником. Процес триватиме, допоки гідростатичний тиск стовпа рідини зрівняється з осмотичним тиском. Для пришвидшення течії розчинника крізь мембрану потрібно збільшити її ефективну площу.
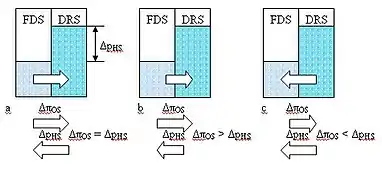
Види осмосу
У разі, коли два розчини, один з низькою концентрацією солі або живильний розчин (англ. feed solution або FDS), інший розчин з високою концентрацією солі або втягуючий розчин (англ. draw solution або DRS), які знаходяться в різних відсіках, розділені напівпроникною мембраною, можна спостерігати чотири різні види осмосу .
Форвардний осмос. Форвардний осмос (англ. forward osmosis або FO) спостерігається у разі, коли різниця осмотичних тисків ΔπOS [Па] в суміжних відсіках є позитивною,
ΔπOS = (πDR − πFD) > 0,
де πDR [Па] — осмотичний тиск у більш концентрованому розчині, πFD [Па] — осмотичний тиск у менш концентрованому розчині, а різниця гідростатичних тисків ΔрHS [Па] у суміжних відсіках дорівнює нулю, рHS-DR = рHS-FD [Па].
Різниця осмотичних тисків є рушійною силою, яка рухає розчинник із розчину з меншою концентрацією солей у розчин з більшою концентрацією солей.
При форвардному осмосі розчин з підвищеною концентрацією поступово розбавляється розчинником. Це знижає рушійну силу, яка рухає потік розчинника через мембрану.
Осмос забарного тиску (забарний осмос). Коли різниця гідростатичних тисків находиться в межах 0 < ΔрHS < ΔπOS, рушійна сила, яка рухає потік розчинника, слабне й дорівнює ΔπOS − ΔрHS . Розчинник ще продовжує проникати із низькоконцентрованого живильного розчину у висококонцентрований втягуючий розчин, але повільніше. Цей процес зветься осмосом забарного тиску або забарним осмосом (англ. pressure-retarded osmosis або PRO). Термін осмос забарного тиску або забарний осмос був запропонований Лоебом та Норманом [222] для опису процесу виробництва енергії з градієнта солоності за допомогою осмотичної мембрани, При забарному осмосі, як і при форвардному, розчин з підвищеною концентрацією поступово розбавляється розчинником. Це знижає рушійну силу, яка рухає потік розчинника через мембрану, і як тільки наступає рівновага осмотичного та гідростатичного тисків ΔрHS = ΔπOS [Па], потік зупиняється.
Зворотний осмос. У разі. коли гідростатичний тиск зі сторони більш концентрованого розчину перевищує осмотичний тиск ΔрHS > ΔπOS, спостерігається явище зворотного осмосу (англ. reverse osmosis). Розчинник переходитиме з більш концентрованого розчину в менш концентрований розчин. Забарний осмос можна розглядати як процес, протилежний зворотному осмосу. У той час, як у процесі зворотного осмосу використовується гідравлічний тиск для протидії осмотичному тиску вхідного живильного розчину, наприклад, морської води для отримання опрісненої води, в процесі забарного осмосу використовується осмотичний тиск морської води для засолення прісної води й створення гідравлічного тиску.
Якоб Гендрік Вант-Гофф виявив залежність осмотичного тиску pOS [Па] від молярної концентрації розчиненої речовини СB [моль/м3] й температури Т [К] розчину, pOS = СB·R·T [Па], де R [Дж/(К·моль)] — газова стала, R = р0·VM/T0 = 8,3144 [Дж/(К·моль)].
Щоб поширити рівняння на розчини з «ненормальним» осмотичним тиском, тиском пари, температурою кипіння та замерзання, більшими, ніж мають бути відповідно до концентрації розчинів, Вант-Гофф використав поправочний ізотонічний коефіцієнт і, який показує, в скільки разів осмотичний тиск даного розчину більший від нормального, pOS = i·СB·R·T = (nM/V)·R·T [Па], де nM — число молів речовини, розчиненої в об'ємі V [м3] розчину, i·СB — осмолярність розчину, тобто добуток фактора Вант-Гоффа i та молярної концентрації розчиненої речовини СB, для бінарного хлориду натрію i = 2.
Ізотонічний коефіцієнт (фактор Вант-Гоффа) означає кількість активних частинок у розчині, i = 1 + α (v — 1), де α — ступінь дисоціації або коефіцієнт дисоціації, кількісний показник, обчислений як відношення числа формульних одиниць розчиненої речовини, що розпалися на йони, до їх загального числа.
При дуже малій концентрації ступінь дисоціації α → 1, тобто всі молекули дисоційовані, v — стехіометричний коефіцієнт у рівнянні реакції дисоціації (для NaCl, α = 1 та v = 2, так що i = 2).
Для розчину з кількома розчиненими речовинами загальний осмотичний тиск є сумою окремих тисків. Якщо створити тиск зі сторони більш концентрованої речовини, спостерігається збільшення концентрації розчину внаслідок зворотного осмосу — зворотної дифузії розчинника. У випадку, коли мембрана проникна для розчинника й деяких розчинених речовин, перенесення останніх з розчину в розчинник дозволяє здійснити діаліз.
Осмотичний тиск є проявом колігативних властивостей розчину — він зростає пропорційно кількості частинок розчиненої речовини й не залежить від їх маси. Осмос може виконувати механічну роботу, наприклад, піднімати рідину.
У рамках молекулярної енергетики використовується також термін диффузіофорез — рух частинок речовини під дією градієнта дифузії (концентрації) молекулярних речовин у розчині. Явище, зворотне диффузіофорезу є капілярний осмос.
Згідно Кацу та ін., осмос — поширене фізичне явище, яке люди використовують здавен. Сіль використовувалася для осушення продуктів і тривалого їх зберігання. У сольових середовищах більшість бактерій, грибів та інших потенційно патогенних організмів зневоднюється й гине або тимчасово дезактивується внаслідок осмотичного процесу.
Осмотичний тиск є реальною рушійною силою. Він може бути застосований у багатьох сферах нашого життя, починаючи з очистки та опріснення морської води й закінчуючи дозуванням ліків. У технології забарного осмосу використовується різниця осмотичних тисків між розчинами різної концентрації солей, характерними, наприклад, для морської та прісної річкової води, з метою підвищення гідростатичного тиску концентрованого розчину й подальшого перетворення напору рідини в електричну енергію.
Вільна енергія Гіббза змішаних розчинів
Кількість енергії, яка може бути вироблена з градієнта солоності двох розчинів, розраховується, виходячи з поняття вільної енергії Гіббза [87]. При змішуванні живильного низькоконцентрованого розчину (розчинника), який володіє вільною енергією Гіббза GFD [Дж], та втягуючого висококонцентрованого розчину, який володіє вільною енергією Гіббза GDR [Дж], кількість енергії, що виділяється, дорівнює зміні вільної енергії Гіббза ΔGМ [Дж] [286],
ΔGМ = GM — GDR — GFD [Дж].
де GM [Дж] — вільна енергія Гіббза змішаного розчину.
Для системи із s розчинів вільна енергія Гіббза визначається через хімічні потенціали складових частинок μi [Дж/моль] i-го виду, G = Σis μi·nМi [Дж], де μi [Дж/моль] — хімічний потенціал i-ї частинки, nМi [моль] — кількість частинок або кількість речовини.
Торсен та Холт наводять похідну формулу для розрахунку зміни вільної енергії Гіббза ΔGМ при змішуванні 1 моля прісної води з нескінченною кількістю морської води,
ΔGМ = R·T·ln χH2O [Дж], (6.22)
де χH2O — мольна частка води в морській воді, R [Дж/(моль·К)] — газова стала, R = 8,314 Дж/(моль·К)–1, T [К] — абсолютна температура.
Морська вода має ту ж саму осмолярність, що й водний розчин NaCl концентрацією 32 г/л. Згідно Торсену та Холту, в цьому розчині концентрації солі NaCl та води Н2О становлять відповідно 0,549 моль/л (1,1 коефіцієнт еквівалентності) та 54,92 моль/л. При температурі 20 0C значення, наведені вище, при підставці у формулу (6.22) дають GМ = 48,1 Дж/моль або 2,7 кДж/кг для прісної води. При молярному об'ємі води 18·10−6 м3/моль це відповідає осмотичному тиску 26,7 атм.
Зміна внутрішньої енергії dE [Дж] дорівнює роботі dW [Дж] при дотриманні закону збереження енергії, dE = Сp·dT = dW [Дж], де Сp [Дж/(моль·К)–1] — теплоємність системи.
Щоб збагнути потенціал нового джерела, порівняємо отримані рівні енергії з енергією інших відомих джерел. Теплотворна спроможність природного газу складає 28,4 МДж/м3 теплової енергії або 31,8 МДж/кг (8 Мкал/кг). Для порівняння, теплота згорання одного кілограма умовного палива (у. п.) складає 29,3 МДж або 7 Мкал, що відповідає теплотворній спроможності низькокалорійного антрациту. Наведемо також інший приклад. Враховуючи, що питома теплоємність води (Н2О) складає cHC = 4,2 кДж·кг−1·К−1 а питома маса — mHTF = 1000 кг/м3, то поглинання тепла, рівного Е = 2,7 МДж, такою кількістю води приведе до її нагівання на ΔТ [К],
ΔT = Е/(mHTF·cHC) =
= 2700 кДж/(1000 кг/м3·4,2 кДж·кг−1·К−1) = 0,64 К. (6.24)
Ці цифри свідчать про те, що енергетичний потенціал градієнта солоності по отриманню відновлюваної енергії є величезним, але його реалізація потребує руху великих мас води.
Поновлюваність градієнта солоності забезпечується річним кругообігом води в природі. За рахунок сонячного випромінювання вода випаровується з океанів, морів та озер, опадає на поверхню материкової суші у вигляді дощу та снігу й збігає річками в моря та океани, по дорозі збагачуючись мінералами. При впадінні річки в море прісна вода змішується з солоною морською водою. Різниця концентрацій річкової та морської води створює енергетичний потенціал, який еквівалентний гідростатичному тиску, котрий створюється греблею. Висоту або гідростатичний напір такої греблі можна розрахувати з різниці осмотичних тисків, яка утворюється на межі розчинів різної солоності.
Концентрація солі NaCl у морській воді находиться в межах 3—4 % або 30—40 г/л (0,51—0,68 моль/л). При температурі 300 К, концентрації СB = 0,51·103 моль/м3 та кількості активних частинок i = 2 у розчині осмотичний тиск πOS дорівнює
πOS = i· СB·R·T =
= 2·0,51·103 (моль/м3)·8,3144 [Дж/(К·моль)]·300 К =
= 2,54 МПа ≈ 25 атм.
У середньому осмотичний тиск морської води складає 27 атм. Цей тиск урівноважує стовп води висотою h = 27 атм·10,33 (м/атм) = 278,91 м над рівнем моря.
Якщо відома кількість енергії. яка виділяється при змішувані розчинів різної солоності, то напір води, який відповідає цій енергії, можна визначити за допомогою виразу для потенціальної енергії. Наприклад, напір води, який відповідає енергії Е = 2,7·106 Дж, що виділяється при змішуванні 1 м3 річкової води з морською водою, визначається так
h = Е/(m·g) =
= 2,7·106 Дж/[103 кг·9,81 (м/с2)] = 276 м.
де m [кг] — маса води, m = 103 кг; g [м/с2] — прискорення вільного падіння, на рівні моря g = 9,81 м/с2.
Тож, градієнт солоності дозволяє виробити близько 2,7 МДж або 0,75 кВт·год на 1 м3 прісної води, враховуючи що 1 кВт·год = 3,6·106 Дж. При інтенсивності змішування річкової води з морською водою 1 м3/с теоретично досяжна потужність електростанції складає PHPP = 2,7 МВт.
Енергетичні технології та системи забарного осмосу
Молекулярна енергетична технологія забарного осмосу складається з послідовності певних операцій або процесів, які виконуються за допомогою сукупності технічних засобів, зведених у молекулярні системи гідроенергетики забарного осмосу.
Молекулярна гідроенергетична система забарного осмосу (англ. molecular pressure retarded osmosis hydropower system або PRO hydropower system) — сукупність молекулярних технологій та обладнання для отримання електричного струму з градієнта солоності в процесі забарного осмосу.
В розрахунках параметрів та характеристик молекулярної системи забарного осмосу, окрім глибинних енергетичних властивостей градієнта солоності, враховуються макроскопічні параметри речовини та поля, як-от швидкість, напрям руху, тиск, питома густина молекул, поєднаних у водний потік.
Системи забарного осмосу можуть бути класифіковані за принципом використання потоку флюїду, за походженням та способом використання розчинів, за способом активації забарного осмосу, за конструктивними особливостями побудови мембранного модуля тощо.
У залежності від принципу використання потоку флюїду розрізняють осмотичні системи гідроакумулювального типу та прямої генерації.
У гідроакумулювальних системах рідина, наприклад, живильний водний розчин спочатку перетікає в резервуар з втягуючим розчином, накопичується там, перш ніж потенціальна енергія накопиченої рідини буде перетворена в кінетичну енергію падаючого потоку а потім гідротурбіни, далі, за рахунок електродинамічних трансформацій — в електрику. Пряма генерація електричної енергії досягається обертанням гідротурбіни та механічно з'єднаного з нею ротора гідрогенератора інтенсивним потоком рідини, сформованим в обмеженому просторі певного флюїдопроводу рушійною силою осмотичного тиску. Так електрична енергія виробляється в реальному масштабі часу, оминаючи етап гідроакумулювання.
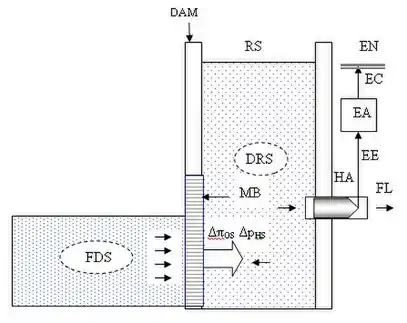
Структурна схема базової гідроакумулювальної електростанції на основі забарного осмосу включає резервуар RS, греблю DАМ, напівпроникну мембрану MB, гідроагрегат НА та електричний адаптер EA. Інші позначення:
- FDS — живильний низькоконцентрований розчин або розчинник
- DRS — втягуючий висококонцентрований розчин
- FL — рушійний потік рідини
- ΔπOS — різниця осмотичних тисків на рівні мембрани
- ΔpНS — різниця гідростатичних тисків
- ЕE — електрична енергія
- EC — електричний струм
- ЕN — електрична мережа.
Існуючі мембрани забарного осмосу, зазвичай, складаються з тонкого щільного робочого шару та пористої підкладки, яка придає мембрані механічну стійкість. Розміри пор підкладки перевищують розміри пор робочого шару. Тож, мембрани є асиметричними елементами.
У вихідному положенні втягуючий висококонцентрований розчин DRS, наприклад, хлориду натрію NaCl перебуває в резервуарі RS і відділений від живильного низькоконцентрованого розчину FDS греблею DАМ та напівпроникною мембраною MB.
Мембрана MB є осмотичним мікрофлюїдним рушієм, який виконує роль насосної системи. Вона вільно пропускає молекули низько концентрованого розчину FDS в резервуар RS із втягуючим висококонцентрованим розчином DRS, проте, перешкоджає проникненню солі у відсік із живильним низькоконцентрованим розчином або розчинником FDS.
Гідроагрегат НА є електродинамічним перетворювачем, який включає гідротурбіну HT та гідрогенератор (електрогенератор). Кінетична енергія потоку падаючої рідини ЕK = ЕP2 трансформується спочатку в кінетичну енергію гідротурбіни, а потім кінетична енергія гідротурбіни в електродинамічній системі електрогенератора перетворюється в електричну енергію ЕE.
Джерелом відновлюваної енергії слугує градієнт солоності розчинів різної концентрації речовини.
Термодинамічна система прагне вирівняти хімічні потенціали в усіх частинах свого об'єму та перейти до стану з нижчим рівнем вільної енергії. Це викликає осмотичне перенесення речовини. Під дією осмотичного тиску молекули живильного низькоконцентрованого розчину FDS перетікають у резервуар RS із втягуючим висококонцентрованим розчином DRS та створюють у ньому підняття змішаних розчинів FDS та DRS. Перерозподіл триває, допоки різниця гідростатичних тисків ΔpНS стовпа змішаних розчинів у резервуарі зрівняється з різницею осмотичних тисків ΔπOS на рівні мембрани, ΔpНS = ΔπOS.
У подальшому потенціальна енергія рідини, накопиченої в резервуарі RS, перетворюється при її падінні в кінетичну енергію потоку, яка урухомлює гідроагрегат (з гідрогенератором) НА. Електродинамічна система гідрогенератора обертає механічну енергію ротора (гідротурбіни) в електричну енергію ЕE. Параметри електричної енергії (сила струму ЕС, напруга та частота) доводяться в електричному адаптері EA до необхідних стандартів, і вона спрямовується споживачам та/або в електричну мережу ЕN.
Енергетичні та економічні параметри системи визначаються параметрами забарного осмосу, характеристиками та параметрами розчинів, мембрани та гідроагрегата.
Відзначимо, що осмотичні системи гідроенергетики, які розглядаються, є комбінованими макроскопічно-молекулярними технологічними засобами. Молекулярні технології градієнта солоності застосовуються тільки для накопичення рідини (гідроакумулювання) та/або формування потоку. Перетворення ж кінетичної енергії потоку в електричну енергію відбувається за допомогою традиційних макроскопічних гідроагрегатів — гідротурбін та поєднаних з ними електрогенераторів.
Електродіалізні технології та системи гідроенергетики градієнта солоності
Досліджуючи електродіалізний спосіб опріснення води, Сидні Лоеб прийшов до висновку, що процес, зворотний електродіалізу, дозволяє отримати різницю електричних потенціалів, якщо використати спрямований рух потоків електроліту з різною концентрацією зарядів, розділених напівпроникними мембранами. Зворотний електродіаліз різниться від зворотного електроосмосу характером та напрямком руху речовин.
Молекулярна технологія зворотного електродіалізу (англ. molecular reverse electrodialysis hydropower technology або RED hydropower technology) — сукупність способів та засобів, які забезпечують виробництво та накопичення електричної енергії, використовуючи енергію градієнта солоності в процесі зворотного електродіалізу. Енергетична технологія зворотного електродіалізу складається з послідовності певних операцій або процесів, які виконуються за допомогою технічних засобів, зведених у молекулярні системи гідроенергетики зворотного електродіалізу.
Молекулярна система гідроенергетики зворотного електродіалізу (англ. molecular reverse electrodialysis hydropower system або RED hydropower system) — сукупність молекулярних технологій та обладнання для отримання електричного струму з градієнта солоності в процесі зворотного електродіалізу. У розрахунках параметрів та характеристик системи зворотного електродіалізу, окрім глибинних енергетичних властивостей градієнта солоності використовуються макроскопічні параметри речовини та поля, зокрема, швидкість, напрям руху, тиск, питома густина молекул, поєднаних у водний потік.
Системи зворотного електродіалізу можуть бути класифіковані за принципом використання потоку флюїду, за походженням та способом використання розчинів, за способом активації зворотного електродіалізу, за конструктивними особливостями побудови мембранного модуля тощо. Системи гідроенергетики зворотного електродіалізу, які розглядаються в цьому розділі, є технологічними засобами прямого виробництва електричної енергії.
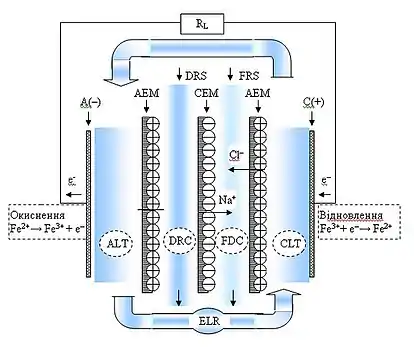
Базова схема комірки зворотного електродіалізу для виробництва електричного струму з градієнта солоності включає відсік низькоконцентрованого розчину FDС, відсік висококонцентрованого розчину DRС, катіонообмінна мембрана СEM, аніонообмінна мембрана AEM, анод A(–), катод C(+), система омивання електродів ELR, католіт CLT, аноліт АLT та зовнішнє електричне навантаження RL. Позначення:
- Cl–, Na+ — йонний струм в електроліті;
- e– — електронний струм
- Fe2+ — e– → Fe3+ — відновна реакція на катоді Fe2+/Fe3+
- Fe3+ + e– → Fe2+ — реакція окиснення на аноді Fe2+/Fe3+.
Стрілками показано напрямки руху розчинів.
Градієнт солоності формується взаємодією низькоконцентрованого FDS та висококонцентрованого DRS розчинів. Ними може бути, наприклад, річкова та солона морська вода. Морська вода як електроліт включає катіони натрію Na+ та аніони хлору Cl–.
Призначенням йонообмінних мембран є поділ зарядів різного знаку та спрямування їх до відповідних електродів з утворенням електрохімічного потенціалу. Аніонообмінна мембрана АЕМ має властивість пропускати негативно заряджені йони в напрямку анода, катіонообмінна мембрана СЕМ має властивість пропускати позитивно заряджені йони в напрямку катода. Електроди анод A(–) та катод C(+) перетворюють йонний струм в електронний через окисно-відновні реакції (які можуть бути зворотними або незворотними) або ж за допомогою йонної адсорбції в ємнісних електродах.
Система омивання електродів активізує окисно-відновні процеси на електродах. Католіт CLT та аноліт АLT — розчини, які утворюються безпосередньо біля катода та анода. Комірка зворотного електродіалізу функціонує так. Відсіки DRС та FDС між мембранами по черзі заповнюються висококонцентрованим DRS та низькоконцентрованим FDS розчинами. Градієнт солоності формує різницю потенціалів (мембранний потенціал) над кожною мембраною МЕМ, тож, різниця електричних потенціалів між зовнішніми відділеннями комірки являє собою суму відмінностей потенціалів на кожній мембрані. Різниця хімічних потенціалів викликає перенесення йонів з висококонцентрованого розчину через мембрани до низькоконцентрованого розчину. При використанні розчину хлориду натрію йони натрію Na+ проникають через катіонообмінну мембрану СЕМ у напрямку катода C(+), а йони хлору Cl– проникають через аніонообмінну мембрану АЕМ у напрямку анода A(–). Електронейтральність розчину в анодному відділенні підтримується шляхом окиснення поверхні анода. Електронейтральність розчину в катодному відділенні підтримується за допомогою реакції відновлення поверхні катода. У результаті, електрон e– переноситься з анода A(–) на катод C(+) через зовнішній електричний ланцюг RL.
Джерела
- Сидоров, В.І. (2020). Гідроенергетика градієнта солоності. В кн. Молекулярна енергетика. Теорія та технічні рішення. (Укр.). Черкаси: Вертикаль, видавець Кандич С.Г. с. 486. ISBN ISBN 978-617-7475-79-7.
- Pattle, R. E. (1954). Production of electric power by mixing fresh and salt water in the hydroelectric pile. Nature. – Vol. 174. – Р. 660-666 (Англ.).
- Norman, R. S. (1974). Water salination: a source of energy. Science. – Vol. 186. – Р. 350-352 (Англ.).
- Loeb, S. (1975). Osmotic power plants. Science. – Vol. 189. – Р. 654-655. (Англ.).
- Lee, K. L., Baker, R. W., Lonsdale, H. K. (1981). Membrane for power generation by pressure retarded osmosis. Journal of Membrane Science. – Vol. 8. – Р. 141-171 (Англ.).
- Post, J. W. et al. (2008). Salinity-gradient power: Evaluation of pressure-retarded osmosis and reverse electrodialysis. Journal of Membrane Science. – 288. – Р. 218-230 (Англ.).
- Achilli, A., Childress, A. E. (2010). Pressure retarded osmosis: From the vision of Sidney Loeb to the first experimental installation. Review Desalination. – Vol. 261 (3). – Р. 205-211 (Англ.).
- Cipollina, A., Micale, G. (2016). Sustainable Energy from Salinity Gradients (Англ.). CambridgeSustainable Energy from Salinity Gradients. – Cambridge: Woodhead Publishing, 2016. – 350: Woodhead Publishing. с. 350.
- Touati, K., Tadeo, F., Kim, J. H. Silva, O. A. (2017). Pressure Retarded Osmosis: Renewable Energy Generation and Recovery. Academic Press. с. 188.
Література
- Сидоров , В.І. (2020). Гідроенергетика градієнта солоності. в кн. Молекулярна енергетика. Теорія та технічні рішення (Укр.). Черкаси: Вертикаль, видавець Кандич С.Г. с. 486. ISBN ISBN 978-617-7475-79-7.
- Hauksbee, F. (1709). Physico-mechanical Experiments on Various Subjects. (Англ.). London, England: printed by R. Brugis. с. 139—169.
- An account of some experiments shown before the Royal Society; with an enquiry into the cause of the ascent and suspension of water in capillary tubes. Philosophical Transactions of the Royal Society of London 30 (355). 1719-12-31. с. 739—747. ISSN 0261-0523. doi:10.1098/rstl.1717.0026. Процитовано 2020-06-26.
- Bernoulli, D. (1738). Hydrodynamica, sive de Viribus et Motibus Fluidorum commentarii. Opus Academicum. (Лат). Strasbourg: Dulsecker.
- Young,, Tomas (1805). An essay on the cohesion of fluids. Philosophical Transactions of the Royal Society of London. — 95. — Р. 65-87. (Англ.).
- Marquis de Laplace, Pierre Simon (1805). Traité de Mécanique Céleste, volume 4 Supplément au dixième livre du Traité de Mécanique Céleste (фр.). Paris, France: Courcier. с. 1–79.
- Gauss, Carl Friedrich (1877). Principia generalia theoriae figurae fluidorum in statu aequilibrii. Werke. Berlin, Heidelberg: Springer Berlin Heidelberg. с. 287—292. ISBN 978-3-642-49320-1.
- Hagen, G. (1839). Ueber die Bewegung des Wassers in engen cylindrischen Röhren. Annalen der Physik und Chemie122 (3). с. 423—442. ISSN 0003-3804. doi:10.1002/andp.18391220304. Процитовано 2020-06-26.
- Poiseuille, J. L. M. (1841). Recherches expérimentales sur le mouvement des liquides dans les tubes de très petits diamètres. Mémoire lu (3e partie, suite). Comptes rendus hebdomadaires des séances de l'Académie des Sciences. — Vol. 12. — Р. 112—115. (фр.).
- Neumann, F. with Wangerin, A. ed., (1894.). Vorlesungen über die Theorie der Capillarität (нім.). Leipzig, Germany: B. G. Teubner.
- Navier, C. L. M. H. (1833.). Résumé des leçons données à l'École des ponts et chaussées sur l'application de la mécanique à l'Établissement des constructions et des machines, tome 2, Deuxième partie, leçons sur le mouvement et la résistance des fluides, la conduite et la distribution des eaux, Troisième partie, leçons sur l'établissement des machines(Фр.). Paris: chez Carilian-Gœury.
- Navier, C. L. M. H. (1833.). Résumé des leçons données à l'École des ponts et chaussées sur l'application de la mécanique à l'Établissement des constructions et des machines, tome 1, Première partie contenant des leçons sur la résistance des matériaux, et sur l'établissement des constructions en terre, en maçonnerie et en charpente (Фр.). Paris: chez Carilian-Gœury.
- Stokes, G. G. (1864). On the discontinuity of arbitrary constants which appear in divergent developments. Transactions of the Cambridge Philosophical Society. — Vol. 10. Part I. — Р. 105—124, 125—128. (Англ.).
- Stokes, G. G. (1856). On the numerical calculation of a class of definite integrals and infinite series. Transactions of the Cambridge Philosophical Society. — Vol. 9. Part I. — Р. 166—188.
- Gibbs, J. W. (1876). On the Equilibrium of Heterogeneous Substances. Transactions of the Connecticut Academy of Sciences (Англ.).
- Van der Waals, J. D. (1873). Over de Continuiteit van den Gas- en Vloeistoftoestand (on the continuity of the gas and liquid state). PhD thesis (Нім.). Leiden, The Netherlands.
- Keesom, W.H. The second virial coefficient for rigid cpherical molecules whose mutual attraction is equivalent to that of a quadruplet placed at its center // Proc. R. Acad. Sci. — 1915.– Vol. 18. — Р. 636—646.
- Debye, P. Zur Theorie der spezifischen Waerme // Annalen der Pyisik. Leipzig. — 1912. — 39(4). — P. 789—839.
- Heitler, W. and London, F. Wechselwirkung neutraler Atome und homöopolare Bindung nach der Quantenmechanik // Zeitschrift für Physik. — 1927. — 44. — Р. 455472.
- Jones, J. E. On the Determination of Molecular Fields. I. From the Variation of the Viscosity of a Gas with Temperature // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1924. — 106 (738). — Р. 441—462.
- Jones, J. E. On the Determination of Molecular Fields. II. From the Equation of State of a Gas // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1924. — 106 (738). — Р. 463.
- Jones, J. E., Ingham, А. Е. On the Calculation of Certain Crystal Potential Constants, and on the Cubic Crystal of Least Potential Energy // Proceedings of the Royal Society. A. — 1925. — 107. — Р. 636—653.
- Garner, W. E., Lennard-Jones, J. E. Molecular Spectra and Molecular Structure. A general discussion // Transactions of the Faraday Society. — 1929. — Т. 25. — Р. 611—627.
- Lennard-Jones, J. E. The electronic structure of some diatomic molecules // Transactions of the Faraday Siciety. 1929. — Vol. 25. — P. 668—686.
- Lennard-Jones, J. E. Wave Functions of Many-Electron Atoms // Mathematical Proceedings of the Cambridge Philosophical Society. — 1931. — 27 (3). — Р. 469.
- Lennard-Jones, J. E. The electronic structure and the interaction of some simple radicals // Transactions of the Faraday Society. — 1934. — Vol. 30. — Р. 70-148
- Lennard-Jones, J. E. The Electronic Structure of Some Polyenes and Aromatic Molecules. I. The Nature of the Links by the Method of Molecular Orbitals // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1937. — 158 (894). — Р. 280.
- Lennard-Jones, J. E. The Molecular Orbital Theory of Chemical Valency. I. The Determination of Molecular Orbitals. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1949. — 198 (1052).
- Hall, G. G., Lennard-Jones, J. E. The Molecular Orbital Theory of Chemical Valency. III. Properties of Molecular Orbitals // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1950. — 202 (1069). — Р. 155.
- Lucas, R. Ueber das Zeitgesetz des Kapillaren Aufstiegs von Flussigkeiten // Kolloid Z. — 1018. — Vol. 23(1). — P. 15-22.
- Washburn, E.W. The Dynamics of Capillary Flow // Physical Review. — 1921. — Vol. 17(3). — P. 273—283.
- Rideal, E. An Introduction to Surface Chemistry. — Cambridge University Press, 1926. 346 p.
- Rideal, E. Bakerian Lectures. On Reactions in Monolayers // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1951. — Vol. 209(1099). — P. 321—446.
- Hamraoui, A. and Nylander, T. Analytical Approach for the Lucas–Washburn Equation // Journal of Colloid and Interface Science. — 2002. — Vol. 250. — Р. 415—421.
- Brunauer, S., Emmet, P.H., Teller, E. Adsorption of Gases in Multimolecular Layers // Journal of American Chemical Society. — 1938. — Vol. 60(2). — P. 309—319.
- Fan, X., Phan-Thien, N., Tanner, R. Numerical Study on Some Rheological Problems of Fibre Suspensions: Numerical Simulations of Fibre Suspensions. — Germany: VDM Verlag Dr Muller, 2008. — 188 р.
- Zheng, R., Tanner, R., Fan, X. Injection Molding: Integration of Theory and Modeling Methods. — Heidelberg Dordrecht London New York: Springer, 2011. — 187 p.
- Warrick, A. W. Soil Water Dynamics. — Oxford University Press, 2003. — 416 р.
- Tabeling, P. Introduction à la microfluidique. — Belin, 2003. — 254 р.
- Squires, T. M., Quake S. R. Microfluidics: Fluid physics at the nanoliter scale // Reviews of Modern Physics. — 2005. — Vol. 77. — Р. 977—1026.
- Bruus, H. Theoretical Microfluidics. — Oxford University Press. 2008. — 346 p.
- Berthier, J. Micro-Drops and Digital Microfluidics — Norvich, NY: William Andrew Inc., 2008. — 441 p.
- Galindo-Rosales, F. J. (Ed.). Complex Fluid-Flows in Microfluidics / Springer International publisher AG, 2018. — 111 p.
- Reuss, F. F. (1808). Notice sur un nouvel effet de l'électricité galvanique. // Mémoires de la Societé Impériale des Naturalistes de Moscou. Mémoires de la Societé Impériale des Naturalistes de Moscou. — Vol. 2. — Р. 327—337. (Фр.).
- Quincke, G. H. (1859). Ueber eine neue Art electrischer Ströme. Ann. Phys. Chem. — Vol. 107. — Р. 1-47. (Нім.).
- Helmholtz, H. (1879). Studien über electrische Grenzschichten. Annalen der Physik. — Vol. 243, Issue 7. — Р. 337—382. (Нім.).
- Gouy, M. (1910). Sur la constitution de la charge électrique à la surface d'un électrolyte. J. de Physique Théorique et Appliquée. — Vol. 9. — Р. 457—468. (Фр.).
- Chapman, D. J. (1913). A contribution to the theory of electrocapillarity. Philos. Mag. — Vol. 25. — Р. 475—481. (Англ.).
- Stern, O. (1924). Zur Theorie der elektrolytischen Doppelschicht. Zeitschrift für Elektrochemie. — Vol. 30. — Р. 508—516.(Нім.).
- Contribution à la théorie de l'endosmose électrique et de quelques phénomènes corrélatifs. Bulletin international de l'Académie des Sciences de Cracovie. — Vol. 8. — Р. 182—200. (Фр.). 1903.
- Hoff, J. H. van't. (1884). Etudes de dynamique chimique (Фр.). Amsterdam: Frederik Muller Publisher. с. 242.
- Arrhenius, S. (1896). On the Influence of Carbonic Acid in the Air upon the Temperature of the Ground. London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science (fifth series). — April. — Vol. 41. — Р. 237—275. (англ.).
- Arrhenius, S. (1884). Recherches sur la conductivité galvanique des électrolytes, doctoral dissertation (Фр.). Stockholm: Royal publishing house, P.A. Norstedt & söner. с. 89.
- Langmuir, I. (1906). The Constitution and Fundamental Properties of Solids and Liquids: II. Liquids. Journal of the American Chemical Society. — Vol. 39 (9). — Р. 1848—1906. (англ.).
- Squires, T. M. and Bazant, M. Z. Breaking symmetries in induced-charge electro-osmosis and electrophoresis // J. Fluid Mech. — 2006. — Vol. 560. — Р. 65-101.
- Духин, С. С., Шилов, В. Н. Диэлектрические явления и двойной слой в дисперсных системах и полиэлектролитах. — Киев: Наук. думка, 1972. — 246 с.
- Dukhin, S. S. & Derjaguin, B. V. Electrokinetic Phenomena. — New York: John Wiley and Sons, 1974.
- Delgado, A. V. Interfacial Electrokinetics and Electrophoresis. — New York, NY: Marcel Dekker, Inc., 2002. — 991 p.
- Ramos, A. (Ed.). Electrokinetics and Electrohydrodynamics in Microsystems — Wien, New York: Springer, 2011. — 300 p.
- Burgreen, D. and Nakache, F. R. Efficiency of Pumping and Power Generation in Ultrafine Electrokinetic Systems J. Appl. Mech. — 1965. — 32 (3). — P. 675—679.
- Chun, M. S., Lee, T. S., and Choi, N. W. Microfluidic Analysis of Electrokinetic Streaming Potential Induced by Microflows of Monovalent Electrolyte Solution Journal of Micromechanics and Microengineering. — 2005. — Vol. 1, № 4. — P. 710—719.
- Van der Heyden, F. H. et al. Power Generation by Pressure-Driven Transport of Ions in Nanofluidic Channels Nano Letters. — 2007. — Vol. 7, № 4. — P. 1022—1025.
- Ren, Y. and Stein, D. Slip-Enhanced Electrokinetic Energy Conversion in Nanofluidic Channels Nanotechnology. — 2008. — Vol. 19, № 19. — Art. № 195707.
- Pattle, R. E. Production of electric power by mixing fresh and salt water in the hydroelectric pile // Nature. — 1954. — Vol. 174. — Р. 660—666.
- Norman, R. S. Water salination: a source of energy // Science. — 1974. — Vol. 186. — Р. 350—352.
- Loeb, S. Osmotic power plants // Science. — 1975. — Vol. 189. — Р. 654—655.
- Loeb, S. Method and apparatus for generating power utilizing pressure-retarded osmosis, United States patent US 3 906 250, 1975.
- Loeb S., Hessen, F., Shahaf, D. Production of energy from concentrated brines by pressure-
- Loeb, S. Method and apparatus for generating power utilizing reverse electrodialysis. United States Patent US4171409, 1977.
- Lee, K. L., Baker, R. W., Lonsdale, H. K. Membrane for power generation by pressure retarded osmosis // Journal of Membrane Science. — 1981. — Vol. 8. — Р. 141—171.
- Post, J. W. et al. Salinity-gradient power: Evaluation of pressure-retarded osmosis and reverse electrodialysis // Journal of Membrane Science. — 2007. — 288. — Р. 218—230.
- Thorsen, T., Holt, T. The potential for power production from salinity gradients by pressure retarded osmosis // Journal of Membrane Science. — 2009. — Vol. 335. — Р. 103—110.
- Nijmeijer, K.; Metz, S. Salinity Gradient Energy. In Sustainability Science and Engineering; Isabel, C. E., Andrea, I. S., Eds.; Elsevier, 2010. — Vol. 2. — Р. 95-139.
- Achilli, A., Childress, A. E. Pressure retarded osmosis: From the vision of Sidney Loeb to the first experimental installation — Review Desalination. — 2010. — Vol. 261 (3). — Р. 205—211.
- Tanioka, А. et al. Power generation by pressure retarded osmosis using concentrated brine from sea water desalination system and treated sewage: review of experience with pilot plant in Japan // 3rd Osmosis Membrane Summit, Statkraft, Barcelona, 2012.
- Yip, N. Y., Elimelech, M. Thermodynamic and energy efficiency analysis of power generation from natural salinity gradients by pressure retarded osmosis // Environ. Sci. Technol. — 2012. — Vol. 46 (9). — Р. 5230-5239.
- Logan, B. E. Elimelech, M. Membrane-based processes for sustainable power generation using water // Nature. — 2012. — Vol. 488. — Р. 313—319.
- Schaetzle, O., Buisman, C. J. N. Salinity Gradient Energy: Current State and New Trends // Engineering. — 2015. — Vol.1, № 2. — Р. 164—166.
- Cipollina, A., Micale, G. Sustainable Energy from Salinity Gradients. — Cambridge: Woodhead Publishing, 2016. — 350 p.
- Touati, K., Tadeo, F., Kim, J. H. Silva, O. A. Pressure Retarded Osmosis: Renewable Energy Generation and Recovery. Academic Press, 2017. — 188 p.