Міжфазна поверхня
Міжфазна поверхня (англ. interface (matter) or interfacial surface) у фізиці та хімії поверхні — це межа між двома просторовими областями, зайнятими різною речовиною або матерією в різних фізичних станах.
.jpg.webp)
С точки зору математики, міжфазна поверхня розглядається як межа або край об'ємного тіла, двовимірне топологічне утворення, геометрична фігура, кожна точка якої та її оточення можуть бути відображені в проекції на площину без розриву. В малих проміжках часу поняття неперервності та квантування не суперечать одне одному і пов'язані між собою в просторі та часі. Неперервна лінія як і неперервна поверхня складаються із окремих дискретних точок. Точка може рухатися на поверхні лише у двох напрямках. Неперервний рух об'єкта складається із множини окремих стрибків. Міжфазна поверхня може бути, зокрема, оболонкою певного тіла, місцем його контакту з іншими тілами, сукупністю точок, розташованих на краю фізичного тіла, або межею об'ємного фізичного тіла — у загальному випадку поверхня являє собою деяку деформовану площину. Поверхня та об'єм — дві різні просторові характеристики одного й того ж тіла. Під об'ємом розуміється тривимірна частину простору, яка обмежена замкнутою поверхнею. Це може бути порожнина (пустота) або ж наповнення певної форми речовиною: твердим тілом, рідиною, газом або плазмою. Геометрично, об'єм можна представити у вигляді сукупності точок та спроектувати на поверхню, так він вироджується в поверхню, поверхня — в лінію, лінія — в точку. Об'єм контактує із іншими тілами поверхнею.
Поверхня у фізиці і хімії поверхні, перш за все, розглядається як міжфазне утворення, кордон між твердим тілом, рідиною та газом. Типовими міжфазними поверхнями є границя поділу між відмінними видами речовини, які перебувають у різних агрегатних станах, наприклад, міжфазні поверхні тверде тіло — газ SG, рідина — газ LG, тверде тіло — рідина SL. У рамках фізики і хімії поверхні досліджується поведінка атомів та молекул газу (повітря) GM, рідини LM та йонів І на кордоні твердого тіла S, рідини L та газового (повітряного) середовища G (AIR).[1][2]
Молекулярна природа міжфазної поверхні
Спорідненість неперервності та квантування відбивається також і на динаміці фізичних поверхневих явищ. Якщо два тіла привести в контакт, то їх стани будуть змінюватись, доки між ними встановиться термодинамічна рівновага. На межі тіла, на міжфазній поверхні його властивості проявляються найбільш явно. Тут атоми та молекули кожної фази оточені атомами та молекулами своєї та суміжної фаз і проявляють себе з двох сторін — зі сторони об'єму та зі сторони сусідньої речовини. У той час як молекули всередині об'єму тіла взаємодіють виключно з оточуючими молекулами, подібними собі, то молекули поверхні взаємодіють одночасно з молекулами об'єму і з молекулами сусідньої речовини. У двовимірному полі міжфазної поверхні молекула бачиться більш об'ємно та панорамно. Знаючи властивості атомів та молекул, що находяться на поверхні, у двох протилежних напрямах, в напрямку об'єму і назовні, можна з високою вірогідністю спрогнозувати їх поведінку. Поверхня відкриває нові відомості про речовину. «Хочу стояти як можна ближче до краю, ризикуючи впасти. Із краю бачиться те, чого не видно із середини». (I want to stand as close to the edge as I can without going over. Out on the edge you see all the kinds of things you can't see from the center (Kurt Vonnegut. Player Piano).
Квантові процеси, що мають місце в атомі, між атомами в молекулі та між молекулами мають різну природу і визначають агрегатний стан речовини. На межі фаз молекули кожної фази оточені молекулами своєї та суміжної фаз, тож, взаємодіють не тільки з молекулами своєї фази, але й з молекулами суміжної фази. В основі міжмолекулярних зв'язків лежать сили ван дер Ваальса[3]: диполь-дипольна взаємодія Кеезома, [4] індукційна взаємодія Дебая, [5] дисперсійна взаємодія Лондона [6] та водневий зв'язок. Фізико-хімічні моделі диполь-дипольної взаємодії Кеезома, індукційної взаємодії Дебая та дисперсійної взаємодії Лондона добре виписані й дозволяють математично визначити величину та напрямок діючих сил. Для пояснення величини та характеру дії вандерваальсових сил можна використати також потенціал Ленарда-Джонса[7][8][9][10][11][12][13][14][15][16] Хімічним зв'язкам ми завдячуємо виникненню молекул, хімічних сполук, кристалів тощо. Тверді тіла можуть утворюватися також за рахунок металічного зв'язку як результат формування макромолекул. Виникнення хімічного зв'язку супроводжується зменшенням повної енергії всіх складних утворень.
Сили молекулярної взаємодії найбільш суттєво проступають у поверхневих фізичних та хімічних явищах змочування, адгезії, когезії, капілярного ефекту, адсорбції та абсорбції, які спостерігаються на міжфазних поверхнях тверде тіло — рідина, тверде тіло — газ (повітря) та рідина — газ (повітря) і вивчаються в межах хімії поверхні та фізики поверхні. Дослідження різних явищ допомагає здолати невизначеності та встановити непомітні раніше зв'язки, бо все, що розглядається окремо, насправді тісно пов'язане між собою. Ці явища застосовні окремо або в поєднанні з іншими, наприклад, для побудови систем гідроенергетики міжфазної поверхні.
Ваговиті атрибути поверхні не применшують значення об'єму — знання поверхні дозволяє краще зрозуміти та контролювати об'єм. Міжфазна поверхня — найбільш антагоністична та агресивна частина об'єму. Міжфазна поверхня демонструє енергію, об'єм нею послуговується.
Термодинамічні потенціали Гіббза та поверхневий натяг
Термодинаміка — більш загальна наука, ніж просто наука про перебіг теплових процесів, як це може витікати з її назви. Скоріш, це наука про енергетичні перетворення. Методологія термодинаміки є універсальною й певною мірою поширюється чи не на всі відомі нам енергетичні процеси мікросвіту та макросвіту. Агрегатний стан робочого тіла як багатокомпонентної термодинамічної молекулярної системи будь то рідина, чи газ у світлі першого та другого законів термодинаміки можна охарактеризувати як традиційними термодинамічними параметрами, як-от тиск р [Па], густина ρ [кг/м3], об'єм V [м3], температура T [К], так і специфічними показниками — термодинамічними потенціалами, зокрема, внутрішньою енергією U [Дж], ентропією [Дж], ентальпією H [Дж] та вільною енергією Гіббза GS [Дж]. Внутрішня енергія є базовим термодинамічним потенціалом і фізично являє собою потенціальну енергію, що описує поле консервативних сил. Вільна енергія Ґіббза є функцією тиску р [Па] та температури Т [К], вона названа в честь американського фізика, хіміка та математика Джозайя Вілларда Гіббза, котрий вніс суттєвий вклад у вивчення поверхневих явищ. [17] Вказані характеристики поєднані у фундаментальному рівнянні термодинаміки, що характеризує зміну внутрішньої енергії молекулярної системи в залежності від зміни термодинамічних параметрів та враховує всі види робіт, які може виконувати молекулярна система, dU = TdS — p·dV + φ·dq + γ·dA + m·g·dh + H·dM + Σμi·dNi,
де T [К] — температура, р [Па] — тиск, S [Дж/К] — ентропія, dS [Дж/К] — нескінченно мала зміна ентропії, V — об'єм [м3], dV [м3] — нескінченно мала зміна об'єму, φ [В] — різниця потенціалів, dq [Кл] — нескінченно мала зміна заряду, m [кг] — маса речовини, g [м·с–2] — прискорення вільного паління, g = 9,81 м·с–2 біля поверхні Землі, h [м] — переміщення компонентів системи по висоті, γ [Н/м] — поверхневий натяг, dА [м2] — нескінченно мала зміна площі поверхні, H [A/м] — напруженість магнітного поля, dM [A/м] — нескінченно мала зміна намагніченості, μi [Дж/моль] — хімічний потенціал i-ї частинки, Ni — число частинок.
Хімічний потенціал μi [Дж/моль] демонструє спроможність системи виконати певну роботу. Чисельно він дорівнює енергії, яку слід задіяти для того, щоб система увійшла в стан термодинамічної рівноваги після включення в неї нового компонента. Хімічний потенціал є частковою похідною вільної енергії Гіббза GS [Дж],
μi = ∂GS/∂Ni.
Звичайною в природі є взаємодія різних тіл. Коли два компонента починають контактувати один з одним, виникає міжфазна поверхня, яка змінює хід термодинамічних процесів, що відбуваються в молекулярних системах цих складових тіл. Зміни термодинамічних параметрів можна представити у вигляді системи рівнянь, [17]
Ni = Niα + Niβ+ NiS;
UIN = Uα + Uβ+ US,
де Niα, Niβ — число компонентів в об'ємах фаз α та β, NiS — кількість частинок на міжфазній поверхні, UIN [Дж] — повна енергія системи, Uα [Дж] та Uβ [Дж] — внутрішня енергія компонентів в об'ємі фаз α та β компонентів. Об'ємом міжфазної поверхні VS [м3] можна знехтувати в порівнянні з об'ємом фаз Vα [м3] та Vβ [м3] (ідеальна поверхня не має об'єму) тобто VS = 0.
Із останнього рівняння визначається поверхнева енергія US [Дж], US = UIN — Uα — Uβ = UIN — uαVα — uβVβ,
де uα та uβ [Дж/м3] — внутрішня питома енергія компонентів на одиницю об'єму фаз α та β.
Відповідно, число молекул, які вміщаються на міжфазної поверхні Niσ, можна визначити із рівняння, яке пов'язує число компонентів, NiS = Ni — Niα — Niβ = Ni — сiα·Vα — сiβ·Vβ,
де сiα [моль/м3] та сiβ [моль/м3] — концентрація і-го компонента в об'ємі фаз α та β.
Із рівняння «компонентів» можна визначити так званий поверхневий надлишок ГiS [моль/м2], який дорівнює числу молекул, що припадають на одиницю площі поверхні А [м2], ГiS = NiS/А, де NiS — число молекул, які вміщаються на міжфазної поверхні.
Поверхневий надлишок ГS [моль/м2] встановлює співвідношення між адсорбційними та енергетичними характеристиками поверхневого шару для розчину через рівняння Гіббза, ГS = [с/(R·T)](–dγ/dс), де с [моль/м3] — об'ємна концентрація розчиненої речовини, R [Дж/(моль·К)] — газова стала, R = 8,31446 Дж/(моль·К), γ [Н/м] — поверхневий натяг або коефіцієнт поверхневого натягу, T [К] — температура.
Фізичний зміст поверхневого надлишку ГS [моль/м2] — надлишкова концентрація розчиненої речовини в поверхневому шарі розчину порівняно з його об'ємною концентрацією с [моль/м3]. Величина поверхневого надлишку ГS показує, яку кількість речовини потрібно додатково внести в систему для того, щоб при збільшенні поверхні розділу фаз на одиницю склад об'ємних фаз не змінився. Величина dγ/dс свідчить про поверхневу активність речовини. У разі, якщо dγ/dс < 0, тоді ГS > 0, розчинена речовина є поверхнево активною і накопичується у поверхневому шарі рідини. У разі, якщо dγ/dс > 0, тоді ГS < 0, розчинена речовина є поверхнево неактивною, її концентрація в поверхневому шарі рідини менша, ніж в об'ємі.
Згідно теорії Ленгмюра, утворення щільного мономолекулярного шару з молекул ПАР на поверхні розчину свідчить про досягнення стану граничної адсорбції. [18] [19]
Для чистої рідини початкове рівняння енергетичної рівноваги значно спрощується. Вільна енергія поверхні
GS = γ·A + Σμi·NiS.
Розділивши праву та ліву частини рівняння цього на площу поверхні А [м2], отримуємо
GS/А = γ + Σμi·NiS/А = γ + Σμi·ГSi,
де ГSi [моль/м2] — поверхневий надлишок.
Для одиниці поверхні ГS = 0, тож, рівняння (2.32) скорочується. У випадку чистої рідини вільна енергія Гіббза одиниці поверхні gS [Дж/м2] дорівнює поверхневому натягу рідини γ [Дж/м2], gS = GS/А = γ.
Робота Wmax [Дж] по утворенню нової поверхні, яку система виконує внаслідок перебігу ізотермічного оборотного процесу, чисельно дорівнює зменшенню енергії Гіббза (ізобарно-ізотермічного потенціалу) ΔGS [Дж] системи,
ΔWmax = –ΔGS [Дж].
Для одиниці поверхні
ΔWmax/A = –ΔGS/A = γ.
Тож, поверхневий натяг дорівнює надлишку енергії Гіббза, що припадає на одиницю площі поверхні. Поверхневий натяг можна також представити як приріст вільної енергії Гіббза у відповідь на зростання площі поверхні.
Величина поверхневого натягу залежить від температури. З її зростанням виникає теплове розширення рідини, знижується її густина, зменшуються сили зчеплення на поверхні та всередині рідини, тож, величина поверхневого натягу лінійно падає. Величину поверхневого натягу рідини можна змінити також внесенням розчинів. Якщо молекули розчиненої речовини більш споріднені з молекулами розчинника, ніж молекули розчинника між собою, розчинена речовина збільшує величину поверхневого натягу, наприклад, концентрація NaCI в 1 % збільшує поверхневий натяг води на 0,17 мН/м при 20 °C.
На межі води з власною парою при кімнатній температурі коефіцієнт поверхневого натягу γ = 72,8 мН/м. При підвищенні температури відмінності між водою та її насиченою парою згладжуються, і величина коефіцієнта поверхневого натягу лінійно убуває. При t = 100 °C коефіцієнт поверхневого натягу γ = 58,8 мН/м, а при наближенні температури до критичного значення Т = 374,15 °C коефіцієнт поверхневого натягу води дорівнює нулю.
Положення поверхні Гіббза вибираємо таким, що NS = 0. Тоді, згідно співвідношенню Максвелла, значення ентропії поверхні на одиницю площі sS [Дж·м–2·K–1] має вигляд
sS = ∂SS/∂А|T=const, NiS=const =
= –∂γ/∂T|A=const, NiS=const .
Ентропія поверхні на одиницю площі дорівнює відношенню зміни поверхневого натягу ∂γ [Дж·м–2] до зміни температури ∂T [K].
Повна поверхнева енергія системи
US = T·SS + γ·А.
Для чистої рідини питома внутрішня поверхнева енергія (енергія одиниці площі поверхні) uS [Дж/м2] може бути знайдена через питому ентропію sS [Дж/м2·К–1] та поверхневий натяг γ [Дж/м2], uS = US/А = T·sS + γ
або
uS = γ — T·∂γ/∂T|Р = const, V = const.
Вільна поверхнева енергія Гіббза деяких речовин [20] [21] [22]
| Речовина | Вільна поверхнева
енергія, мДж/м2 |
| Скло | 310 |
| Кремній Si | 1240 |
| Окис магнію MgO | 1200 |
| Поварена сіль NaCl | 300 |
| Фторид літію LiF | 340 |
| Мідь Cu | 1650 |
| Карбонат кальцію СаСО3 | 230 |
| Флуорид кальцію СаF2 | 450 |
Значення поверхневого натягу γ, питомої ентропії T·sS та
вільної поверхневої енергії uS деяких рідин [17]
| Рідина | Поверхневий
натяг γ, мН·м–1 |
T·sS,
мН·м–1 |
uS,
мН·м–1 |
| Ртуть | 485,48 | 61,1 | 549,6 |
| Вода | 71,99 | 46,9 | 121,1 |
| н-Гексан | 17,89 | 30,5 | 49,9 |
| н-Октан | 21,14 | 28,3 | 50,9 |
| Метанол | 22,07 | 23,0 | 46,3 |
| Етанол | 21,97 | 24,8 | 48,0 |
| 1-Пропанол | 23,32 | 23,1 | 47,6 |
| 1-Бутанол | 24,93 | 26,8 | 53,0 |
| Толуен | 27,93 | 35,4 | 65,1 |
Термодинамічні потенціали є кількісними і якісними показниками фундаментального термодинамічного рівняння і дозволяють не тільки всебічно характеризувати енергетичний стан системи з врахуванням молекулярної структури робочого тіла, але й визначають напрямок перебігу процесів. Теорія вільної енергії Гіббза дозволяє описати молекулярну природу поверхневих явищ, зокрема, фізичну суть та величину поверхневого натягу рідини. Для перенесення молекул з об'єму рідини у поверхневий шар необхідно виконати роботу W [Дж], яка йде на збільшення вільної поверхневої енергії Гіббза GS [Дж], W = GS = (ЕS — ЕV)·N, де ЕS [Дж] — вільна енергія молекули рідини на поверхні, ЕV [Дж] — вільна енергія молекули рідини в об'ємі, N — кількість молекул, які утворюють поверхневий шар. При постійних значеннях температури Т [К], тиску р [Па] та зовнішніх параметрів вільна енергія Гіббза GS [Дж] зменшується і в стані рівноваги досягає мінімального значення GSmin.
Робота ізотермічного утворення одиниці поверхні (площею 1 м2) визначає питому вільну поверхневу енергію і називається коефіцієнтом поверхневого натягу γ [Дж/м2] даної рідини на кордоні з другою фазою,
γ = W/A = (ЕS — ЕV)·N/A = (ЕS — ЕV)· N1,
де A [м2] — площа поверхневого шару рідини, N1 — кількість молекул в 1 м2 поверхневого шару, N1 = N/A.
В значеннях нескінченно малих величин коефіцієнт поверхневого натягу також визначається як відношення зміни вільної поверхневої енергії dЕS-V [Дж] до зміни площі поверхневого шару dА [м2],
γ = ΔЕS-V/ΔA = dЕS-V/dA.
де T [K] = const, P [Па] = const, and N [моль–1] = const.
З іншого боку, поверхневий натяг можна виразити як силу Fγ [Н], що діє на одиницю довжини L [м],
γ = W/ΔA = Fγ·Δх/(2L·Δх) = Fγ/(2·L).
де W [Дж] — робота, яка переходить у потенціальну енергію, W = Fγ·Δх [Дж], ΔA — зміна площі поверхні, на яку діє сила, ΔA = 2L·Δх [м2].
Одиниці вимірювання поверхневого натягу в системних і позасистемних одиницях зв'язані між собою відношенням: 1 ерг/см2 (дін/см) = 0,001 Дж/м2 (Н/м).
У різних частинах об'єму молекулярна система будь то тверде тіло, рідина, чи газ, завжди буде намагатися переходити в стан термодинамічної рівноваги та мінімізувати вільну енергію Гіббза. Так речовини кожна окремо можуть певною мірою вирівняти свій хімічний потенціал.
Поведінка рідини на кордоні фаз
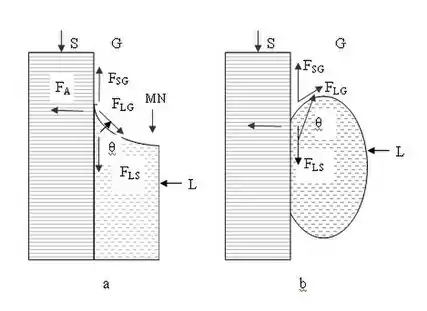
Молекули рідини L, газу G (повітря) та твердого тіла S взаємодіють між собою всередині об'єму та на кордоні дотику (FLS [Н] — сила взаємодії молекул рідини та твердого тіла; FLG [Н] — сили взаємодії молекул рідини та газу (повітря); FSG [Н] — сила взаємодії молекул твердого тіла та газу (повітря); FА [Н] — сила адгезії) й спричиняють поверхневі явища змочування, адгезії, когезії та капілярності. Поверхня рідини біля поверхні твердого тіла викривлена та утворює меніск MN та θ — крайовий кут змочування.
Один з методів розрахунку параметрів мультифазної системи полягає в складанні балансу сил, які діють на поверхні розділу трьох фаз, тобто в прирівнюванні векторної суми сил, які приводять до розтікання рідини, до сил зчеплення та в'язкості. По вертикалі складова сили FLG [Н] має урівноважити силу FLS [Н], FLS − FSG = − FLG·cos(θ), де θ — крайовий кут змочування між поверхнею твердого тіла S та меніском MN у точках їх перетину.
Так як сили FLS, FSG та FLG [Н] прямо пропорційні відповідним поверхневим натягам γLS, γSG та γLG, які у міжнародній системі SI вимірюються в Н/м або Дж/м2, отримуємо рівняння Томаса Юнга, [23]
γLS − γSG + γLG·cos(θ) = 0.
Міра змочування визначається величиною cos(θ), cos(θ) = (γSG — γLS)/γLG.
Цей вираз носить назву рівняння Юнга-Дюпре. З нього визначається робота адгезії WA [Дж] для одиниці площі поверхні, WA = γLS·[1 + cos(θ)], При γSG > γLS кут θ < π/2. У цьому випадку поверхня твердого тіла S є гідрофільною, рідина FL змочує тверде тіло та має увігнутий меніск MN.
Коли γSG < γLS, кут θ > π/2. Тоді поверхня твердого тіла S є гідрофобною, рідина не змочує тверде тіло та має опуклий меніск MN.
Природу гідрофільності та гідрофобності можна пояснити особливостями будови молекул твердого тіла та рідини. Тверді полярні речовини є гідрофільними. До гідрофобних речовин належать тверді тіла з насиченими ковалентними зв'язками та симетричною будовою молекул. У таких молекулах центри позитивних і негативних зарядів співпадають. Звичайно такі речовини є хімічно пасивними.
Процес змочування твердого тіла можна розглядати як процес мінімізації вільної поверхневої енергії Гіббза GS [Дж]. При великому запасі вільної енергії Гіббза на поверхні твердого тіла сили притягання між молекулами рідини та твердого тіла більші, ніж між молекулами самої рідини, й рідина прагне збільшити поверхню контакту з твердим тілом, тож, поверхня твердого тіла добре змочується рідиною. Крапля на гідрофільній поверхні розтікається та створює на поверхні плівку. Плівка ж рідини на гідрофобній поверхні, навпаки, рветься та скраплюється.
Викривлення поверхневого шару рідини викликає появу додаткового тиску на неї, величина тиску залежить від значень коефіцієнта поверхневого натягу γ та кривини поверхні Н = 1/R, де R [м] — радіус кривини поверхні.
П'єр Сімон Лаплас узгодив тиск pМ [Н·м–2] під викривленою поверхнею (меніском) рідини та форму викривленої поверхні, [24]
pМ = p0 + pR = p0 + γ·(1/Rх + 1/Rу), де p0 [Пa] — тиск під плоскою поверхнею рідини, pR [Пa] — додатковий тиск, залежний від кривини поверхні рідини, Rх [м] та Rу [м] — головні радіуси кривини по осям х та у.
Для сферичної поверхні Rх = Rу = R [м], тож, справедлива формула Юнга-Лапласа, pR = γ·(1/Rх + 1/Rу) = 2·γ·Н.
Для випуклого меніска pR > 0, відповідно для увігнутого меніска pR < 0. У разі, якщо меніск має форму циліндричної поверхні радіусом R [м], формула Юнга-Лапласа приймає вигляд: pR = γ/R.
Згідно рівнянню Юнга-Лапласа, чим менший радіус краплі, тим більший тиск, який стягує поверхню краплі всередину її об'єму. Сили, які утримують частинку разом, з уменшенням розміру зростають, особливо, на мікро- та нанорівнях.
Вочевидь, міжфазна поверхня володіє величезними енергетичними можливостями. І схоже, локалізується ця енергія щонайкраще в пористих структурах.
Термодинамічні потенціали Гіббза в однорідних капілярах
Зважаючи на те, що тенденція розвитку технічних систем лежить в плоскості їх мініатюризації, в різних галузях зростає інтерес до використання капілярних систем, які володіють унікальними властивостями керувати рідиною, дякуючи великим значенням енергії молекул на кордонах фаз. При мікронних поперечних розмірах капілярів спостерігається зростання впливу сил поверхневого натягу і в'язкості на поведінку рідини в порівнянні із силами гравітації, збільшення гідравлічного опору та розсіювання енергії, сильно знижується також значення числа Рейнольдса. [25][26][27][28] У нанорозмірних капілярах характерна довжина Дебая є співставною з поперечним розміром капіляра. Властивості нанорозмірних капілярів дозволяють створювати гідродинамічні елементи з функціями випрямлення йонного електричного струму, тунелювання субатомної частинки через потенціальний бар'єр і підсилення електричного струму — по функціям гідродинамічні елементи багато в чому схожі з електронними напівпровідниковими елементами.
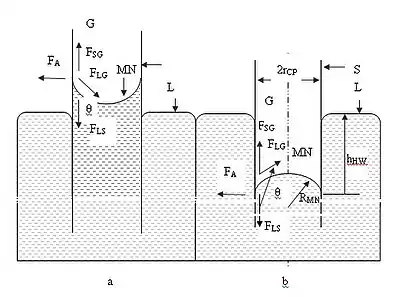
Поведінка рідини в однорідних капілярах зі змочуваною та незмочуваною поверхнями відрізняється величиною та напрямом міжмолекулярних сил (FLS [Н] — сила взаємодії молекул рідини та твердого тіла; FLG [Н] — сила взаємодії молекул рідини та газу (повітря); FSG [Н] — сила взаємодії молекул твердого тіла та газу (повітря); FА [Н] — сила адгезії), які обумовлюють відносний рух рідини L та поверхні капіляра (тверде тіло S). висота підняття або глибина опуску рідини - hHW [м]. Спостерігається капілярний ефект — поверхневе явище, яке характеризує здатність рідини рухатися капілярами внаслідок міжмолекулярних сил взаємодії рідини з молекулами твердого тіла. В основі цієї взаємодії лежать сили ван дер Ваальса. У випадку, якщо рідина змочує однорідну поверхню стінки капіляра, поверхнева енергія рідини в трубці мінімізується, і між рідиною та стінкою капіляра формується меніск MN з відповідним кутом змочування θ. Чим менше радіус капіляра rCP, тим більше різниця тисків на кордоні фаз повітря — рідина. Під увігнутою поверхнею рідини виникає надмірний від'ємний тиск, у результаті, рідина в капілярі піднімається, бо під плоскою поверхнею рідини в широкому резервуарі надмірного тиску немає. Якщо ж рідина не змочує стінки однорідного капіляра, то позитивний тиск приведе до опускання рідини в капілярі. Рідина в капілярі піднімається або опускається на таку висоту hHW [м], при якій тиск стовпа рідини (гідростатичний тиск) ρ·g·hHW врівноважується надмірним тиском.
Рідину вверх піднімає сила капілярності Fγ [Н], Fγ = γ·cos(θ)·2·π·rCP,
де γ [Н/м] — коефіцієнт поверхневого натягу рідини, характеризує поверхневу енергію рідини на кордоні з газом, θ — кут змочування рідиною поверхні твердого тіла, характеризує адгезію молекул рідини та поверхні твердого тіла.
Сила виконує роботу W [Дж], W = Fγ·hHW/2 = γ·cos(θ)·2·π·rCP·hHW/2.
Частина роботи витрачається на збільшення потенціальної енергії рідини ЕР [Дж], ЕР = mFL·g·hHW/2 = ρFL·VFL·g·hHW/2 = ρFL·π·rCP2·hHW·g·hHW/2.
Із умови збереження енергії витікає
ЕР = W [Дж].
Підставляючи значення роботи W [Дж] та потенціальної енергії ЕР [Дж] в останнє рівняння (2.54), можна знайти висоту hHW [м] підняття рідини в циліндричному вертикальному капілярі радіусом rCP [м] (формула Джеймса Джюріна) у разі змочуваної поверхні, [29] hHW = 2·γ·cos(θ)/(ρFL·rCP·g).
де ρFL [кг/м3] — густина рідини, g [м/с2] — величина прискорення вільного падіння, біля поверхні Землі g = 9,81 м·с–2.
Якщо капіляр має форму щілини з постійною шириною δCP [м], то меніск має складну форму, і висота підйому змочуючої рідини hHW [м] в капілярі вираховується за допомогою формули
hHW = 2·γ·cos(θ)/(δCP·ρFL·g).
Поведінку рідини в зануреному капілярі зручно розглядати за допомогою моделі термодинамічних потенціалів Ґіббза.
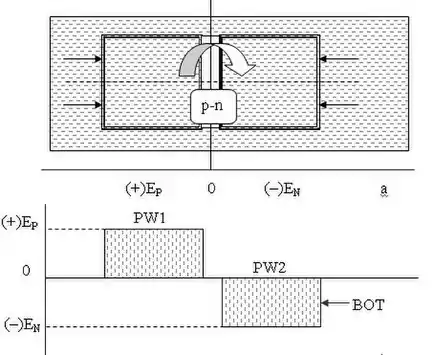
Рідина в капілярі рухається із області з меншим значенням від'ємного потенціалу, в область із більшим значенням від'ємного потенціалу. Занурення капіляра зі змочуваною (гідрофільною) поверхнею в рідину призводить до утворення в ньому потенціальної термодинамічної ями PW — області підвищеного капілярного тиску, яка характеризується малим значенням крайового кута змочування (θ < π/2) та високою адгезією молекул рідини до поверхні твердого тіла. і, відповідно, високою вільною енергією (потенціалом) Гіббза GS [Дж]. За визначенням, термодинамічна потенціальна яма — область капілярного простору, в якій потенціальна енергія рідини менша, ніж зовні. Потенціальна яма характеризується шириною й глибиною. Точка з найнижчим значенням потенціальної енергії називається дном потенціальної ями BOT.
Енергія дна термодинамічної потенціальної ями (+)ЕP [Дж] чисельно дорівнює роботі, яку мають виконати молекули рідини та твердого тіла для того, щоб підняти рідину на певну висоту за рахунок сил адгезії та поверхневого натягу. Нагадаємо, що поверхнева енергія рідини на кордоні з газом характеризується коефіцієнтом поверхневого натягу, а адгезія молекул рідини до поверхні твердого тіла характеризується кутом змочування рідиною поверхні твердого тіла θ. Молекулярні сили, які задіяні в формуванні термодинамічного p-потенціалу, мають кулонівську природу й підпорядковуються статистичним квантовим законам. Рідина використовує поверхневу енергію Гіббза, сходить на певну висоту під дією сил адгезії та поверхневого натягу, таким чином зменшуючи вільну енергію Гіббза міжфазної поверхні. Рушійні можливості міжфазної поверхні зростають пропорційно силам ван дер Ваальса [30] [31]
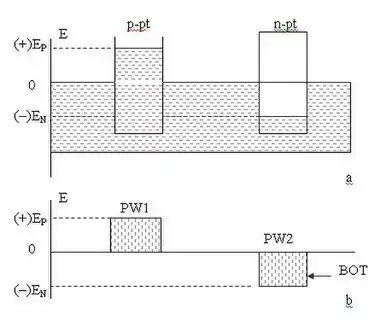
Занурення капіляра з незмочуваною (гідрофобною) поверхнею в рідину також приводить до утворення потенціальної термодинамічної ями PW, проте, вона є областю пониженого капілярного тиску й характеризується великим значенням крайового кута змочування (θ > π/2), низькою адгезією молекул рідини до поверхні твердого тіла та, відповідно, низькою вільною енергією (потенціалом) Гіббза GS [Дж]. Енергія сформованої термодинамічної потенціальної ями (–)ЕP [Дж] чисельно дорівнює роботі, яку мають виконати молекули рідини та твердого тіла для того, щоб опустити рідину в капілярі за рахунок сил когезії та поверхневого натягу на певну глибину.
Потенціали Гіббза є кількісними та якісними показниками фундаментального термодинамічного рівняння, їх природа кулонівська, й підпорядковуються вони статистичним квантовим законам. Термодинамічні потенціали не тільки всебічно розкривають енергетичний стан системи з врахуванням молекулярної структури робочого тіла, але й визначають напрямок перебігу процесів.
Термодинамічні p-n переходи Гіббза в парних капілярах
Надзвичайно важливими напрямками досліджень є термодинамічні p-n переходи, зокрема, ті, які виникають при русі рідини парним капіляром з гідрофільною та гідрофобною поверхнями стінок на різних кінцях. Утім, розгляд тези доцільно почати з аналізу більш простого випадку — руху рідини горизонтальним капіляром із однорідною гідрофільною поверхнею.
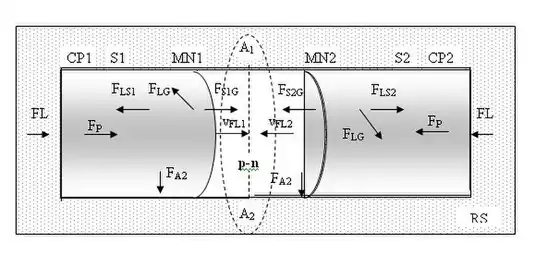
Уявімо, що парний капіляр складається з двох однакових за розмірами (довжиною та радіусом rCP [м]) циліндричних частин CP1 та CP2, втім, поверхня S1 однієї частини є гідрофобною по відношенню до рідини FL, а поверхня S2 другої частини є гідрофільною по відношенню до цієї рідини; цей капіляр занурений горизонтально в резервуар RS з рідиною FL. Рух рідини парним капіляром CP1-СР2 визначається силами гравітаційного тиску рідини FP [Н], вільним гравітаційним характером поширення, силами взаємодії молекул рідини та поверхні капіляра FLS1 [Н] і FLS2 [Н], силами взаємодії молекул газу та поверхні капіляра FS1G [Н] і FS2G [Н], силами взаємодії молекул рідини та газу FLG [Н] а також силами адгезії молекул рідини та поверхні капіляра FA1 [Н] і FA2 [Н]. У той час, коли потік рідини в гідрофільній частині капіляра CP2 має тенденцію до поширення, оскільки на додаток до сили гравітаційного тиску FP [Н], у тому ж напрямі діють сили адгезії та поверхневого натягу, то потік рідини в гідрофобній частині гальмується силами поверхневого натягу рідини.
Межа між гідрофобною та гідрофільною частинами капіляра, яка відмічена лінією A1-A2, характеризується конкуренцією фронтів нерівноважних потоків, різними силами зчеплення молекул рідини поверхневого шару новосформованих менісків, різними параметрами адсорбції та абсорбції однієї й тієї ж рідини (краплями) з протилежного потоку а також різними параметрами відновлення енергетичного стану менісків та стовпів рідини на протилежних краях капіляра.
Градієнти молекулярних сил поверхневого натягу, адгезії, когезії, адсорбції та абсорбції, які виникають у парних капілярах, дають підставу говорити про виникнення термодинамічного p-n переходу Гіббза та термодинамічних потенціальних ям PW1, PW2, де BOT — дно термодинамічної ями; (+)ЕP [Дж], (–)ЕN [Дж] — магнітуди вільної енергії Гіббза позитивної та негативної секцій термодинамічного р-n переходу.
Гідрофільна поверхня твердого тіла S2 є областю з термодинамічним р-потенціалом Гіббза, вона характеризується підвищеним капілярним тиском. Гідрофобна поверхня твердого тіла S1 є областю з термодинамічним n-потенціалом Гіббза, вона характеризується низьким капілярним тиском. Зазначені області капілярного простору можна розглядати як термодинамічні потенціальні ями, що володіють позитивним або негативним значеннями потенціальної енергії, яка необхідна для заповнення ям рідиною або ж видалення з них цієї рідини.
Дещо відмінним від розглянутого є рух рідини вертикальним парним капіляром із гідрофільною та гідрофобною поверхнями на протилежних краях, які утворюють у вертикальному парному капілярі термодинамічний p-n перехід.

Парний капіляр вертикально занурено в резервуар RS з рідиною FL так, що гідрофільна частина CP1 знаходиться вверху, а гідрофобна секція CP2, відповідно, знаходиться внизу. Швидкості руху рідини різними секціями парного капіляра vFL1 [м/с], vFL2 [м/с] визначаються силами гравітаційного тиску рідини на різній глибині FP1 [Н], FP2 [Н], силами взаємодії молекул рідини та поверхні капіляра FLS1 [Н], FLS2 [Н], силами взаємодії молекул газу та поверхні капіляра FS1G [Н], FS2G [Н], силами взаємодії молекул рідини та газу FLG [Н] а також силами адгезії молекул рідини та поверхні капіляра FA1 [Н], FA2 [Н]. Потік рідини у гідрофільній частині капіляра CP1 має тенденцію до поширення, бо на додаток до сили гравітаційного тиску FP1 [Н] у тому ж напрямі діють сили адгезії та поверхневого натягу. Потік рідини у секції CP2 з гідрофобною поверхнею S2 гальмується силами поверхневого натягу рідини. Градієнти молекулярних сил поверхневого натягу, адгезії, когезії, адсорбції та абсорбції створюють на кордоні гідрофобної та гідрофільної секцій капіляра термодинамічний p-n перехід, який характеризується конкуренцією фронтів нерівноважних потоків.
Для секції капіляра СР1 з гідрофільною поверхнею S1 умова рівноваги сил записується так
FLS1 − FS1G − (FP1− P1) = − FLG·cos(θ1).
де FP1 [Н] — сила гравітаційного тиску рідини або вага стовпа рідини на рівні верхнього краю капіляра, P1 [Н] − вага стовпа рідини у капілярі зі змочуваною поверхнею, θ1 [рад] — крайовий кут змочування між поверхнею твердого тіла S1 та меніском MN1 на поверхні рідини у точках їх перетину.
Величина cos(θ1) визначає міру змочування поверхні і може бути знайдена із рівняння Томаса Юнга, cos(θ1) = (γS1G — γLS1)/γLG.
Для гідрофільної поверхні S1 капіляра СР1 рідина FL змочує тверде тіло та формує увігнутий меніск MN1. У цьому випадку мають місце такі співвідношення термодинамічних параметрів:
γS1G > γLS1 і θ1 < π/2.
Сили адгезії та поверхневого натягу витрачаються на збільшення висоти стовпа рідини у змочуваній частині капіляра. Переміщення рідини змочуваною частиною капіляра продовжуватиметься, доки фронт рідини досягне незмочуваної поверхні. З цього моменту рух рідини сповільнюється та, у разі, якщо сумарна сила FΣ1[Н], яка рухає стовп рідини, урівноважиться зустрічною силою поверхневого натягу в незмочуваній частині капіляра FSТ2 [Н], її потік повністю зупиниться, FΣ1 = − FSТ2 [Н].
Для секції капіляра СР2 з гідрофобною поверхнею S2 умова рівноваги сил записується так
FLS2 − FS2G − FP2 = − FLG·cos(θ2).
де FP12 [Н] — сила гравітаційного тиску рідини (вага стовпа рідини) на рівні нижнього краю капіляра, θ2 [рад] — крайовий кут змочування між поверхнею твердого тіла S2 та меніском MN2 на поверхні рідини в точках їх перетину.
Величина cos(θ2) визначає міру змочування (незмочування) поверхні S2 і може бути знайдена із рівняння Томаса Юнга, cos(θ2) = (γS2G — γLS2)/γLG.
Для гідрофобної поверхні S2 капіляра СР2 рідина не змочує тверде тіло та має опуклий меніск MN2. Цей стан описується нерівностями
γS2G < γLS2 і θ2 > π/2.
Термодинамічна система, що виникла в нижній незмочуваній частині парного капіляра, на відміну від термодинамічної системи, яка сформувалася в змочуваній частині капіляра, є сталим енергетичним утворенням. Накопичена у верхній частині капіляра рідина має високу потенціальну енергію, тож, може здолати потенціальний бар'єр термодинамічного p-n переходу Гіббза й бути поглинутою меніском MN2 рідини в нижній частині парного капіляра. Параметри термодинамічного p-n переходу в горизонтальних та вертикальних парних капілярах описуються системою рівнянь.
Градієнт термодинамічних потенціалів p-n переходу Гіббза дозволяє влаштовувати дозоване однонаправлене перетікання рідини між менісками парного капіляра. Поєднання рушійної сили багатьох парних капілярів дає можливість створювати великі потоки рідини, властивість вельми корисна для побудови систем молекулярної гідроенергетики — молекулярних гідроелектростанцій.
Див. також
Джерела
- Сидоров, В. І. Молекулярна енергетика. Теорія та технічні рішення. — Черкаси: Вертикаль, видавець Кандич С. Г., 2020. — 486 с. ISBN 978-617-7475-79-7
- Сидоров, В. І. Від макроскопічних до молекулярних технологій відновлюваної енергії // Промислова електроенергетика та електротехніка. — 2018. — № 3. — С. 34—42.
- Van der Waals, J. D. Over de Continuiteit van den Gas- en Vloeistoftoestand (on the continuity of the gas and liquid state). PhD thesis. — Leiden, The Netherlands, 1873.
Примітки
- Сидоров, В. І. (2020). Молекулярна енергетика. Теорія та технічні рішення (Укр.). Черкаси: Вертикаль, видавець Кандич С.Г. с. 486 с. ISBN ISBN 978-617-7475-79-7.
- Сидоров В.І. (2018). Від макроскопічних до молекулярних технологій відновлюваної енергії. Промислова електроенергетика та електротехніка. – № 3. – С. 34-42 (Укр.).
- Van der Waals, J. D. (1873). Over de Continuiteit van den Gas- en Vloeistoftoestand (on the continuity of the gas and liquid state). PhD thesis (Нім.). Leiden, The Netherlands.