Зубчаста звивина
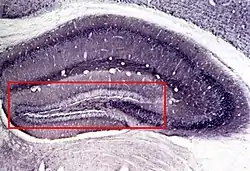
Зубчаста звивина, або лат. fascia dentata hippocampi, або зубчаста фасція гіпокампу — звивина, розташована в глибині борозни гіпокампу (Рис. 1). Морфологічно зубчаста звивина є відносно просто організованою частиною мозку, де повторюваний патерн побудови клітинного шару сполучається з високовпорядкованою структурою шарів нервових волокон, які проводять вхідні та вихідні сигнали і легко локалізуються на тканинних перерізах[1]. Це робить зубчасту звивину зокрема, і гіпокамп в цілому, популярною модельною системою в сучасній нейробіології для дослідження особливостей проведення, інтегрування та модуляції нервових сигналів.
Морфологія

Зубчаста звивина (ЗЗ) як окремо виражена структура в ході еволюції хребетних уперше з'являється в ссавців; в гіпокампі птахів та рептилій прямий морфологічний гомолог ЗЗ відсутній[3]. Питання щодо існування функціонального гомолога є спірним станом на 2010-ті роки: базуючись на результатах генетичних та нейроанатомічних досліджень, частина нейрологів підтримує гіпотезу щодо функціональної гомології між ЗЗ ссавців, медіальною корою рептилій та вентральною частиною вентрального гіпокампа птахів[4][5][6], але дані інших дослідницьких груп[7][8] суперечать цій гіпотезі[3].
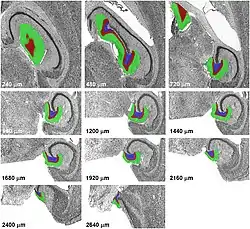
Морфологічно ЗЗ складається з трьох шарів: молекулярного, клітинного та поліморфного, або хілусу (див. Рис. 2 та 3)[9].
Клітинний, або гранулярний шар розташований між молекулярним та поліморфним шаром[10].
Молекулярний шар є структурою приблизно 250 мкм завтовшки (в мозку щура), утворений в основному дендритами гранулярних клітин клітинного шару, пірамідних кошикових нейронів та інших клітин поліморфного шару (див. докладніший опис нижче); шар містить відносно невелику кількість інтернейронів. Також до складу молекулярного шару входять волокна перфорантного сигнального шляху, що проводить до ЗЗ сигнали з енторинальної кори[11].
Клітинний шар ЗЗ складається в основному зі щільно упакованих гранулярних клітин, що складають понад 95% його об'єму. Товщина клітинного шару коливається від 4 до 8 клітин або приблизно 60 мкм. Окрім гранулярних клітин у цьому шарі трапляються й клітини інших типів, такі як пірамідні кошикові нейрони[1], які можна знайти переважно на межі клітинного шару та хілусу. Гранулярний шар одержує нервові сигнали винятково від енторинальної кори[12] через перфорантний сигнальний шлях, що поділяється на латеральну та медіальну секції, які беруть початок, відповідно, у латеральній та медіальних долях енторинальної кори. Медіальний перфорантний шлях утворює синапси на проксимальній частині дендритів гранулярних клітин, а латеральний — на дистальній частині[13]. Аксони гранулярних клітин називаються «мохоподібними волокнами[14]; вони прямують до зон CA1 та CA3 гіпокампу, де утворюють збуджувальні глутаматергічні синапси на дендритах пірамідних нейронів[15].
Поліморфний шар ЗЗ складається з нейронів великої кількості різних типів, зокрема мохових клітин, ГАМК-ергічних інтернейронів, а також мохових волокон гранулярних клітин, що проходять через цю зону на шляху до своєї основної цілі — зон CA1 та CA3 гіпокампу, попутно утворюючи синапси з дендритами клітин поліморфного шару[16].
На межі хілусу та гранулярного шару знаходиться так звана «субгранулярна зона», що є одним з нечисленних місць у мозку ссавців, де нові нейрони утворюються вже після народження і навіть протягом дорослого життя (Рис. 4)[10]; при цьому було показано, що ознакою диференціації («дорослішання») клітини та, відповідно, перетворення її зі стовбурової клітини на гранулярний нейрон є початок синтезу в ній АМРА-рецепторів[17].
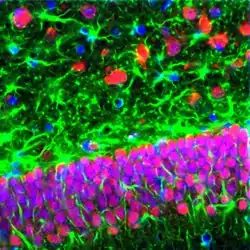
Окрім нейронів велику долю об'єму молекулярного та поліморфного шарів (і значно меншу — в гранулярному шарі) займають клітини астроглії (див. Рис. 5).
Загальний об'єм ЗЗ може коливатись у досить широких межах і у дорослої людини становить кілька сотень кубічних міліметрів (див. Таблицю 1).
Типи клітин та міжклітинна сигналізація
Гранулярні клітини
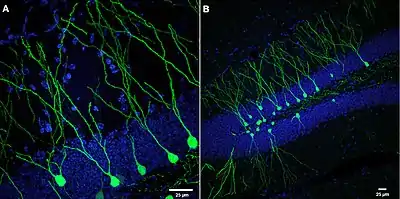
Гранулярні клітини зубчастої звивини (ГКЗЗ; слід відрізняти від гранулярних клітин мозочка) є найчисленнішим типом клітин у ЗЗ[18]. Їх тіло округлої або еліптичної форми, шириною приблизно 10 мкм та довжиною приблизно 18 мкм[19]. Для цього типу клітин характерне конусоподібне дендритне дерево середнього ступеня розгалуження; гілки дендритів проходять крізь молекулярний шар, доходячи до вентрикулярної поверхні гіпокампу (див. Рис. 6). Загальна довжина дендритів ГКЗЗ, розташованих у супрапірамідальній частині гранулярного шару (на Рис. 6В вгорі), є в середньому більшою, ніж дендритів інфрапірамідальної частини (на Рис. 6В внизу): 3500 та 2800 мкм відповідно[20]. Дендрити супрапірамідальної частини утворюють у середньому 1,6 синапса на 1 мкм довжини, а дендрити інфрапірамідальної частини — близько 1,3 синапса на 1 мкм[20]. Практично всі збуджувальні сигнали з усіх можливих джерел надходять до ГКЗЗ через ці синапси.
Загальна кількість ГКЗЗ у гіпокампі щура приблизно дорівнює 1,2×106[21]. Попри те, що утворення нових нервових клітин (нейрогенез) у гранулярному шарі відбувається протягом майже всього життя[18], загальна чисельність ГКЗЗ у дорослих лишається незмінною. Це доводить, що нейрогенез здійснює заміну клітин, що гинуть, але не змінює їхню загальну кількість[21].
Мохоподібні волокна
ГКЗЗ спрямовують вихідні збуджувальні сигнали через немієлінізовані аксони характерної будови, що мають діаметр 0,2-0,5 мкм — так звані «мохоподібні волокна». Мохоподібні волокна несуть незвичайно великі (у порівнянні зі звичайними аксонами) синаптичні бутони, які, своєю чергою, утворюють так звані «мимобіжні», або «en passant» синапси з моховими клітинами поліморфного шару та дендритами зони CA3 гіпокампу. Кожне первинне мохоподібне волокно розгалужується в середньому на 6-7 гілок, які називаються колатералями. Загалом, сумарна довжина загального дерева колатералей, утворених одним мохоподібним волокном всередині поліморфного шару, досягає приблизно 2300 мкм[16]. Колатералі мохоподібних волокон всередині поліморфного шару утворюють синапси з проксимальними дендритами мохових клітин[22]. Згідно з пізнішими дослідженнями більшість колатералей мохоподібних волокон у поліморфному шарі утворює синапси з ГАМК-ергічними інтернейронами[23]. Колатералі мохоподібних волокон іноді трапляються в гранулярному шарі, але ніколи за нормальних умов не доходять до молекулярного шару. Колатералі, що входять у гранулярний шар, в абсолютній більшості утворюють синапси з апікальними дендритами пірамідальних кошикових нейронів. Присутність колатералей мохоподібних волокон у молекулярному шарі ЗЗ є однією з найхарактерніших гістоморфологічних ознак скроневої епілепсії[24][25][26].
За межами хілусу мохоподібні волокна утворюють синапси з дендритами пірамідних нейронів зони CA3 гіпокампу; у проксимальній частині зони CA3 колатералі мохоподібних волокон можуть доходити до тіл пірамідних нейронів і утворювати на них синапси. Шар мохоподібних волокон, який лежить у гіпокампі навпроти зони CA3, називається {{нп|stratum lucidum|Stratum lucidum of hippocampus}}. Проєкція мохоподібних волокон до зони навпроти пірамідних нейронів гіпокампу закінчується на межі зон CA3 та CA2; отже, однією з основних відмінностей пірамідних нейронів CA2 від таких у CA3 є відсутність вхідних сигналів від ГКЗЗ[16]. Головним нейромедіатором у синапсах мохоподібних волокон є глутамат, отже, вони передають збуджувальні сигнали. Окрім глутамату, імуногістохімічні дослідження виявили наявність у мохоподібних волокнах ліганду опіоїдного рецептора OPRK1 динорфіна, а також гальмівного нейромедіатора ГАМК[27].
Пірамідні кошикові клітини
Пірамідні кошикові нейрони є найбільш дослідженим типом гальмівних інтернейронів у ЗЗ[22]. Ці клітини в основному розташовані вздовж межі між гранулярним шаром та хілусом. Для них характерна пірамідальна сома розміром 25-35 мкм, єдиний апікальний дендрит, спрямований у молекулярний шар, де він поділяється на кілька гілок та кілька менших за розміром базальних дендритів, спрямованих у поліморфний шар[28]. Назву «кошиковий» цей тип нейронів отримав за будову аксону, який утворює дуже сильно розгалужену мережу гілок, що обертаються навколо численних гранулярних клітин, утворюючи ГАМК-ергічні синапси на їхніх сомах та апікальних дендритах. Завдяки надзвичайно сильному розгалуженню аксона, один пірамідний кошиковий нейрон може утворювати синапси з великою кількістю гранулярних клітин: аж до 10 тисяч, або 1% всіх клітин гранулярного шару[29][30].
Мохові клітини
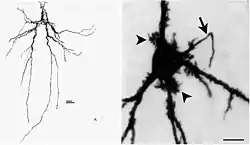
Мохові клітини (Рис. 7) є найбільш численними нейронами поліморфного шару ЗЗ. Для них характерна сома діаметром 25-35 мкм, приблизно трикутної або мультиполярної форми. Характерною рисою мохових клітин, за яку ці клітини отримали свою назву, є наявність дуже великих виступів («наростів») складної будови на апікальних дендритах. Кілька дендритів (3 і більше) з нечисленними відгалуженнями відходять на велику відстань у поліморфний шар, де утворюють збуджувальні глутаматергічні синапси з гальмівними інтернейронами, та в гранулярний шар, де утворюють синапси з ГКЗЗ. Залежно від того, чи утворює конкретна мохова клітина більше синапсів на гальмівних інтернейронах, що своєю чергою іннервують ГКЗЗ, чи безпосередньо на ГКЗЗ, вплив мохової клітини на ГКЗЗ може бути збуджувальним або гальмівним. Було показано, що пригнічення функціонування мохових клітин і їхня масова індукована загибель ведуть до аномально високого збудження в гранулярному шарі ЗЗ; отже, загальний ефект мохових клітин є гальмівним[31]. Гістологічні дослідження довели, що більшість вхідних синаптичних сигналів мохові клітини отримують від ГКЗЗ[32]. Функціонально, мохові клітини забезпечують розділення різних патернів вхідних збуджувальних сигналів до ЗЗ, таким чином регулюючи збудження ГКЗЗ та модуляцію вихідних сигналів, що передаються до зони CA3 гіпокампу[33].
Інші типи інтернейронів
Кошикові інтернейрони хілуса, особливо в його субгранулярній частині, можуть бути розподілені на кілька типів на основі їхніх морфологічних (форма соми, ядра, дендритного дерева) та біохімічних (більш або менш активна експресія протеїнів та нейроактивних речовин) ознак. Більшість із них демонструє активну імунореактивність на ГАМК; проте, у різних інтернейронів у цій області, окрім ГАМК, виявляється імунореактивність і на інші, різні набори нейромедіаторів. Таким чином, інтернейрони ЗЗ можуть бути поділені на різні групи, причому не всі такі групи відтворюватимуть будову та функції типових кошикових клітин[34]. Окрім мохових клітин, у хілусі наявна помітна кількість так званих веретеноподібних нейронів. Їхній розподіл за типами в основному базується на наявності мембранних шипиків (або виростів) та їхній формі. Методами внутрішньоклітинного забарвлення було показано, що аксони цих клітин доходять до молекулярного шару, і утворюють синапси на дендритах ГКЗЗ[11]. Досліди з антитілами проти пептиду соматостатину показали, що інтернейрони поліморфного шару імунореактивні на даний пептид, і складають приблизно 16% від усіх ГАМК-ергічних клітин у ЗЗ[35].
У молекулярному шарі знайдені як мінімум два типи нейронів. Перший локалізований у глибині шару, має мультиполярну або трикутну сому, розгалужений аксон та дендрити без мембранних шипиків[11]. Другий тип інтернейронів молекулярного шару відтворює функціональну морфологію аксо-аксональних клітин неокортексу: розгалужений аксон цих інтернейронів утворює синапси з ГКЗЗ виключно на їхніх аксонних горбиках. Інтернейрони даного типу перебувають у безпосередній близькості до верхньої межі гранулярного шару, а, часом, навіть серед розташованих на межі гранулярного шару ГКЗЗ[36]. Кожний аксо-аксональний інтернейрон здатний утворювати синапси на аксонних горбиках до 1000 ГКЗЗ. З огляду на те, що ці інтернейрони демонструють імунореактивність до ГАМК, вони, скоріше за все, являють собою додаткове джерело гальмівної сигналізації для клітин гранулярного шару.
Зовнішні сигнальні шляхи
Сигнальний шлях від енторинальної кори

ЗЗ отримує значний об'єм вхідних сигналів від енторинальної кори через сукупність нервових волокон, яка називається «перфорантний шлях» (Рис. 8). Сигнальна проєкція в ЗЗ здійснюється в основному клітинами локалізованими в шарі II енторинальної кори, хоча невелика кількість сигналів надходить також і від нейронів з шарів V та VI[38]. Енторинальні термінали локалізовані виключно в зовнішніх двох третинах молекулярного шару, де вони формують асиметричні синапси з дендритами ГКЗЗ та, у невеликій кількості, з дендритами розташованих тут інтернейронів[39]. Перфорантний шлях (ПШ) може бути поділений на дві частини на основі регіону походження, топографії кінцевого синаптичного дерева, а також гістохімічних та імуногістохімічних характеристик. Дві частини ПШ у мозку щура називаються латеральним та медіальним ПШ з огляду на те, що вони беруть початок з латеральної та медіальної частин еторинальної кори. Клітини, що дають початок цим двом частинам ПШ, помітно відрізняються за морфологічними та гістохімічними ознаками[40]. Волокна ПШ, що походять з латеральної частини енторинальної кори, інервують найбільш поверхневу третину молекулярного шару, тоді як волокна що походять з медіальної частини кори інервують середню частину молекулярного шару. Відносно тонкі аксони ПШ (~0.1 мкм) у молекулярному шарі демонструють періодично розташовані варикозні розширення товщиною 0.5-1 мкм[40].
Незважаючи на те, що ПШ часто вважається єдиним сигнальним шляхом, що поєднує енторинальну кору та гіпокамп, було показано, що невеликі об'єми вхідних сигналів також надходять з пресубікулуму та парасубікулуму. Ці волокна входять до молекулярного шару ЗЗ і розгалужуються в зоні, що покриває латеральну і медіальну частини ПШ[41].
Сигнальний шлях від септальних ядер
ЗЗ отримує відносно невелику кількість нервових сигналів від підкіркових структур мозку. Найбільш значний об'єм підкіркових сигналів надходить від септальних ядер (частина нюхового аналізатора). Септальна сигнальна проєкція походить від клітин медіального септального ядра та ядра діагональної стрічки Брока (bandaletta diagonalis (Broca)[42]. Септальні волокна надають доволі щільну інервацію клітинам поліморфного шару, особливо у вузькій зоні, що примикає до гранулярного шару.
Більша частина волокон септальних проєкцій до ЗЗ є холінергічними; це виглядає доволі логічним, оскільки 30-50% клітин у медіальному септальному ядрі та 50-75% клітин ядра діагональної смужки є холінергічними нейронами. Інші нейрони септальних ядер, що надсилають аксони до ЗЗ, є ГАМК-ергічними. При цьому, холінергічні та ГАМК-ергічні волокна утворюють синапси на різних типах постсинаптичних нейронів. Волокна ГАМК-ергічних нейронів закінчуються, переважно, на інших ГАМК-ергічних нейронах, таких як кошикові пірамідні клітини (див. вище). На відміну від них, холінергічні септальні аксони утворюють синапси в ЗЗ з гранулярними клітинами, інервуючи їхні дендрити у внутрішній третині молекулярного шару. Натомість близько 5-10% септальних холінергічних аксонів утворюють синапси на мохових клітинах[43].
Сигнальний шлях від гіпоталамуса
Основна вхідна інервація, що її надсилає гіпоталамус до ЗЗ, походить з групи нейронів великого розміру, локалізованих у супрамамілярній частині цього відділу мозку[44]. Cупрамамілярна проєкція, в основному, надходить до зони, локалізованої над гранулярним шаром, з незначною інервацією поліморфного і молекулярного шарів. Ця нервова проєкція є збуджувальною, нейромедіатором у її синапсах слугує глутамат[45]. Окрім глутамату, супрамамілярні нейрони, що інервують ЗЗ, також синтезують кальретинін та субстанцію Р[46].
Сигнальні шляхи від стовбура мозку
ЗЗ отримує вхідні нервові сигнали від кількох окремих структур стовбура головного мозку. По-перше, це блакитна пляма, з якої надходять норадренергічні волокна, які утворюють синапси, в основному, у поліморфному шарі та продовжуються до зони CA3 гіпокампу[47]. По-друге, це менший за обсягом передаваних сигналів пучок дофамінегрічних аксонів, що походить з вентральної області покришки, та утворює синапси переважно в поліморфному шарі. По-третє, це серотонінергічна проекція, що походить з медіанної і дорсальної частин ядер шва та утворює синапси в субгранулярній частині поліморфного шару на пірамідальних кошикових нейронах та інших інтернейронах поліморфного шару, характерною рисою яких є експресія (синтез) кальбіндіну[48].
Функції
ЗЗ (разом з іншими відділами мозку) залучена до виконання кількох вищих функції нервової системи, таких як навчання, пам'ять та орієнтація в просторі, де вона відіграє важливу роль. Основним функціональним навантаженням ЗЗ є первинна обробка вхідних збуджувальних сигналів, з наступною передачею сигналу до зони CA3 гіпокампу[49].
ЗЗ отримує сенсорні нервові сигнали, що кодують зорову, нюхову, вестибулярну, слухову та соматосенсорну інформацію з енторинальної кори, разом з інформацією про просторове положення тіла[50]. При цьому, медіальна частина ЗЗ обробляє просторову інформацію, а латеральна — непросторову (слухову, соматосенсорну, і т. ін.)[51]. Таким чином, медіальна частина перфорантного шляху передає в ЗЗ просторову інформацію шляхом активації NMDA-рецепторів, а латеральна — зокрема, візуальну інформацію шляхом активації опіоїдних рецепторів[52].
Одна гранулярна клітина ЗЗ утворює синапси з, в середньому, 15-ма пірамідними нейронами зони CA3 гіпокампу. Водночас до кожного пірамідного нейрона надходять сигнали з, у середньому, 72-х гранулярних клітин[53]. З огляду на велику кількість клітин і вищезазначені особливості з'єднання між нейронами ЗЗ та CA3, а також з огляду на низьку частоту генерації потенціалів дії гранулярними клітинами, вірогідність того, що один пірамідний нейрон у CA3 отримує одночасно збуджуювальний сигнал більше ніж від однієї гранулярної клітини є дуже малою. Тому сигнальний патерн, що надходить з неокортексу до ЗЗ, розподіляється між гранулярними клітинами, а потім «перезбирається» при передачі сигналів на пірамідні нейрони CA3[54][55]. З огляду на такий принцип передачі сигналів, ЗЗ вважають структурою, що здійснює обробку та розрізнення сигнальних патернів кори головного мозку. Ця функція ЗЗ є ключовою в процесі декореляції запам'ятованих структур, зокрема розрізнення двох подібних спогадів[56].
Роль у розвитку патологічних станів
Епілепсія
З огляду на площинну (ламінарну) структуру передавальних шляхів у ЗЗ (і в гіпокампі в цілому), ця частина мозку при збудженні продукує великі польові електричні потенціали, які підтримують збудження в аксонах, і, отже, роблять ЗЗ особливо чутливою до епілептиформних вхідних сигналів. Зокрема, було показано, що аналогічні за природою епілептиформні сигнальні артефакти в ЗЗ є більшими ніж в інших частинах мозку, вразливих до епілепсії[58]. Окрім наведеного теоретичного обґрунтування, численні клінічні спостереження та посмертні анатомічні розтини свідчили про значну роль гіпокампа загалом і ЗЗ зокрема в генерації епілепсії, особливо скроневої епілепсії[59]. Протягом кількох останніх десятиріч визначальна роль ЗЗ у генерації скроневої епілепсії була дещо піддана сумніву, що, втім, все одно лишає ЗЗ важливим елементом у формуванні синдрому даного захворювання[60][61].
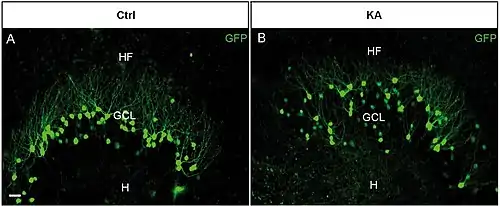
Іншим аргументом для розгляду ЗЗ як одного з центральних факторів при розвитку скроневої епілепсії є гіпотеза про те, що втрата нейронів хілуса, характерна для хворих з розвинутою стадією епілепсії, є одним з елементів іншого ураження — мезіального скроневого склерозу — і є мінімальною достатньою умовою для розвитку даного виду епілепсії[62]. На підтвердження цього, кілька досліджень тваринних моделей травматичних уражень мозку[63][64] та ішемії[65][66], котрі можуть призводити до епілепсії, показали, що хілус є надзвичайно вразливим при таких ураженнях. Таким чином, увагу було сконцентровано на вразливостях різних типів розташованих у хілусі нейронів, і на тому, як ці вразливості можуть позначитись на електрофізіологічних характеристиках відповідних нейронних мереж у ЗЗ. Дослідження цього питання спонукали появу щонайменше двох гіпотез щодо наслідків втрати нейронів хілусу та паралельного підвищення збудливості нейронних мереж у ЗЗ, що обумовлює розвиток епілепсії. По-перше, підвищення збудливості мереж з причини зниження в них кількості гальмівних нейронів[67]; по-друге, з причини зменшення кількості та потужності вхідних збуджувальних сигналів, що їх отримують гальмівні інтернейрони («гіпотеза дизінгібіції», або «гіпотеза сплячих кошикових нейронів»)[62][68]. При цьому, у ході розвитку епілепсії, ГКЗЗ розсіюються з гранулярного шару та частково мігрують з гранулярного шару ЗЗ до хілуса, що є однією з характерних патолого-анатомічних ознак цього захворювання (див. Рис. 9)[57].
Хвороба Альцгеймера
Як частина гіпокампа, що відіграє важливу роль у формуванні пам'яті, ЗЗ активно вивчалася практично з часу початку цитологічних та ультраструктурних досліджень, пов'язаних з цим захворюванням. Як і в багатьох інших частинах мозку, морфологічне та функціональне ураження ЗЗ, викликане хворобою Альцгеймера (ХА), пов'язане з трьома основними факторами: втратою синаптичних зв'язків (особливо на ранніх стадіях хвороби), накопиченням і відкладанням білка тау (τ) та/або білка бета-амілоїду (Аβ).
Морфологічні та ультраструктурні дослідження показали статистично перевірений зв'язок між розвитком ХА та втратою синаптичних з'єднань, у тому числі в ЗЗ. Зокрема, у пацієнтів з ХА кількість синапсів на кубічний міліметр нервової тканини зменшується на 21% у зовнішній частині молекулярного шару ЗЗ[69] та на 15 % у внутрішній частині молекулярного шару, а кількість синапсів на одному гранулярному нейроні зменшується на 27%[70]; на відміну від інших частин гіпокампу, кількість гранулярних нейронів при цьому вірогідно не змінюється[70][71]. При цьому втрата функціональних синапсів у ЗЗ (і, як наслідок, здатних до проведення сигналів нервових волокон) внаслідок ХА викликає активне утворення нових синапсів у прилеглих неуражених зонах, що може частково компенсувати ефект ХА[72]. Кілька наукових груп, базуючись на незалежних джерелах експериментальних даних, висунули припущення, що зменшення кількості синапсів на дендритах ГКЗЗ відбувається в основному внаслідок синапсів, утворених нейронами хілуса[73][74][75].
Щільні клубочки білка тау сферичної форми (на відміну від інших частин гіпокампу, таких як пірамідний шар зон CA1-CA3, де ці утворення набувають форми смолоскипа) виникають у ГКЗЗ лише на пізніх стадіях ХА: стадія VI за Брааком[76]. Кількісні параметри ураження можуть варіювати: при дослідженнях за допомогою моноклональних антитіл до білка тау на цих стадіях ХА було виявлено ураження 1.7-4.2%[71] або десятків відсотків[77] ГКЗЗ такими клубочками. Разом з тим, в експериментах з кольоровою індикацією гіперфосфорильовані волокна білка тау виникають як дифузна хмара у зовнішньому молекулярному шарі ЗЗ починаючи зі стадії III розвитку ХА; поява цього ефекту корелює з виникненням деменції[78]. Інтернейрони вражаються набагато менше, можливо завдяки наявності в них великої кількості білків, що зв'язують необхідний для формування клубків протеїну тау кальцій, таких як парвальбумін та кальретинін[79][80][81]. Проте, така невразливість не є абсолютною: імуноцитологічні дослідження виявляють формації білка тау в невеликій кількості інтернейронів[82].
Виникнення бляшок Аβ в ЗЗ спостерігаються пізніше, ніж в інших частинах гіпокампу; в зоні CA1 такі бляшки спостерігається починаючи з фази 2 відкладання Аβ, тоді як у ЗЗ вони спостерігаються не раніше фази 3[83]. За допомогою кореляційного аналізу було показано, що фази 1 та 2 у гіпокампі не супроводжуються порушеннями когнітивних функцій, що є аргументом на користь контролю за цими функціями саме з боку ЗЗ[83]. Бляшки Аβ спостерігаються приблизно в зоні між двома зовнішніми та внутрішньою третиною молекулярного шару, тобто в термінальній зоні перфорантного шляху[84] приблизно на фазі IV розвитку ХА за Брааком[76]; це пізніше, ніж в енторинальній корі, з нейронів якої виходять аксони перфорантного шляху, і де бляшки Аβ спостерігаються починаючи з фази III[76]. На стадії V кількість бляшок вірогідно збільшується, і стає помітно, що вони групуються в ряди; стадію VI характеризує наявність щільних рядів бляшок Аβ всередині нейронів ЗЗ; при цьому термінальна зона мохових волокон лишається вільною від бляшок Аβ навіть на пізніх стадіях ХА[76].
Шизофренія
| Ліва ЗЗ | ||||||
|---|---|---|---|---|---|---|
| Mean | SE | Інтервал | n | t | p | |
| Здорові пацієнти | 574 | 4.16 | 365–774 | 300 | -4.95 | 2.8×10−6 |
| Пацієнти з шизофренією | 542 | 5.11 | 367–774 | 210 | ||
| Права ЗЗ | ||||||
| Mean | SE | Інтервал | n | t | p | |
| Здорові пацієнти | 600 | 4.45 | 372–857 | 300 | -5.31 | 4.5×10−7 |
| Пацієнти з шизофренією | 565 | 5.24 | 351–789 | 210 | ||
Значна роль гіпокампа в процесах навчання, реалізації коротко- та довгострокової пам'яті, а також когнітивних функцій, протягом його вивчення зробила аксіоматичним твердження щодо його ураження в процесі розвитку шизофренії; ці припущення були неодноразово підтверджені клінічними, патолого-анатомічними, та експериментальними дослідженнями на тканинному, клітинному та біохімічному рівнях[86][87].
ЗЗ як важлива структурна й функціональна частина гіпокампу, також залучена до аномалій пов'язаних з шизофренією. Розвиток цієї хвороби супроводжується, аналогічно гіпокампу в цілому, змінами в ЗЗ на кількох рівнях організації. По-перше, спостерігається високодостовірне зменшення об'єму ЗЗ у пацієнтів з шизофренією (див. таблицю)[85]. По-друге, спостерігаються зміни в морфології нейронів: майже вдвічі (з 22±2% до 43±3%) підвищується частка ГКЗЗ з базальними дендритами[88]. По-третє, на відміну від інших частин гіпокампу, в ЗЗ при шизофренії зменшується активність синтезу субодиниці глутаматних рецепторів GluN1[89], яка є критично важливим елементом для формування функціональних NMDA-рецепторів. Таким чином, у ході розвитку шизофренії відбувається зменшення об'єму збуджувальних сигналів, що надходять до ГКЗЗ; ГКЗЗ, своєю чергою, завдяки цьому надсилають менше гальмівних сигналів на пірамідні нейрони гіпокампальної зони CA3, що призводить до аномально високого збудження останніх. Таке збудження викликає порушення процесів обробки сигналів та синаптичної пластичності в CA3. Описана аномальна активність у зоні CA3 призводить до підвищеної асоціативності стандартних патернів вхідних сигналів і помилкового кодування вихідних сигналів при виклику масивів довготривалої пам'яті; як результат, відбувається генерація фальшивих спогадів психотичного характеру[90].
Іншою біохімічною аномалією в ЗЗ, що супроводжує шизофренію, є вдвічі підвищена активність експресії рецепторів ретиноєвої кислоти RARα. Припускають, що аномально висока кількість RARα призводить до патології росту та диференціації ЗЗ у ході ембріонального розвитку та в постнатальний період, що підвищує ймовірність розвитку шизофренії[91].
Посилання
- Amaral, DG.; Lavenex, P. Hippocampal neuroanatomy. In: Andersen, P.; Morris, R.; Amaral, D.; Bliss, T.; O'Keefe, J., editors. The Hippocampus Book. Oxford University Press; New York: 2007(англ.)
- Faiz M, Acarin L, Castellano B, Gonzalez B (2005). Proliferation dynamics of germinative zone cells in the intact and excitotoxically lesioned postnatal rat brain. BMC Neurosci. 6 (1): 26. PMC 1087489. PMID 15826306. doi:10.1186/1471-2202-6-26.
- Georg F. Striedter (15 травня 2015). Evolution of the hippocampus in reptiles and birds. The Journal of Comparative Neurology. doi:10.1002/cne.23803.
- Gupta S; Maurya R; Saxena M; Sen J (15 червня 2012). Defining structural homology between the mammalian and avian hippocampus through conserved gene expression patterns observed in the chick embryo. Dev. Biol. doi:10.1016/j.ydbio.2012.03.027.
- Abellán A; Desfilis E; Medina L (4 липня 2014). Combinatorial expression of Lef1, Lhx2, Lhx5, Lhx9, Lmo3, Lmo4, and Prox1 helps to identify comparable subdivisions in the developing hippocampal formation of mouse and chicken. Front. Neuroanat. doi:10.3389/fnana.2014.00059.
- Olucha F; Martinez-Garcia F; Poch L; Schwerdtfeger W; Lopez-Garcia C (22 жовтня 1988). Projections from the medial cortex in the brain of lizards: correlation of anterograde and retrograde transport of horseradish peroxidase with Timm staining. J. Comp. Neurol. doi:10.1002/cne.902760402.
- Altman J; Bayer S (15 листопада 1990). Migration and distribution of two populations of hippocampal granule cell precursors during the perinatal and postnatal periods. J. Comp. Neurol. doi:10.1002/cne.903010304.
- Nacher J; Ramirez C; Molowny A (7 жовтня 1996). Ontogeny of somatostatin immunoreactive neurons in the medial cerebral cortex and other cortical areas of the lizard Podarcis hispanica. J. Comp. Neurol. doi:10.1002/(SICI)1096-9861(19961007)374:1<118::AID-CNE9>3.0.CO;2-6.
- Lisa Basler; Stephan Gerdes; David P. Wolfer; Lutz Slomianka (12 грудня 2017). Sampling the Mouse Hippocampal Dentate Gyrus. Front. Neuroanat. doi:10.3389/fnana.2017.00123.
- Tuncdemir, SN; Lacefield, CO; Hen, R (18 листопада 2019). Contributions of adult neurogenesis to dentate gyrus network activity and computations.. Behavioural Brain Research 374: 112112. PMC 6724741. PMID 31377252. doi:10.1016/j.bbr.2019.112112.
- Z. S. Han; E. H. Buhl; Z. Lorinczi; P. Somogyi (1993). A high degree of spatial selectivity in the axonal and dendritic domains of physiologically identified local-circuit neurons in the dentate gyrus of the rat hippocampus. Eur. J. Neurosci. PMID 8261117.
- Nolte, John (2002). The Human Brain: An Introduction to Its Functional Neuroanatomy (вид. 5). с. 570–573.
- Rachel A. Dalley; Lydia L. Ng; Angela L. Guillozet-Bongaarts (2008). Dentate Gyrus. Nature Precedings. doi:10.1038/npre.2008.2095.1.
- О. Н. Верхратський, С. А. Федулова. Ендоплазматичний ретикулум і регуляція вивільнення нейромедіаторів у пресинаптичних терміналях // Фізіологічний журнал. — 2004. — Т. 50, вип. 4. — С. 142-149..
- Senzai, Y (March 2019). Function of local circuits in the hippocampal dentate gyrus-CA3 system.. Neuroscience Research 140: 43–52. PMID 30408501. doi:10.1016/j.neures.2018.11.003.
- Brenda J. Claiborne; David G. Amaral; Maxwell Cowan (22 квітня 1986). A light and electron microscopic analysis of the mossy fibers of the rat dentate gyrus. J. Comp. Neurol. 246: 435–58. doi:10.1002/cne.902460403.
- Н. Hagihara; К. Ohira; К. Toyama; Т Miyakawa (8 грудня 2011). Expression of the AMPA receptor subunits GluR1 and GluR2 is associated with granule cell maturation in the dentate gyrus. Front. Neurosci. doi:10.3389/fnins.2011.00100.
- Carmen Vivar; Henriette van Praag (25 лютого 2013). Functional circuits of new neurons in the dentate gyrus.. Front. Neur. Circ. doi:10.3389/fncir.2013.00015.
- Brenda J. Claiborne; David G. Amaral; W. Maxwell Cowan (8 грудня 1990). Quantitative, three‐dimensional analysis of granule cell dendrites in the rat dentate gyrus. J. Comp. Neurol. doi:10.1002/cne.903020203.
- Nancy L.Desmond; William B.Levy (15 березня 1985). Granule cell dendritic spine density in the rat hippocampus varies with spine shape and location. Neuroscience Letters. doi:10.1016/S0304-3940(85)80082-3.
- P R Rapp; M Gallagher (3 вересня 1996). Preserved neuron number in the hippocampus of aged rats with spatial learning deficits. Proc. Natl. Acad. Sci. USA. doi:10.1073/pnas.93.18.9926.
- C. E. Ribak; L. Seress; D. G. Amaral (October 1985). The development, ultrastructure and synaptic connections of the mossy cells of the dentate gyrus. J Neurocytol. doi:10.1007/bf01170832.
- L. Acsády; A. Kamondi; T. Freund; G. Buzsáki (1 травня 1998). GABAergic cells are the major postsynaptic targets of mossy fibers in the rat hippocampus. J Neurosci. doi:10.1523/JNEUROSCI.18-09-03386.1998.
- Anthony J.G.D.Holtmaat; Jan A.Gorter; Joris DeWit; Else A.Tolner, et al. (July 2003). Transient downregulation of sema3a mrna in a rat model for temporal lobe epilepsy: A novel molecular event potentially contributing to mossy fiber sprouting. Exp. Neurology. doi:10.1016/S0014-4886(03)00035-9.
- Paul S. Buckmaster; Guo Feng Zhang; Ruth Yamawaki (1 серпня 2002). Axon Sprouting in a Model of Temporal Lobe Epilepsy Creates a Predominantly Excitatory Feedback Circuit. J. Neurosci. doi:10.1523/JNEUROSCI.22-15-06650.2002.
- C. R. Houser (July 1992). Morphological changes in the dentate gyrus in human temporal lobe epilepsy. Epilepsy Res. Suppl. PMID 1466768.
- М. С. Walker; А. Ruiz; D. М. Kullmann (2002). Do mossy fibers release GABA?. Epilepsia. PMID 12121321.
- C. R. Houser (2007). Interneurons of the dentate gyrus: an overview of cell types, terminal fields and neurochemical identity. Progress in Brain Research. doi:10.1016/S0079-6123(07)63013-1.
- A. Sik; M. Penttonen; G. Buzsaki (1997). Interneurons in the hippocampal dentate gyrus — an in vivo intracellular study. Eur. J. Neurosci. PMID 9104599.
- R. G. Struble; N. L. Desmond; W. B Levy (1978). Anatomical evidence for interlamellar inhibition in the fascia dentata. Brain Res. PMID 687975.
- S. Jinde; V. Zsiros; K. Nakazawa (12 лютого 2013). Hilar mossy cell circuitry controlling dentate granule cell excitability. Front. Neural Circuits. doi:10.3389/fncir.2013.00014.
- R. Murakawa; T. Kosaka (2001). Structural features of mossy cells in the hamster dentate gyrus, with special reference to somatic thorny excrescences. J. Comp. Neurol. doi:10.1002/1096-9861(20000101)429:1<113::aid-cne9>3.0.co;2-d.
- H. E. Scharfman; C. E. Myers (9 січня 2013). Hilar mossy cells of the dentate gyrus: a historical perspective. Front. Neural Circuits. doi:10.3389/fncir.2012.00106.
- C. E. Ribak (1992). Local circuitry of GABAergic basket cells in the dentate gyrus. Epilepsy Res. Suppl. PMID 1334668.
- J. M. Boyett; P. S. Buckmaster (2001). Somatostatin-immunoreactive interneurons contribute to lateral inhibitory circuits in the dentate gyrus of control and epileptic rats. Hippocampus. PMID 11530846.
- Е. Soriano; М. Frotscher (1989). A GABAergic axo-axonic cell in the fascia dentata controls the main excitatory hippocampal pathway. Brain Res. PMID 2611653.
- G. Xiong; H. Metheny; B. Johnson; A. Cohen (2017). A Comparison of Different Slicing Planes in Preservation of Major Hippocampal Pathway Fibers in the Mouse. Front. Neuroanat. PMID 29201002.
- T. Deller; A. Martinez; R. Nitsch; M. Frotscher (1996). A novel entorhinal projection to the rat dentate gyrus — direct innervation of proximal dendrites and cell bodies of granule cells and gabaergic neurons. J. Neurosci. PMID 8627369.
- А. Hjorth-Simonsen; В. Jeune (1972). Origin and termination of the hippocampal perforant path in the rat studied by silver impregnation. J. Comp. Neurol. PMID 4112908.
- N. Tamamaki; Y. Nojyo (1993). Projection of the entorhinal layer-II neurons in the rat as revealed by intracellular pressure-injection of neurobiotin. Hippocampus. PMID 8269038.
- С. Köhler (1985). Intrinsic projections of the retrohippocampal region in the rat brain. I. The subicular complex.. J. Comp. Neurol. PMID 3902916.
- L. W. Swanson (1978). The anatomical organization of septo-hippocampal projections. Editors: Katherine Elliott, Julie Whelan. Novartis Foundation Symposia. doi:10.1002/9780470720394.ch4.
- J. Lübke; T. Deller; M. Frotscher (1997). Septal innervation of mossy cells in the hilus of the rat dentate gyrus — an anterograde tracing and intracellular labeling study. Exp. Brain Res. PMID 9187278.
- Z. Magloczky; L. Acsady; T. Freund (1994). Principal cells are the postsynaptic targets of supramammillary afferents in the hippocampus of the rat. Hippocampus. PMID 7531093.
- J. Kiss; A. Csaki; H. Bokor; M. Shanabrough; C. Leranth (2000). The supramammillo-hippocampal and supramammillo-septal glutamatergic/aspartatergic projections in the rat: a combined [3H]D-aspartate autoradiographic and immunohistochemical study. Neuroscience. PMID 10842010.
- Z. Borhegyi; C. Leranth (1997). Distinct substance P- and calretinin-containing projections from the supramammillary area to the hippocampus in rats — a species difference between rats and monkeys. Exp. Brain Res. PMID 9224865.
- S. Loughlin; S. Foote; F. Bloom (1986). Efferent projections of nucleus locus coeruleus: topographic organization of cells of origin demonstrated by three-dimensional reconstruction. Neuroscience. PMID 3736860.
- С. Köhler; Р. Steinbusch (1982). Identification of serotonin and non-serotonin-containing neurons of the midbrain raphe projecting to the entorhinal area and the hippocampal formation. A combined immunohistochemical and fluorescent retrograde tracing study in the rat brain. Neuroscience. PMID 7048127.
- P. Jonas; J. Lisman (2014). Structure, function, and plasticity of hippocampal dentate gyrus microcircuits. Front. Neural Circuits. doi:10.3389/fncir.2014.00107.
- T. Hafting; M. Fyhn; S. Molden; M. Moser; E. Moser (2005). Microstructure of a spatial map in the entorhinal cortex. Nature. doi:10.1038/nature03721.
- E. Hargreaves; G. Rao; I. Lee; J. Knierim (2005). Major dissociation between medial and lateral entorhinal input to dorsal hippocampus. Science. doi:10.1126/science.1110449.
- В. Poucet (1989). Object exploration, habituation, and response to a spatial change in rats following septal or medial frontal cortical damage. Behavioral Neuroscience. doi:10.1037//0735-7044.103.5.1009.
- Witter, М (2010). In: Cutsuridis V, Graham B, Cobb S, Vida I, editors. Hippocampal microcircuits: a computational modeler’s resource book. ISBN 978-3-319-99103-0.
- B. McNaughton; L. Nadel (1990). Hebb-Marr networks and the neurobiological representation of action in space. In: Neuroscience and connectionist theory. Hillsdale, NJ: Erlbaum. ISBN 9780805806199.
- В. McNaughton; R. Morris (1987). Hippocampal synaptic enhancement and information storage within a distributed memory system. Trends Neurosci. doi:10.1016/0166-2236(87)90011-7.
- А. Treves; А. Tashiro; М. Witter; Е. Moser (2008). What is the mammalian dentate gyrus good for?. Neuroscience. doi:10.1016/j.neuroscience.2008.04.073.
- C. Orcinha; G. Münzner; J. Gerlach; A. Kilias; M. Follo; U. Egert; C. A. Haas (2016). Seizure-Induced Motility of Differentiated Dentate Granule Cells Is Prevented by the Central Reelin Fragment. Front. Cell. Neurosci. doi:10.3389/fncel.2016.00183.
- A. Bragin; I. Mody; C. Wilson; J. Engel (2002). Function of local circuits in the hippocampal dentate gyrus-CA3 system. J. Neurosci. PMID 11880532.
- J. Engel (1989). Seizures and Epilepsy (Contemporary Neurology Series). F.A. Davis Company, Philadelphia, PA. doi:10.1002/ana.410280323.
- Е. Bertram (1997). Functional anatomy of spontaneous seizures in a rat model of limbic epilepsy. Epilepsia. PMID 9024190.
- Р. Gloor (1992). Role of the amygdala in temporal lobe epilepsy. In: Aggleton J.P. (Ed.), The Amygdala: Neurobiological Aspects of Emotion, Memory, and Mental Dysfunction. Wiley-Liss, Inc., New York.
- R. Sloviter; С. Zappone; В. Harvey; А. Bumanglag (2003). ‘‘Dormant basket cell’’ hypothesis revisited: relative vulnerabilities of dentate gyrus mossy cells and inhibitory interneurons after hippocampal status epilepticus in the rat. J. Comp. Neurol. PMID 12629666.
- D. Lowenstein; M. Thomas; D. Smith; T. McIntosh (1992). Selective vulnerability of dentate hilar neurons following traumatic brain injury: a potential mechanistic link between head trauma and disorders of the hippocampus. J. Neurosci. PMID 1464770.
- Z. Toth; G. Hollrigel; T. Gorcs; I. Solesz (1997). Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. PMID 9334386.
- M. Hsu; G. Buzsaki (1993). Vulnerability of mossy fiber targets in the rat hippocampus to forebrain ischemia. J. Neurosci. doi:10.1523/JNEUROSCI.13-09-03964.1993.
- P. Williams; P. Pou; F. Dudek (2004). Epilepsy and synaptic reorganization in a model of perinatal hypoxia-іschemia. Epilepsia. doi:10.1111/j.0013-9580.2004.60403.x.
- С. Houser; М. Esclapez (1996). Vulnerability and plasticity of the GABA system in the pilocarpine model of spontaneous recurrent seizures. Epilepsy Res. doi:10.1016/s0920-1211(96)00054-x.
- R. Sloviter (1987). Decreased hippocampal inhibition and a selective loss of interneurons in experimental epilepsy. Science. doi:10.1126/science.2879352.
- S. Scheff; D. Sparks; D. Price (1996). Quantitative assessment of synaptic density in the outer molecular layer of the hippocampal dentate gyrus in Alzheimer's disease. Dementia. doi:10.1159/000106884.
- S. Scheff; D. Price (1998). Synaptic density in the inner molecular layer of the hippocampal dentate gyrus in Alzheimer disease. J. Neuropathol. Exp. Neurol. doi:10.1097/00005072-199812000-00006.
- М. Bobinski; J. Wegiel; M. Tarnawski; B. Reisberg; M. de Leon et al. (1997). Relationships between regional neuronal loss and neurofibrillary changes in the hippocampal formation and duration and severity of Alzheimer disease. J. Neuropathol. Exp. Neurol. doi:10.1097/00005072-199704000-00010.
- S. Hoff; S. Scheff; А. Kwan; С. Cotman (1981). A new type of lesion-induced synaptogenesis. I. Synaptic turnover in non-denervated zones of the dentate gyrus in young adult rats. Brain Res. doi:10.1016/0006-8993(81)90936-7.
- M. Bobinski; J. Wegiel; H. Wisniewski; M. Tarnawski; M. Bobinski et al. (1996). Neurofibrillary pathology—correlation with hippocampal formation atrophy in Alzheimer disease. Neurobiol. Aging. doi:10.1016/s0197-4580(97)85095-6.
- W. Samuel; E. Masliah; L. Hill; N. Butters; R. Terry (1994). Hippocampal connectivity and Alzheimer’s dementia: effects of synapse loss and tangle frequency in a two-component model. Neurology. doi:10.1212/wnl.44.11.2081.
- M. West; P. Coleman; D. Flood; J. Troncoso (1994). Differences in the pattern of hippocampal neuronal loss in normal ageing and Alzheimer’s disease. Lancet. doi:10.1016/s0140-6736(94)92338-8.
- Н. Braak; E. Braak (1991). Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol. doi:10.1007/bf00308809.
- К. Wakabayashi; M. Narisawa-Saito; Y. Iwakura; T. Arai; K. Ikeda et al. (1999). Phenotypic down-regulation of glutamate receptor subunit GluR1 in Alzheimer’s disease. Neurobiol. Aging. doi:10.1016/s0197-4580(99)00035-4.
- D. Thal; M. Holzer; U. Rub; G. Waldmann; S. Günzel et al. (2000). Alzheimer-related tau-pathology in the perforant path target zone and in the hippocampal stratum oriens and radiatum correlates with onset and degree of dementia. J. Neuropathol. Exp. Neurol. doi:10.1006/exnr.2000.7380.
- E. Braak; B. Strotkamp; H. Braak (1991). Parvalbumin-immunoreactive structures in the hippocampus of the human adult. Cell Tissue Res. doi:10.1007/bf00305720.
- R. Nitsch; T. Ohm (1991). Calretinin immunoreactive structures in the human hippocampal formation. J. Comp. Neurol. doi:10.1002/cne.903600309.
- T. Freund; G. Buzsaki (1996). Interneurons of the hippocampus. Hippocampus. doi:10.1002/(SICI)1098-1063(1996)6:4<347::AID-HIPO1>3.0.CO;2-I.
- N. Iwamoto; P. Emson (1991). Demonstration of neurofibrillary tangles in parvalbumin-immunoreactive interneurones in the cerebral cortex of Alzheimer-type dementia brain. Neurosci. Lett. doi:10.1016/0304-3940(91)90764-k.
- D. Thal; U. Rub; M. Orantes; H. Braak (2002). Phases of A beta-deposition in the human brain and its relevance for the development of AD. Neurology. doi:10.1212/wnl.58.12.1791.
- В. Crain; Р. Burger (1988). The laminar distribution of neuritic plaques in the fascia dentata of patients with Alzheimer’s disease. Acta Neuropathol. doi:10.1007/bf00687684.
- U. Haukvik; L. Westlye; L. Mørch-Johnsen; K. Jørgensen; E. Lange (2015). In Vivo Hippocampal Subfield Volumes in Schizophrenia and Bipolar Disorder. Biol. Psychiatry. doi:10.1016/j.biopsych.2014.06.020.
- Р. Harrison (2004). The hippocampus in schizophrenia: a reviewof the neuropathological evidence and its pathophysiological implications. Psychopharmacology (Berlin). doi:10.1007/s00213-003-1761-y.
- S. Schobel et al. (2013). Imaging Patients with Psychosis and a Mouse Model Establishes a Spreading Pattern of Hippocampal Dysfunction and Implicates Glutamate as a Driver. Neuron). doi:10.1016/j.neuron.2013.02.011.
- М. Lauer; Н. Beckmann; D. Senitz (2003). Increased frequency of dentate granule cells with basal dendrites in the hippocampal formation of schizophrenics. Psychiatry Res. doi:10.1016/s0925-4927(02)00122-1.
- А. Stan; S. Ghose; C. Zhao; K. Hulsey; Р. Mihalakos (2014). Magnetic resonance spectroscopy and tissue protein concentrations together suggest lower glutamate signaling in dentate gyrus in schizophrenia. Molecular Psychiatry. doi:10.1038/mp.2014.54.
- С. Tamminga; А. Stan; А. Wagner (2010). The hippocampal formation in schizophrenia. Am. J. Psychiatry. doi:10.1176/appi.ajp.2010.09081187.
- L. Rioux; S. Arnold (2005). The expression of retinoic acid receptor alpha is increased in the granule cells of the dentate gyrus in schizophrenia. Psychiatry Res. doi:10.1016/j.psychres.2004.11.003.
|
|
Ця стаття належить до добрих статей української Вікіпедії. |
.jpg.webp)