Grid-нейрон
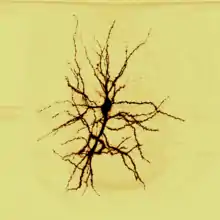
Grid-нейрони (англ. grid cells або нейрони решітки чи «координатні нейрони», від grid «решітка, ґратка») — це просторово вибіркові нейрони в медіальній енторіальній корі ссавців, які різняться від всіх інших нейронів регулярно повторюваними гексагонально-подібними рецептивними полями, що активізуються не в одному, а в множині місць будь-якого середовища. Нейрони решітки є ключовою частиною системи мозку, що будує когнітивну карту власного місцезнаходження тварини в просторі.

Кожен нейрон в дорсолатеральній медіальній енторіальній корі електрично збуджується тоді, коли тварина знаходиться на вершині уявної правильної трикутної решітки, що заповнює площину, в якій вона рухається. Тоді як в гіпокампі схожі за функціями нейрони місця активуються тільки в одному, конкретному місці в просторі, то нейрони решітки в медіальній енторіальній корі репрезентують фізичний світ через гексагональну ґратку тоді, коли кожен нейрон активується щоразу, як тварина рухається через поле розряду, з центром у специфічній для нейрона точці (вузлові) ґратки.
Характер розрядів grid-нейронів незалежний від зовнішніх сигналів та розміру і форми загорожі, в якій знаходиться тварина, тому щоразу правильно оновлюється, коли вона рухається в даному середовищі, навіть за умов цілковитої темряви[1], припускаючи, що ці нейрони є частиною внутрішньо породжуваної та універсальної карти просторового середовища.[2]
Геометричні властивості паттернів розрядів нейронів решіток, а також їх синаптична проекція до нейронів місця в гіпокампі відводять цим нейронам ключову роль в кодуванні та репрезентації простору. Стійка структура їхньої решітки, разом із просторовою періодичністю, роблять grid-нейрони визначальною частиною нейронної метрики для локального простору. Ця метрична решітка уможливлює ті просторові обчислення, що лежать в основі нашого відчуття місця.
Унікальний характер розрядів решіток (однаковість і повторюваність в різних середовищах, незалежно від контексту) свідчить про те, що grid-код енторіальної кори є винятково когнітивним конструктом. І хоча паттерни розрядів нейронів решітки оновлюються та калібруються сенсорними вхідними сигналами із зорової, вестибулярної, кінематичної та інших систем, вони не залежать від зовнішніх сенсорних сигналів, і цілком конструюються в енторіальних нейронних ланцюгах. Нейрони місця в гіпокампі такою незалежністю від зовнішнього світу не володіють, оскільки їхні паттерни розрядів визначаються специфічною комбінацією сенсорних орієнтирів та сигналів, що існують в конкретних локальних місцях.
Відкриття нейронів решітки, та їх зв'язок з нейронами місця, надали матеріальну основу радикальним для свого часу ідеям Іммануїла Канта («Критика чистого розуму», 1781), визначаючи простір організаційним принципом розуму, що обумовлює та впорядковує наш досвід сприйняття світу у відповідності із заданими, вродженими властивостями мозку, які до того ж майже однакові серед багатьох ссавців.[3]
Хоча найбільш інтенсивно нейрони решітки вивчались у щурів та мишей, нещодавні дослідження виявили їх присутність в кажанах[4] та приматах[5], включаючи людей[6], однак щодо останніх досі точаться дискусії, чи є вони власне нейронами решітки в класичному сенсі, як вони були виявлені в щурах. Також решітко-подібні нейрони було виявлено в голубів, хоча, на відміну від щурів, у них решітки впорядковані в ряди, так що множина сусідніх груп нейронів формує квадрати.[7]
Загальна характеристика
Ієрархія кіркової репрезентації. Найпростіші форми відображення зовнішнього світу знаходяться на ранніх стадіях нейронних систем, де порядок речей в зовнішньому світі дублюється в порядку «карт», що виражають просторову організацію сенсорних рецепторів. Зорова (А), слухова (Б) і тактильна (В) сенсорні карти є прикладами таких відображень, де викривлені, але зберігаючі порядок та сусідство, проекції формуються між сенсорним органом та мозком. На вершині ієрархії репрезентації кори відображення зовнішнього світу сильно залежить від внутрішніх механізмів і тому є не-топографічним. Такою є карта зовнішнього простору (Г) в гіпокампі та мЕК із нейронами місця та решітки відповідно. Характерні паттерни розрядів цих нейронів є унікальними з-поміж всіх інших тим, що вже не відображають властивості стимулу із зовнішнього світу, а самі формують відповідні паттерни в яких цей світ схоплюється та упорядковується[8]
Зовнішній світ відображається на множині рівнів кіркової ієрархії, від ранніх рівнів первинних сенсорних областей кори до найвищих рівнів асоціативних областей. На вершині абстракції знаходиться відображення зовнішнього простору в гіпокампі та медіальній енторинальній корі (надалі мЕК).
Гіпокамп та енторинальна кора (ЕК) ссавців містять нейрони, що характеризуються просторово вибірковими розрядами потенціалів дії. Нейрони місця, що розташовані переважно в областях СА1 та СА3 гіпокампа, активізуються головним чином тоді, коли тварина знаходиться в певному просторовому місці її середовища.[9] Більшість, але не всі, нейрони місця характеризуються єдиним полем розряду в експериментальних середовищах зі стандартними розмірами. Простір кодується нейронами місця в гіпокампі нетопографічно, тобто сусідні нейрони збуджуються в різних частинах середовища і тому положення тварини може точно бути відображене через колективну активність будь-якої групи нейронів місця.[10]
Енторинальна кора знаходиться на стику, між тришаровою корою гіпокампа та шестишаровим неокортексом, і відсилає головний кірковий вхідний сигнал до зубчатої звивини. ЕК є останнім ступенем, де опрацьовується кіркова інформація перш ніж потрапити до гіпокампової формації. Більшість провідних довгоаксонних (principial) нейронів у ІІ шарі мЕК проявляють лише розряди решіток, будучи позбавленими інших типів просторової модуляції, як то чутливість до напрямку голови,[11] а решіткоподібні розряди нейронів притаманні обом типам провідних нейронів у мЕК ІІ — зіркоподібним та пірамідальним нейронам.[12]
На відміну від нейронів місця в гіпокампі, grid-нейрони в мЕК є активними в множині місць, які утворюють вершини періодичної трикутної матриці або гексагональної решітки, що покриває все просторове середовище перебування тварини[1]. Структура піків (або вузлів) полів розрядів нейронів решіток підкоряється площинній групі симетрії p6m, тобто найбільш симетричній та складній з 17 груп. Характерною рисою цієї групи є обертальна симетрія шостого порядку, що у застосунку до нейронів решітки означає, що повернуті довкола будь-якого вузла на будь-який кут кратний 60°: розряди полів будуть аналогічними до оригінального поля. Кожен вузол решітки оточений шістьма рівновіддаленими вузлами навколо. Розглядаючи вузли як точки в точковій ґратці, ця ґратка може бути описана двояко: або як гексагон, оскільки фундаментальна комірка (полігон) Вороного для двовимірної гексагональної ґратки це гексагон, 2) або як рівносторонній трикутник, оскільки тріангуляція Делоне містить рівносторонні трикутники.[13]
На відміну від гіпокампової просторової карти, групи нейронів в енторинальній корі зберігають внутрішню структуру розрядів їх активності на всіх середовищах. Якщо два grid-нейрони мають однакові вершини в одному середовищі, вони також будуть збуджуватись в аналогічних місцях в іншому середовищі[1]. Тоді як в гіпокампові різні підмножини нейронів активуються в різних середовищах, що свідчить на користь того, що енторинальна мережа містить єдину універсальну для всіх середовищ карту, тоді як гіпокамп містить множину просторових індивідуальних репретезенатцій, призначених для того, щоб включати унікальні властивості та сприйняття всіх можливих просторів, що стали складовою частиною досвіду тварини[14]
Гексагональна форма розрядів нейронів-решіток є одним з найунікальніших прикладів нейронного відтворення зовнішнього світу, що не може бути відстежений в жоден прямий спосіб назад до конкретних форм активації множини сенсорних рецепторів. На відміну від більшості типів нейронів у первинних сенсорних областях кори, найвизначальніші риси решіткоподібних рецепторних полів скоріш за все постають в межах самої ЕК, тим самим являючи собою перший приклад абстрактних обчислень на найвищому рівні кори, який вдалось на сьогодні відкрити та детально дослідити.[8]
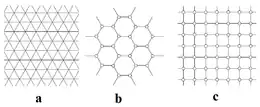
Фундаментальною рисою нейронної організації ссавців є топографічне відображення зовнішнього світу на сенсорні області неокортексу, які організовані в шар із модулів (або колонок) нейронів, що репрезентують схожі риси сенсорних вхідних сигналів[15] Нейронний код, що репрезентує зовнішній двовимірний простір, також міг бути організований через відображення просторових координат на двовимірний шар нейронів кори, де б сусідні просторові місця кодувались сусідніми нейронами. Втім, на противагу такому прямому відображенню структури зовнішнього світу на структуру мозку, енторинальна кора та гіпокамп не мають такої топографічної жорсткої організації.
В гіпокампі та мЕК різні нейрони активізуються в різних місцях таким чином, що разом вони утворюють нейронну карту всіх місць в даному локальному просторі.[3] Ці просторові карти різняться від сенсорних мап тим, що розряди просторових полів постають в результаті внутрішніх механізмів самого нейронного ланцюга мЕК, а не як результат виокремлення певних властивостей із сенсорного сигналу.[16] Але навіть без топографічної організації нейронів, відношення найближчого сусідства все ж можуть зберігатись в синаптичній матриці таким чином, що нейрони із сусідніми полями місця мають сильніші зв'язки між собою, аніж нейрони із віддаленими полями.
Тож, механізм топографічної організації в мЕК може бути зовсім іншим, аніж в сенсорній корі, когнітивнішим та автономнішим від зовнішнього світу[17]
Історія відкриття
Вперше ідею про те, що поведінка тварин у довколишньому середовищі може визначатись картоподібним відображенням простору висунув американський психолог Едвард Толмен, який у 1930-40-х рр. опублікував ряд статей, в яких зробив головне припущення, що тварини навчаються просторовому порядку шляхом формування внутрішніх репрезентацій середовища. Він вважав, що тварини здатні відкривати відношення між місцями та подіями під час вивчення локального середовища, що в решті поступово приводить їх до формування того, що Толмен назвав «когнітивною картою», тобто такою, що будується внутрішньо, через комбінацію просторових сигналів та пам'яті.[18]
Толмен вважав, що картоподібна структура таких репрезентацій дозволяє тваринам вільно переміщатись у середовищі, здійснюючи маневри, змінювати маршрути та шукати коротші шляхи у випадку перешкод. При тому, що складові частини карти на думку Толмена будувались на основі власних знань тварини, спертих на досвід переміщень різними просторами, а не топографічно продубльованих через сенсорні відчуття в центральні кіркові сенсорні системи:[19]
| ...Ми вважаємо, що в процесі навчання в мозку щура постає дещо, подібне на польову карту середовища… Процеси мозку є складнішими та автономнішими, аніж вважають психологи школи «реакція-відповідь»... Нервова система щура є на подив вибірковою щодо зовнішніх сигналів, довільно визначаючи, який з них ввійде в поле зору. По-друге, ми стверджуємо, що ...стимули, яким дозволено потрапити в НС щура, не з'єднані простими перемикачами один в один із реакцією тварини. Скоріш, вхідні сигнали обробляються мозком і формуються в орієнтувальну (tentative), когнітивну карту середовища. І саме ця орієнтувальна карта, що позначає маршрути і шляхи а також просторові співвідношення, врешті решт визначає, якою буде кінцева відповідь тварини[18]
Оригінальний текст (англ.) ...We believe that in the course of learning something like a field map of the environment gets established in the rat's brain... Brain processes are more complicated, more patterned and often, pragmatically speaking, more autonomous than do the stimulus-response psychologists. Although we admit that the rat is bombarded by stimuli, we hold that his nervous system is surprisingly selective as to which of these stimuli it will let in at any given time. Secondly, we assert that ...the stimuli, which are allowed in, are not connected by just simple one-to-one switches to the outgoing responses. Rather, the incoming impulses are usually worked over and elaborated in the central control room into a tentative, cognitive-like map of the environment. And it is this tentative map, indicating routes and paths and environmental relationships, which finally determines what responses, if any, the animal will finally release. |

Такі ідеї Толмена не тільки розривали з панівним тоді біхевіоризмом, але й напрочуд близько наближались до сучасного уявлення про активну природу просторового представлення твариною дійсності, наявність в її мозку спеціальної системи для створення просторової карти власного положення в зовнішньому середовищі.
Ідеї Толмена знову набули актуальності через багато років після його смерті, коли були винайдені та використані мікроелектроди для позаклітинної реєстрації одиничних нейронів у тварині під час поведінкових завдань. Поява цієї техніки дозволила Джеймсу Б. Ранку Мол. (1973)[20] та о’Кіфу з Достровським (1971) вперше моніторити активність окремих нейронів у гіпокампі тварин, що вільно рухаються. Обидві лабораторії знайшли стійкі зв'язки між нейронною активністю та поведінкою тварини, але саме лабораторія о'Кіфа знайшла, що ця нейронна активність залежить від положення тварини в середовищі.
_2014b.jpg.webp)
1971 року, Джон о’Кіф та його студент Джонатан Достровський[9] описали нейрони в гіпокампі щура, що збуджувались кожен раз, коли тварина проходила через певне просторове місце і ніде більше, назвавши їх «нейронами місця» (англ. place cells). Вони виявили, що різні нейрони місця збуджуються в різних просторових місцях («полях місця», англ. place fields). Репрезентація положення в просторі нейронами місця виявилась нетопографічною, оскільки поля місця сусідніх нейронів були не більше схожими між собою, аніж поля місця віддаленіших нейронів. Поєднання активності кількох великих груп нейронів місця було унікальним для кожного положення в середовищі, тому популяція нейронів гіпокампа утворювала картоподібну структуру, що була схожа на «когнітивну карту» Толмена.[21]
Двома найважливішими відкриттями о'Кіфа, які потім просунули відкриття grid-нейронів, було те, що: 1) репрезентація простору в мозку тварини представлена не однією сенсорною ознакою (як запах, зір чи дотик), але поєднанням інформації про дотик, зір, запах та вестибулярно-кінематичні дані в гіпокампі, звідки випливало, що простір в мозку репрезентує абстрактну, когнітивну функцію; 2) Другим важливим відкриттям о'Кіфа було те, що нейрони місця, які складають просторову карту гіпокампа, організовані нетопографічно, на відміну від зору чи запаху, але випадково. Сусідні нейрони гіпокампа не кодують сусідні положення в просторі.[22][23]
Проте вже з перших днів відкриття нейронів місця о'Кіф зрозумів, що просторові карти, сформовані на основі цих нейронів самі по собі є недостатніми для руху тварин у локальному середовищі.[24] Така навігація включає важливі метричні складові, що повинні залежати від здатності нервової системи вимірювати відстань та напрямок руху тварини. Тому о'Кіф та інші дослідники вважали, що метрика просторової карти повинна формуватись поза гіпокампом.[25]
Крім того десятилітні дослідження нейронів місця виявили, що характер їх розрядів може змінюватись та трансформуватись (англ. remapping) у відповідь навіть на незначні зміни сенсорних (колір чи форма середовища) та мотиваційних (винагорода і стимул) вхідних сигналів до гіпокампа, в результаті чого виникали нові поля місця і зникали старі.[26][27] Тож, пошук первинних кодуючих просторові властивості нейронів перейшов на енторіальну кору, з якої гіпокамп отримує свої головні вхідні сигнали з кори.
Вирішальним моментом у пошуку нейронів, що кодують метричну складову когнітивної карти, стало відкриття того, що поля місця зберігаються в гіпокампальній області СА1 навіть після лезії всіх міжгіпокампальних вхідних сигналів до неї.[28] Але оскільки сама по собі область CA1 не має потрібного асоціативного нейронного ланцюга для обчислення сигналу місця, то єдино можливим способом, в який просторова інформація передається до СА1, є прямі контакти з енторіальної кори.[29]
З часів Кахаля було відомо, що енторіальна кора — це головна структура що посилає вхідний сигнал в гіпомкамп із неокортекса, будучи на один синапс вище чи нижче від гіпокампа. Тому нейробіологи почали вивчати детально клітини в цій корі для визначення походження сигналу місця. Нова серія досліджень розпочалась із вивчення дорсальної частини медіальної енторіальної кори (дМЕК), що складає найзначнішу частку в кіркових вхідних сигналах до найчастіше реєстрованої області нейронів місця в гіпокампі.[25]
Станом на початок 1990-х рр. існувало лише декілька досліджень енторіальної активності тварин у вільному русі. Особливо важливим для подальшого вивчення нейронів решітки було дослідження Грегорі Кірка та ін. (1992)[30], у якому автори моніторили активність індивідуальних нейронів у медіальній енторіальній корі під час активної навігації щура в циліндричному середовищі. Дослідники відмітили, як і до них інші лабораторії, що нейрони в мЕК є просторово вибірковими, але вони також знайшли, що поля розрядів цих нейронів значно більші та з більшим шумом, аніж в нейронах гіпокампа і їх паттерни спільної активності не реагували на трансформації середовища, як нейрони місця. Разом з двома іншими дослідженнями[31][32], що виявили подібні розсіяні поля розрядів у мЕК, досліди Кірка припускали, що деякі залежні від місця розряди існують до гіпокампа. Втім, джерелом цих розрядів продовжували вважати сам гіпокамп, а не мЕК.[33][34]

2004 року подружжя Едвард та Мей-Бритт Мозер з колегами в Тронгейм вперше здійснили реєстрацію дорсальної смуги ЕК.[35] Ще в середині 1990-х років Мозер провели деякий час в Британії, навчаючись у Річарда Моріса (Единбурзький університет) та Джона о'Кіфа як аспіранти. Саме тоді вони відкрили для себе світ нейронів місця та навчились реєструвати їх активність у гіпокампі.[36]
Після повернення з Англії до Норвегії, подружжя розпочало власні дослідження нейронів місця у своїй лабораторії в Тронгеймі, намагаючись знайти джерело сигналу нейронів місця. Поворотним моментом у цьому пошуку для Мозер було відкриття, що енторіально-гіпокампова система функціонально організована вздовж дорсовентральної осі.[37] Про що свідчило й те, що ураження дорсальної частини гіпокампа значно більше впливало на навігацію тварини, аніж вентральної частини[38]. На топографічний зв'язок між гіпокампом та енторіальною корою (прямі з'єдання дорсально-вентральних частин)[39][40] Мозерам вказав у середині 1990-х Менно Віттер (англ. Menno Witter), який згодом став їх колегою й автором багатьох спільних досліджень. Відкриття Віттером енторіально-гіпокампової топографічної проекції наштовхнули Мозер на думку, що попередні реєстрації в енторіальній корі не зачіпали ті її області, що мали найсильніші зв'язки із дорсальною частиною гіпокампу, де фіксувалась майже вся активність нейронів місця. Разом із Менно Віттером та ін. Мозер розпочали реєстрацію найдорсальнішої частини медіальної енторіальної кори.[36]
У 2004 році подружжя Мозер, взявши на озброєння техніку, розроблену о'Кіфом для реєстрації потенціалів дії множини нейронів, розпочали вивчення нейронної активності мЕК щура під час вільного руху в локальному середовищі. Підкинувши трохи подрібленого шоколаду до цього середовища, вони змусили щура активно пробігати всю його площу, збираючи крихти. Поки тварина ставала ситою, вона встигала покрити все середовище в коробці, дозволивши ефективно записати та декодувати її нейронну активність.[36]
Ці перші дослідження Мозер виявили нейрони із надзвичайно виразними полями активності. Втім, всім дослідникам на подив, на відміну від нейронів місця, кожен нейрон в дорсальній мЕК мав кілька полів активності та, на відміну від усіх відомих нейронів ЦНС, вони мали унікальну впорядковану організацію, будучи рознесені на оптимально близькій відстані один від одного. Ґрунтуючись на колективній активності близько 10 енторіальних нейронів дослідники змогли реконструювати траєкторію руху щура, тим самим зробивши революційне відкриття, що положення тварини в мЕК може бути представлене з такою ж точністю, як і в нейронах місця розташованих на один синапс нижче в гіпокампі.[35]
Для кращого вивчення цих полів, активність нейронів дМЕК було вивчено в більшому середовищі (2-метровій круглій арені), аніж в традиційних дослідженнях просторової активності нейронів. Саме це дозволило відкрити унікальні властивості нейронів мЕК: поля активності мали форму мозаїчних шестикутних решіток. Такі нейрони, із періодичними полями активності було названо «нейронами решіток» (англ. grid cells)[1].
Результати цих досліджень вказували на мЕК як нову, ключову частину системи мозку, що відповідала за просторове відображення та навігацію. Остаточне підтвердження ролі нейронів мЕК у кодуванні положення тварини в просторі було отримано, коли виявили разючі порушення в просторовій навігації та пам'яті після ураження дорсо-латеральної смуги енторіальної кори.[41] Щурі із лезією мЕК не здатні до обробки просторової інформації, але зберігають здатність до розпізнавання непросторових об'єктів.[42]
Через два роки після відкриття нейронів решітки нові дослідження ЕК виявили, що ці нейрони співлокалізовані з іншими типами нейронів. В проміжних та глибинних шарах ЕК було знайдено великі групи нейронів вибіркових до напрямку голови (англ. head direction cells)[11], що первинно було відкрито в 1985 році у передпідставці гіпокампа (англ. presubiculum) і особливою рисою яких є те, що вони збуджуються лише тоді, коли тварина обернена обличчям в певному напрямку, незалежно від місця перебування тварини.[43] Особливістю відкритих в мЕК нейронів напрямку голови було те, що вони також мали властивості нейронів решітки, активуючись тільки тоді, коли тварина проходила через вершини решітки, тримаючи голову в певному напрямку[11]. Ще через два роки, 2008 р., було виявлено, що ці два типи нейронів співлокалізовані з третім типом нейронів — нейронами границі (border cells)[44] Ці нейрони активізувались лише тоді, коли тварина була біля однієї або кількох границь локального середовища, наприклад, стіни. Коли стіну забирали, то поля розрядів нейронів слідували за стіною, а коли ставили нову стіну чи перегородку, виникало нове поле розряду вздовж стіни[45]
2014 року, рівно через 10 років по відкриттю нейронів решітки, Джон о'Кіф та подружжя Мозер отримали Нобелівську премію з медицини та фізіології «за відкриття системи нейронів у мозку, які дозволяють орієнтуватись в просторі».
Властивості grid-нейронів
Повторюваною одиницею решітки є рівносторонній трикутник, або, точніше, два трикутники з протилежною орієнтацією. Поєднання шістьох таких трикутників дає правильний шестикутник. Як було виявлено в першому дослідженні нейронів решітки, додаткові гексагони з рівновіддаленими піками розрядів формувались в кількох місцях поряд з найближчим гексагоном, що означало, що гексагональний паттерн зберігав свою періодичність у всьому середовищі. Кутова відстань вершин внутрішнього гексагону кратна 60°[1].
Проте на рівні одиничного нейрона, індивідуальні поля розрядів є нерозрізнюваними, тому для кодування простору в мЕК має значення популяція нейронів решітки, а не один нейрон, наділяючи мЕК новим, порівняно із сенсорно-руховим, популяційним кодом. Електричний розряд одиничного нейрона решіток сам по собі не є інформативним і якщо його буде «читати» популяція вищепоставлених нейронів, то через нього неможливо визначити положення тварини в просторі, оскільки характер розрядів показує, що вона може знаходитись в будь-якому із цілого діапазону місць, без визначення в якому саме. Тому точна оцінка положення тварини можлива лише через взяття до уваги властивостей сусідніх нейронів решітки, кожен з яких характеризується через регулярну решітку місць в яких даний нейрон активується[46].
Впорядковані поля нейронів решіток можуть спостерігатись одразу, коли тварина починає рухатись в новому середовищі, зберігаючи притаманну їм структуру решітки навіть коли вилучити всі зовнішні сенсорні сигнали із середовища і навіть у темряві, що свідчить на користь того, що інформація отримана із власного саморуху тварини активно використовується нейронами решітки для відстежування її положення в навколишньому середовищі[2]. Цей процес, відомий як інтеграція шляху, може забезпечувати просторову карту метричною складовою.
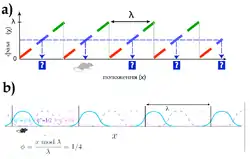
Коли тварина прямує до центру поля розряду нейрона решітки, частота спайків збільшується, в такий спосіб кодуючи просторове положення через частотний код (англ. rate code). Разом з тим, спайки в нейронах мЕК ІІ з'являються на послідовно ранніх фазах позаклітинних осциляцій в тета діапазоні частот (5-12 Гц) протягом перетину твариною поля решітки.[47][48] Це обумовлює існування поряд з частотним кодом незалежного від нього темпорального коду, в якому величина фазової прецесії передає положення тварини точніше, аніж спайковий частотний код[46]. Стійкість фазової прецесії в нейронах решітки до інактивації гіпокампа означає, що мЕК може керувати фазовою прецесією в гіпокампі.[48]
Нейрони решіток у своїй більшості є ненаправленими, тобто частоти розрядів не залежать від напрямку тварини, коли вона проходить через вершини решітки. Частота розрядів на різних вершинах решітки також характеризується значною варіацією: на деяких вершинах частота перевершувала 30 Гц, на інших можуть спостерігатись лише кілька розкиданих спайків.[35] Варіюються в нейронів решітки також різні степені асиметрії, а періодичність може бути виражена сильніше уздовж однієї осі трикутної решітки, аніж двох інших[49][50]
Крім того, як показали ранні дослідження нейронів решітки, між просторовими кодами мЕК та гіпокампа існує суттєва різниця у стабільності рецепторних полів. Поля нейронів місця в гіпокампі трохи стабільніші під час досліджень в різних середовищах, тоді як в мЕК спостерігалась поява нових та зміщених полів решітки. Це може свідчити про більшу роль гіпокампа у зберіганні та відновленні доцентрової інформації, оскільки навіть незначні коливання відновлюваних сигналів у середовищі не перешкоджають гіпокампу відновити інформацію. Тому, на відміну від мЕК, гіпокамп більше залучений не до обробки інформації про положення в просторі, а до трансформації просторових та непросторових сенсорних сигналів у стійкі репрезентації, що легко можуть згодом відновитись не зважаючи на зміни у зовнішньому середовищі.[35]

Головні параметри, за якими різняться клітини-решітки одна від одної, є: інтервал (відстань між полями її розрядів), орієнтація (кут повороту решітки відносно осі координат) та фаза (наскільки решітка переноситься, зміщується відносно зовнішньої точки відліку)
Інтервал
Інтервал нейронів решітки визначається типовою мінімальною відстанню між центрами 2-х послідовних полів решітки. Інтервал між нейронами решітки є функцією реєстрованої глибини, або дорсовентральної позиції, в межах ЕК.[35] Інтервал поля решітки розширений вздовж дорсовентральних осей мЕК. Нейрони, які реєструвались дослідниками дорсально, зазвичай мали мінімальний розмір інтервалу решітки ~30 см в щурів, тоді як в нейронів, реєстрованих вентральніше, інтервал зазвичай зростав принаймні в двічі. У дослідженні щурів, що бігли вздовж лінійної траси, було виявлено, що інтервал між послідовними полями решітки може досягати до 3 м і більше.[51] Тож схоже, що нейрони решітки кодують просторові масштаби з різною роздільною здатністю: нейрони в дорсальному кінці мЕК кодують менші простори з точною роздільністю, тоді як нейрони у вентральному кінці мЕК кодують більші простори з грубозернистою роздільністю.
Фаза
Фаза решітки нейронів ЕК — це х-у положення вершин їх розрядів. Фаза решітки може бути визначена через положення одного піка розряду нейрона [x0, y0]. На відміну від інтервалу решітки, який слідує анатомічному градієнту, фазова різниця між двома нейронами решітки не має жодних очевидних анатомічних корелятів[1]. Нейрони решітки із однаковим інтервалом але різними просторовими фазами можуть бути реєстровані в тому самому місці в мЕК. Різниця фаз переноситься між середовищами: два нейрони решітки схожого масштабу із малою фазовою різницею між ними в одному середовищі збережуть малу фазову різницю коли щур переміститься в інше середовище; тоді як два нейрони решітки із більшою фазовою різницею в одному середовищі збережуть більшу фазову різницю в ін. середовищі.[52]

Орієнтація
Нейрони решітки з однаковим інтервалом частіше мають майже ідентичну орієнтацію решітки в межах того ж самого середовища. Тоді як нейрони решітки з різними інтервалами часто різняться орієнтацією решітки і нейрони решітки з різними значеннями інтервалів решітки мають тенденцію до збереження їх різниці орієнтування, коли щур переміщується з одного середовища в інше. Орієнтація клітин решітки визначається головним чином геометрією коробки і є відносно незмінною між щурами. А різні тварини часто характеризуються подібними орієнтаціями решіток нейронів мЕК в межах одного і того ж локального середовища.[17]
Розмір поля розрядів
Інтервал між різними центрами поля решітки не обов'язково обумовлює розмір єдиного поля решітки. Тому, теоретично, можуть існувати нейрони-решітки з великим інтервалом і малими полями, або нейрони із малими інтервалами та великими полями. Втім, із експериментальних досліджень випливає, що існує деяке відношення між розміром решітки і розміром поля відповідно до якого, більший інтервал решітки зумовлює більший розмір поля[1][53], хоча ця проблема не вивчалась окремо детальніше.
Еліптичність
Хоча решітки зазвичай ізотропні, як показало нещодавнє дослідження, нейрони решітки можуть мати анізотропний інтервал вздовж їх трьох осей орієнтації, що обумовлює певну «еліптичність» форми решітки.[17] Ексцентриситет еліпса решітки може змінюватись від 1 (повністю ізотропна решітка) до анізотропніших значень. Подібна анізотропність решіток може бути використана для визначення приналежності нейронів-решіток до різних модулів.
В цілому, всі ці властивості нейронів решітки, на відміну від нейронів місця, дозволяють групі grid-нейронів зберігати стійке просторове співвідношення. Просторове співвідношення між решітками нейронів в одній і тій же частині ЕК залишаються незмінними для різних середовищ настільки, що якщо вершини решітки двох нейронів зміщуються на 10 см в одній дослідній кімнаті, вони також будуть зміщеними на 10 см в суміжній кімнаті. Так само ці нейрони будуть обертатись на однакову величину між двома середовищами[1]. Хоча таке жорстке просторове співвідношення між співлокалізованими нейронами решітки робить їх мережу малоінформативною про саме середовище і оточення тварини, воно втім дозволяє мережі нейронів решіток відображати точну метричну інформацію про положення тварини відносно точок відліку в зовнішньому середовищі.[54]

Сталість інтервалу, розміру поля та орієнтації решіток у сусідніх нейронах припускає, що поєднання активних нейронів повторюється регулярно, коли тварина рухається по поверхні. Якщо початок положення зберігається, то повторювана, циклічно організована карта може бути достатньою для сигналізування положення у середовищах будь-якого розміру.[1][56]
Втім, ідея про роль нейронів решітки як внутрішньої метрики для простору не цілком узгоджується із дослідами, оскільки масштаб сітки решітки може змінюватись з часом. І хоча паттерни решіток можуть мати однаковий масштаб у середовищах із різними фізичними властивостями, вони можуть деформуватись тоді коли щурі, які були спочатку навчені в квадратній коробці, потім переміщаються в прямокутну з тим самим середовищем, або переміщуються між однаковими по формі коробками в кімнатах з різними конфігураціями зовнішніх сигналів.[49] Тоді решітки змінюють масштаб (розширюються або звужуються), хоча і не так сильно, як змінюється саме середовище. Проте, якщо тварини вже були в коробках з іншою формою, повторне їх поміщення в подібну коробку ніяким чином не позначається на зміні масштабу решітки нейронів[1]. Тож, подібне повернення (хоч і повільне та може тривати кілька днів) решітки до сталої форми протягом тривалого тренування означає, що система має незмінний внутрішній масштаб решітки, по відношенню до якого коригуються зміни решіток у середовищах із різною формою оточення.
Отже, просторова карта нейронів решітки така ж динамічна, як і ті середовища, в яких знаходиться тварина. Причиною цього є те, що її формування пов'язане із рухом тварини в даному просторі[2]. Така динамічна зміна активності решіток у відповідності з рухом тварин потребує, щоб нейрони мЕК мали доступ до сенсорних сигналів, що відповідають зміні положень тварини у просторі. Однак лише кілька типів сенсорних вхідних сигналів є достатньо неперервними та стабільними, аби уможливити плавне перенесення відображень решітки. До таких сигналів входять пропріоцептивні та кінематичні зворотні зв'язки, вестибулярні сигнали та оптичний потік.[52] Первинність сигналів саморуху і вторинність сигналів від стаціонарних ознак підтверджується тим, що нейрони решітки зберігають гексагональний характер їх розрядів навіть після вилучення візуальних та нюхових орієнтирів[1].
З іншого боку, класичні дослідження нейронів решіток проводились на щурах у простому квадратному середовищі, але в природі тварини знаходяться в складніших та неоднорідніших умовах. Дослідження нейронної активності щурів в U-лабіринті, який складався зі сполучених коридорів та мав форму зигзагу, де тварина бігла з одного кінця до іншого, показало, що решітка втрачала свою гексагональну структуру призводячи до утворення окремих фрагментів паттернів розрядів решітки зі своїми періодичними паттернами.[57] Подібне розбиття решітки залежало від геометрії середовища і не спостерігалось, коли щур пробігав зигзаг у відкритому середовищі без стін. Так фрагментація структури решітки у розділених на комірки середовищах припускає, що мЕК кодує простір через сукупність регулярних суб-карт, що, у свою чергу, вказує на те, що тварина може репрезентувати зовнішнє просторове середовище через багатовид швидко взаємодіючих карт, де кожна секція середовища має свою власну репрезентацію,[58] як передбачали ще перші теорії формування просторових карт у гіпокампі.[59] Фіксована прив'язаність індивідуальних координат цих суб-карт до зовнішнього світу може здійснюватись через орієнтири та сигнали, що зберігаються в гіпокампові, а трансформація між координатами може здійснюватись через обчислення в межах енторіально-гіпокампового ланцюга[2][58].
Модульна організація

Внутрішня метрика притаманна нейронам решітки, разом з їх інваріантністю в різних середовищах, свідчить про те, що значна частина просторової когнітивної карти, яку в 1978 році О'Кіф і Надель[21] приписували виключно гіпокампу, знаходиться в мЕК. Когнітивна карта в гіпокампі це все ще когнітивний конструкт, а не сама карта. Нейрони місця насправді відображають не будь-який сигнал середовища, але скоріш сприйняття твариною її місця в середовищі.[56] Лише мЕК з її унікальним, нередукованим до сенсорних сигналів, кодом решітки є продуктом внутрішньої активності локальних нейронних ланцюгів, популяції grid-нейронів, що надають просторовому середовищу впорядковані форми репрезентації.
Картоподібна природа репрезентації простору енторіальними решітками підтримується поміж іншого їхньою точною анатомічною організацією, що нагадує модулярну організацію типів нейронів у сенсорних системах.[15]
Про модульну організацію нейронів решітки в ЕК свідчать кілька факторів. Одна архітектонічна риса, котра свідчить про модульність решіток в ЕК це періодичність комплектації дендритів та аксонів пірамідальних нейронів.[61]
Іншим свідченням модулярної організації в мЕК є те, що нейрони решітки в одній і тій же частині мЕК мають схожі інтервали та орієнтацію решіток, тобто організовані топографічно. Інтервал решітки збільшується строго і майже лінійно від дорсальної до вентральної смуг мЕК,[1][51] що дзеркально відображується у збільшенні розміру полів нейронів місця в дорсовентральних осях гіпокампа.[62] Модулі з нейронами із малими інтервалами решітки переважають саме в дорсальній частині мЕК. Коли ж реєструвальні електроди переміщали у вентральнішому напрямку, то послідовно поставали більші решітки. Однак, майже ніяких градієнтів не було виявлено в медіалатеральному напрямку, що вказує на те, що модулі організовані в горизонтальні смуги, паралельні до дорсальних меж мЕК.[17]
Існує деяке анатомічне перекриття (особливо вентральніших місць мЕК) між модулями: нейрони решітки із двох модулів з різними інтервалами (довжиною хвилі) можуть реєструватися одночасно в одному й тому ж анатомічному місці.[63] Це припускає, що модулі решіток швидше за все «сплетені» між собою, на відміну від більш градуйованої топографії репрезентативних карт первинної кори більшості сенсорних систем.[64]
Проте, на відміну від інтервалів, фази паттернів решітки не мають очевидної крупномасштабної топографічної організації — поля нейронної активності співлокалізованих нейронів випадково зміщені одне відносно одного[1] подібно до полів сусідніх нейронів місць у гіпокампі.[24][65] Розподіл фаз решітки схожий до розкиданої, або як «сіль-і-перець» (коли нейрони налаштовані на орієнтацію стимулу, але не мають ніякого особливого порядку в своєму розташуванні, як у зоровій корі), організації властивостей реакцій у деяких сенсорних областях кори, як то репрезентація запаху в грушоподібній корі[66] або карти орієнтації у зоровій корі щурів[67]
Також, на відміну від паттерна решітки нейрону, просторова фаза і орієнтація решітки визначаються властивостями середовища, його орієнтирами та геометричними межами: коли помітні орієнтири обертаються в колоподібному середовищі, решітки обертаються разом із цими орієнтирами; коли добре знайома тварині квадратна чи прямокутна огорожа змінюється через її розтягнення в одному напрямку, решітка нейронів також параметрично розширюється в тому самому напрямку, тоді як інтервали решітки залишаються незмінними в ортогональному напрямку.[49] При тому, що одна і та ж тварина може мати одночасно більше ніж одну орієнтацію решітки[50], і дискретність в орієнтації решітки в різних модулях збігається з дискретністю масштабів решітки.[4][17]
Часто помітною є також зміна масштабу решітки поблизу границь середовища в якому рухається тварина, що проявляється в менш правильному впорядкуванні інтервалу та орієнтації решітки біля периферії коробки, аніж в будь-якій іншій її точці[1].
На основі багатьох досліджень поведінки щурів та їх нейронної активності в різних середовищах, можна зробити висновок що в мозку однієї тварини нейрони решітки в ЕК можуть групуватись в 4 або 5 модулів у такий спосіб, що масштаб решітки збільшується дискретно між одним та наступним модулем в тій самій тварині.[8]
Різні модулі решіток можуть мати різні ступені розширення та скорочення решітки, що свідчить про те, що вони здатні діяти незалежно один від одного. Зміна масштабів решітки збігається не тільки зі змінами в орієнтації, але також із відмінностями в еліптичній деформації решітки, як і в варіації тета-частотної модуляції нейронів решітки. Більше того, коли експериментальне середовище стискається, трансформуючи відому щуру квадратну коробку в прямокутну, нейрони в різних модулях мЕК можуть реагувати незалежно. Після такої трансформації коробки, нейрони решітки в найменшому модулі не виявляють ніякої реорганізації, тоді як всі нейрони в більших модулях цілком змінюють масштабування, зберігаючи первинну кількість полів решітки в напрямку стиснення коробки з найменшими відстанями між полями розрядів.[17]. Це може пояснюватись тим, що модулі решіток можуть діяти незалежно один від одного у відповідь на зовнішні сигнали, хоча й всі нейрони решітки в межах одного модуля й змінюються синхронно. Функціональний зв'язок нейронів решітки в межах модулів та їх відокремленість від нейронів решіток в інших модулях може означати, що мережі решіток складаються із анатомічно перекривних підмножин мереж, що характеризуються сильним внутрішнім зчепленням, але слабким з'єднанням з іншими підмережами.[8]
Автономія модулів решіток, разом із дискретною топографією карти решіток, суттєво відрізняється від класичних карт із градуйованою топографією для неперервних змінних в сенсорних системах (наприклад, карти орієнтацій та напрямків зорової кори),[15][64][68][69] припускаючи, що модульність карти решіток є результатом локальної самоорганізації динаміки мережі grid-нейронів, а не зовнішнього впливу.[17]
Однак, подібна автономність модулів решіток, за наявності внутрішньо притаманного нейронним мережам шуму та, як наслідок, поява помилок в кодуванні можуть приводити до поступового дрейфу та зміщення в межах модулів нейронних решіток, що врешті позначиться на точності відображення положення тварини в просторі. Ця проблема особливо значуща, коли немає помітних сенсорних сигналів у середовищі, адже тоді фази в різних модулях можуть дрейфувати незалежно одна від одної, не маючи можливості без таких сигналів синхронно оновлюватись.[70] Подібний незалежний дрейф фаз у модулях досить швидко призведе до такого їхнього поєднання, що не відповідатиме жодному положенню в локальному середовищі тварини.[71]
Одним із можливих механізмів, що може використовувати нейронна система ЕК для вирішення цієї проблеми, є поєднання модулів між собою, що б унеможливило їхній незалежний дрейф і таким чином нівелювало можливість появи незалежних нейронних шумів, які б викривляли точність відображення положення тварини в просторі. Таке поєднання може бути здійснене, наприклад, через зворотній зв'язок від нейронів місця в гіпокампі,[71] або через внутрішню синаптичну єдність в межах самої мЕК. Вхідні сигнали з гіпокампа в мЕК також можуть оновлювати просторове представлення нейронами решіток на основі сенсорних даних та виправляти великі помилки в індивідуальних фазах модулів.[72] У цілому, поєднання модулів нейронів решіток через гіпокамп здатне суттєво стабілізувати їхнє просторове кодування, зберігаючи за кодом решіток унікальну, експоненційно велику інформаційну ємність.[73]
Grid-нейронний код
Неочікувана та неповторна геометрична природа нейронів решітки в мЕК породила ряд питань щодо природи інформації, яку ці нейрони кодують і те, як вони її кодують: Що нейрони решітки кодують і чому саме така, а не інша форма кодування? Що робить grid-код ефективним для навігації в середовищі та обчислення положення тварини в ньому? Які властивості роблять код решіток корисним для нижчих нейронів?
Особливістю розрядів нейронів решітки є те, що вони постають як більш інваріантне відображення простору, аніж розряди нейронів місця: вони не залежать від шляху, напрямку чи шляху тварини, як і від її контексту. Ці інваріантності припускають, що нейрони решітки можуть формувати основу абстрактної, універсальної репрезентації місцеположення в просторі. Хоча з точки зору нейронного кодування, grid-код наводить на питання, чому змінна (положення у двовимірному просторі), яка повністю може бути описана всього двома числами або координатами, розбита мозком на множину періодично оформлених репрезентацій, використовуючи понад 100 тис. нейронів.[54]
Фазовий код
Точну інформаційну ємність коду нейронів решітки можна оцінити, якщо скористатись модульною арифметикою і трактувати мережу решіток, як двовимірний еквівалент оператора по модулю. За цією схемою положення щура може бути представлене як множина фаз (або остач), обчислюваних через ділення по модулю фіксованої множини періодів ґратки.[73]
З ранніх досліджень grid-нейронів відомо, що сусідні нейрони в мЕК мають спільний період ґратки (λ) та орієнтацію, але різняться їхньою відносною просторовою фазою[1]. Тоді поточне положення щура може бути точно представлене як фаза — аж до (mod, по модулю) всіх можливих періодичних зміщень ґратки. Наслідком дорсо-вентрального зростання періодів ґратки (решітки) є існування в мЕК суб-популяції з різними періодами, в діапазоні від 30 до 70 см, тому нейрони в мЕК можуть розкладати 2-D вектор поточного положення щура на множину 2-D періодичних змінних, або фаз, по модулю множини періодів ґратки , вздовж двох незалежних напрямків ґратки і тоді інформація з однієї ґратки дозволяє локалізувати щура по модулю цього періоду ґратки.[74]
В 1-D аналогові мЕК, для спрощення аналізу, активна підгрупа в межах кожної популяції ґратки репрезентує 1-D фазу якщо де x — це внутрішня оцінка щурем положення в просторі, а — період ґратки . Символ mod означає операцію по модулю, що є остачею від цілочисельного ділення на . Оскільки існує різних популяцій з різними періодами ґратки (), кожне місцезнаходження щура може бути представлене в мЕК через множину фаз , що можуть бути прочитані вищепоставленими нейронами як відмітні ознаки активної підгрупи в межах кожної ґратки.[74]
Аналогом приписуваної таким чином мЕК репрезентації величини через множину остач (фаз), отриманих після ділення по модулю із фіксованою множиною модулів (періодів ґратки), є незвична, але добре відома непозиційна система числення для представлення чисел — так звана числова система залишків (ЧСЗ).[75]
Якщо, з метою спрощення, припустити, що мЕК не має інших функцій, окрім вказаних репрезентацій по модулю і без відношення до можливого зчитування чи декодування мЕК-коду, то постає питання, чи є множина фаз достатньою для однозначного визначення положення щура x і для якого діапазону. Тобто, яка інформаційна ємність коду решіток з точки зору фазового коду. В ідеалізованій ситуації, де положення x та періоди ґратки обмежені до цілих чисел, для виявлення ємності коду нейронів решіток, можна використати китайську теорему залишків (КТЗ), на якій ґрунтується ЧСЗ. З допомогою КТЗ можна довести, що модулярна репрезентація із відносно малою кількістю модулів (періодів ґратки) здатна однозначно визначити вхідне число (місцеположення) для великого діапазону в середовищі.[73][76]
До прикладу, для простої системи із модулями або періодами, і , коли поступово збільшується від , то неодноразово циклічно проходить через значення , а — через . Починаючи в , де , значення двох фаз , розглядуваних в парі, не повторюються аж до , добутку 3 × 4, де знову :
Така проста система із може репрезентувати 12 різних місцезнаходжень в просторі.[73]
В цілому, для будь-якої кількості N ґраток, якщо та — цілі числа, КТЗ передбачає, що загальний діапазон [0, D] будь-яких положень в просторі, які фази по модулю можуть репрезентувати, є найменшим спільним кратним (НСК, або англ. LCM) всіх різних періодів:
Друга рівність виконується, якщо періоди ґратки є взаємно-простими числами. До прикладу, для множини п'яти модулів , будь-яке число в 0 — 1 007 759 однозначно визначене через його остачі або фази: 1 000 000 можна репрезентувати через фази . А якщо, як в мЕК, всі періоди ґратки мають однакову величину (), тоді загальна інформаційна ємність системи пропорційна . Тож, ємність збільшується комбінаторно з кількістю різних періодів і тому ефективність кодування числа (положення в просторі) як множини фаз або арифметичних остач по модулю настільки ж висока, як і зберігання її в будь-якій іншій числовій системі з основою b, де розмір найбільшого кодованого числа () також росте експоненційно із числом N регістрів.[71][73]
Більшість із відомих популяційних кодів (багато нейронів, які разом кодують дану змінну) у сенсорно-руховій та когнітивній областях уможливлюють лише незначне поліпшення у кодуванні аналогової змінної як функції від кількості нейронів (N): квадратичне відхилення зменшується в найкращому випадку як 1/N. Тоді як точність репрезентації (як і зменшення помилки) нейронів решітки збільшується із N не поліноміально, а експоненційно: об'єднаний код популяції нейронів решітки з усіма фазами може однозначно репрезентувати експоненційно великі діапазони із лінійно більшою кількістю нейронів при постійній абсолютній роздільній здатності.[71]
При певних припущеннях, максимальна інформаційна ємність коду отримується, коли комбіновані масштаби не мають спільних множників, тобто коли відношення масштабів решітки утворює послідовність простих чисел[73], припускаючи, що ємність мережі решіток є комбінаторною і тому зростає непропорційно із додаванням одиниць із різними масштабами[70]
Разом з тим, роздільна здатність grid-нейронного коду суттєво обумовлена найнижчим інтервалом решітки, що приблизно рівний 30 см в щурів[51], хоча менш відомо, як ємність коду залежить від точних інтервалів та орієнтацій решітки. Якщо відношення між послідовними інтервалами у щурів рівне , тоді багато інтервалів є цілими кратними один одного, що в 1D суттєво обмежить ємність нейронного коду решіток.[73] Проте, невелике відхилення від цього відношення буде достатнім для відновлення великої ємності коду. Більше того, у 2D ємність коду залежить також від відносних орієнтацій решітки в різних модулях. Але навіть якщо grid-нейронний код у щурів може відображати експоненційно великий діапазон положень відносно максимального інтервалу решітки (~10м[51]), невідомо, чи їх мозок повністю використовує таку велику ємність коду.
Окрім високої інформаційної ємності, код по модулю, на відміну від інших числових систем, має ще кілька корисних властивостей для кодування та оновлення положення в мЕК, що дозволяють припустити про його можливу нейробіологічну перевагу та застосовність.[74]
- Множина регістрів у ЧСЗ, які лежать в основі її величезної комбінаторної ємності, може бути розміщена дуже близько, охоплюючи вузький діапазон — всі модулі можуть бути майже рівними, з однаковою величиною. Оскільки для формування ґраток, що могли б охопити діапазон великих розмірів не може існувати параметрів у нейронній мережі, що охоплювала б такий самий діапазон, то модульна (фазова) система уможливлює як завгодно великий динамічний діапазон (із відповідною кількістю решіток) при вузькому динамічному діапазоні в параметрах мЕК мережі. Наслідком цього є те, що в модульній системі різні періоди розподіляють між собою інформацію про положення тварини порівно — інформація із усіх масштабів наявна в кожній решітці.
- Операції додавання, віднімання та множення в модульній системі ЧСЗ здійснюються цілком паралельно, оскільки тут не потрібно переносу інформації з одного регістра в інший: сума двох чисел є сумою по модулю їх остач (фаз), обчислювальних незалежно для кожного регістра або решітки. Щур у вільному русі, використовуючи ЧСЗ може оновлювати свою оцінку положення в просторі через незалежно зростаючі фази кожної решітки, без необхідності перенесення інформації циклічного повернення фази з однієї решітки на іншу. Тож, хоча позиційна інформація розподілена по ґратках, для оновлення положення в просторі не потрібно ніякої координації (і, відповідно, ніякої рекурентної обробки інформації) між ґратками. Ця властивість коду решіток свідчить про те, що репрезентація простору в мЕК підходить для додавання зростаючих сигналів руху тварини щоб оновлювати її положення, тим самим роблячи мЕК місцем ідеоцентричної інтеграції шляху в мозку.
Однак, ряд суттєвих рис нейронного коду в мЕК різняться від ЧСЗ. Періоди ґраток в мЕК не є, скоріш за все, взаємно-простими цілими числами, але дійсними числами, як і положення щура в просторі. Також, на відміну від ЧСЗ, де число остач (окремих фаз або фазової роздільності) росте із розміром модулю (періодом ґратки), фазова роздільна здатність в мЕК скоріш за все є сталою серед ґраток. Через ці причини, існуючі точні формули для реконструкції чисел із їх остач використовуючи КТЗ більше не підходять, і тоді репрезентативна ємність коду решіток може бути значно нижча, аніж в ЧСЗ. Втім, незважаючи на ці відмінності, операція додавання і множення залишаються цілковито паралельними, а інформаційна ємність продовжує зростати експоненційно із числом (не взаємно-простих) ґраток, покриваючи великий діапазон дійсних положень із високою роздільною здатністю. Однозначність цієї репрезентації є гарантією того, що зворотне відображення із фаз решітки на положення все ще зберігається.[73]
Використання такого фазового коду для вираження мережі нейронів решітки дозволяє теоретично передбачити, що grid-код є значно ефективнішим, аніж код нейронів місця, оскільки він дозволяє невеликій кількості нейронів кодувати більший обсяг простору.[74] Із кодом по модулю мережа ґраток може однозначно репрезентувати 2 км простору в середовищі із 6 см роздільною здатністю в кожному лінійному розмірі[73], площа як узгоджується із діапазоном пошуку їжі щуром[77] Тоді як код місця нейронної мережі гіпокампа може покривати максимально діапазон 20 м простору в середовищі.
Код вкладених відрізків
Нейронна репрезентація положення у світі, в силу притаманного шуму та спайкової активності нейронів, завжди піддається викривленню справжнього місцезнаходження, тим самим обмежуючи ту роздільну здатність, якої потребує тварина для орієнтування та навігації. Відтак, для того, щоб зрозуміти природу коду решітки, слід брати до уваги динамічність та мінливість його нейронних корелятів, що модель коду по модулю оминула, створивши більш ідеальний код, аніж нейрони решітки мають в реальності. Для вирішення цієї проблеми і пояснення, як тварина репрезентує простір через наближеніші до реальності нейронні властивості, була запропонована ширша та складніша модель нейрону решіток — так званий «код вкладених відрізків».
За схемою коду вкладених відрізків, просторові періоди покривають широкий діапазон, ефективно ділячи простір середовища. Базовою одиницею цього коду є модуль — популяція нейронів решітки, які мають однакову ґратку, але просторово зміщені та репрезентують різні (просторові) фази. Для одиничного модулю ключовим параметром у покращенні просторової роздільної здатності вкладений код припускає просторовий період ґратки. Щоб модуль мав малий просторовий період, як умова винятково точної репрезентації зовнішнього простору, неоднозначність одиничного модуля повинна бути знята іншим модулем. Найкраще це можна зробити, якщо код організований як вкладені відрізки, що передбачає послідовне збільшення розмірів решітки в різних модулях, тобто наявність множини масштабів у нейронів решітки[78].
Формально, у схемі коду «вкладених відрізків» популяція N нейронів ділиться на L підгруп нейронів, чиї криві частотної налаштованості (англ. tuning curves) є періодичними на тій самій довжині шкали — просторовий період решітки. Кожна така підгрупа формує модуль. Діапазон стимулів, які подібний вкладений код може репрезентувати, такий же за розмірами, як і довжина найбільшого масштабу ґратки , або навіть більший. Але для простоти, припускається, що . В межах «коду вкладених відрізків» просторові періоди решіток впорядковані як і для кожного існують М нейронів решітки, що розподіляють між собою цей просторовий період, але мають зміщені одна відносно іншої ґратки. Тоді М нейронів репрезентуватимуть рівновіддалені фази із {0, 1…M-1} Така решітка у вкладеному коді точно і ефективно, крок за кроком, кодуватиме місця, менші ніж . Модуль 1 надає тільки грубу інформацію про місцезнаходження (із роздільністю ); модуль 2, хоча сам по собі і грубий в межах діапазону, збільшує роздільність в межах кожного під-відрізку із М з довжиною ; так само модуль 3 додає ще точнішої роздільності і т. д. По індукції таким чином, всі модулі повинні мати вкладені просторові періоди, коли кожен модуль далі ділить період попереднього[78][79].
Така схема коду вкладок схожа на роботу аналогового годинника: протягом 12-годинного проміжку, стрілки хвилин і секунд самі по собі не точні. І хоча стрілка годин, в принципі, може кодувати час доби з мікро-секундною точністю, існує межа для кутової роздільної здатності людського ока, де комбінацію всіх стрілок можна легко розібрати. Подібно до цього і код вкладених відрізків може кодувати місця із високою точністю, хоча самі окремі модулі позбавлені або просторової точності, або широти просторового діапазону.[80]
Вкладеність просторових періодів уможливлює найвищу, як для стохастичних нейронів решітки, роздільну здатність у репрезентації місцезнаходження і дотримується унікальної властивості масштабування: роздільна здатність збільшується експоненційно із числом нейронів N. Такий grid-код із множиною просторових масштабів перевершує популяцію нейронів місця із просторово локалізованим розрядом, що збільшується лише лінійно із числом нейронів. Оскільки, як показав теоретичний аналіз, якщо роздільна здатність коду нейронів місця оптимізується популяцією нейронів із сталими розмірами, то для нейронів решітки різні просторові масштаби гексагональних ґраток кардинальним чином покращують точність кодування місця. Тож навіть для невеликого розміру популяції нейронів, вкладений код надає суттєво більшу роздільну здатність, аніж код нейронів місця[81][78].
Той факт, що найбільший просторовий період у схемі вкладеного коду має довжину масштабу кодованої області, дозволяє зробити кілька корисних передбачень. Зокрема, актуальний діапазон навігаційної поведінки тварини повинен бути приблизно рівним найбільшому просторовому періоду . Також схема вкладеного коду передбачає, що для повноцінного використання коду решіток, та всі інші просторові періоди мають бути адаптовані до локального середовища тварини, який є для неї в дану мить актуальним. В цілому, схема вкладеного коду передбачає, що просторові періоди нейронів решітки згруповуються в множинні дискретні групи і повинні утворювати геометричну прогресію . З цього випливає, що серед нейронів решіток має бути більше малих просторових періодів, аніж великих[81].
Оскільки збільшення масштабу решітки не є неперервним і існує чітка шкала відношень між модулями,[17] в яких масштаб решітки збільшується (зберігаючи роздільну здатність та максимальний інтервал решітки) від одного модуля до іншого в геометричній прогресії, — в середньому на ~1,4 або ≈1,65 у 2D, тобто в достатньо доброму наближенні до відношення між простими числами 5 і 3.[82] Якщо ці припущення виконані, то із 8-10 різними масштабами решітки, мЕК спроможна однозначно локалізувати тварину з точністю кількох сантиметрів у площі в кілька квадратних кілометрів, тим самим маючи значно більшу ємність коду, аніж може бути досягнута із тією самою кількістю нейронів місця.[73]
При такому геометричному співвідношенні між модулями кількість кодуючих нейронів решітки в модулі зменшується, що узгоджується із даними, отриманими експериментально.[17] Чисельний аналіз передбачає, що подібна організація може бути оптимальною для отримання максимальної просторової деталізації середовища від мінімальної кількості нейронів решітки[78]. Із вкладеного коду випливає, що навіть із нейронами решітки, з притаманним їм шумом та спайковою варіативністю, нейронів у мЕК зможуть закодувати положення тварини в просторі з винятковою точністю. Існування такої нейронної системи в ЕК, що максимізує інформацію із обмеженого набору нейронів, схоже на баланс між кількістю ON і OFF нейронів у сітківці ока, який узгоджується із статистичною структурою загальних візуальних сцен.[83][84]
Отже, для досягнення високої роздільної здатності в межах модулярного коду нейронів решітки, ґратки решітки мають формувати геометричну прогресію в просторових періодах і кожен модуль має бути самоподібним. Втім, на відміну від інших схем кодування нейронами решітки, в схемі вкладеного коду запорукою великої роздільної здатності та переваги нейронів решітки над нейронами місця є не зміни в кривих налаштування, піках частоти розрядів, і навіть не періодичність, а вкладеність, тобто існування множини відмінних масштабів. Оскільки у вкладеному коді піки розрядів можуть бути розподілені між різними нейронами одного модуля, тим самим руйнуючи періодичність структури решітки, і все ж зберігаючи притаманну їм високу комбінаторну роздільну здатність[78][79]. Саме тому вкладений код відрізків більше узгоджується з накопиченими емпіричними даними і є стійким до еліптичної деформації та навіть втрати нейронами решітки періодичності.[17] Він навіть зберігає притаманну просторову роздільну здатність, якщо, як показали останні дослідження, більшість нейронів із високою просторовою інформацією в мЕК не є класичними нейронами решітки, але «нейронами-стрічками» (англ. band cells) чи навіть неперіодичними просторово вибірковими нейронами (англ. nonspatially periodic cells).[50] Більше того, навіть існування модулів не є настільки важливим, як до прикладу для коду ґрунтованого на модульній арифметиці. У схемі вкладених відрізків кожен нейрон решітки може мати свій власний інтервал ґратки, сформований із цілого континууму можливих довжин масштабів. Допоки буде зберігатись умова, що всі довжини масштабів є щільно розміщені в решітках, популяція нейронів кодуватиме простір з високою точністю та малими помилками, даючи тварині адекватну інформацію про її місцезнаходження[78].
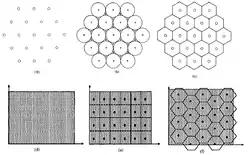
Схема вкладеного коду також дозволяє пояснити те, чому нейрони решітки мають гексагональну форму розрядів і чому гексагональна ґратка забезпечує більшу просторову роздільну здатність, аніж квадратна. Тобто, чому для унімодальних кривих налаштування оптимальний нейрон решітки буде мати гексагональну, а не квадратну періодичність[78]. Із добре знаної геометричної проблеми пакування кіл (Circle packing) відомо, що серед усіх регулярних покриттів площини плиткою з однаковою площею, гексагональне замощення найбільш щільно вкладає вписані кола.[85] Ґрунтуючись на цьому, теоретики обчислили роздільну здатність невеликої популяції нейронів решітки і показали, що використання нейронами решітки гексагонального пакування дозволяє отримати більш повну та менш помилкову інформацію, аніж використання квадратних ґраток, які не щільно заповнують площину. З цього випливає, що ефективний просторовий період гексагональних ґраток є меншим, аніж квадратних.[80][87]
Геометричну оптимальність гексагональних конфігурацій було вперше доведено угорським математиком Ласло Феєш Тотом у його відомій «теоремі про суму моментів»,[88][89] що отримала широке застосування у найрізноманітніших галузях, зокрема і в квантуванні даних. Із теореми Тота випливало, що оптимальні двовимірні квантівники для двовимірних сигналів (аналогово-цифрові перетворювачі) дискретизують (розбивають на кінцеві елементи) простір на гексагональні решітки (комірки), тобто кодові слова організовані на гексагональній решітці і, для кодування кожної аналогової величини, призначені до найближчої точки (вузла) ґратки.[86][90]
Однорідний двовимірний векторний квантівник ґрунтується на фундаментальній області квантування (комірці квантування), чиї перенесення замощують двовимірну площину.[91] В одновимірному випадку для існує тільки один можливий вибір — інтервал з довжиною ∆, тоді як для двох вимірів — це квадрати та гексагони. Перевірка ефективності векторного квантування зазвичай виконується через вимірювання його середнього спотворення певного джерела вхідного сигналу — чим менше середнє спотворення, тим ефективнішим є квантування. З точки зору діаграми розбиття це можна розглядати в термінах середньої відстані до центра комірки, або ж як ефективність щільного пакування комірок.[85] Такий розгляд середнього спотворення квантування в термінах геометричної форми комірок дозволяє побачити, що гексагональні ґратки мають менше загальне спотворення (середньоквадратичне відхилення) джерела вхідного сигналу, аніж квадратні ґратки.[86] Відтак, гексагональна геометрія забезпечує мінімальне спотворення, уможливлюючи оптимальне векторне квантування і максимально точну передачу інформації.
Код усунення помилок
В цілому, із суто теоретичної точки зору кодування, обидві схеми коду нейронів решітки — модульно-арифметичний та вкладений коди — показують, що незважаючи на притаманні нейронам мЕК шум та варіативність, вони володіють незрівнянно високою точністю в репрезентації положення тварини у просторі.
Періодична природа решітки дозволяє активності нейронів мЕК в межах одного модуля кодувати положення в просторі аж до довільного дискретного зміщення, і хоча з теоретичної точки зору такий нейронний код може здаватись надлишковим та двозначним, сукупна активність кількох модулів здатна кодувати великий діапазон положень без будь-якої двозначності[2][92]. Саме тому grid-нейронний код має набагато більший діапазон представлення та точність відображення положення в просторі, аніж код нейронів місця із тією самою кількістю нейронів та роздільною здатністю. Цей діапазон нейронного коду решіток може значно перевершувати типовий діапазон руху щура в природних умовах.[73]
Відкриття такої високої ємності коду нейронів решітки спонукало теоретиків до думки, що однією з його ключових функцій є усунення помилок у репрезентації положення в просторі. Якщо, до прикладу, сильно спотворена фаза в одному з модулів перемістить відображене положення на нереалістичне місце, то ґрунтуючись на фазах інших модулів, ця помилка може бути ідентифікована та виправлена[54][74] Інша можлива користь від надлишковості та ємності коду решітки — це наділення grid-нейронів здатністю до глобальної реконфігурації (англ. remapping) в гіпокампі:[93] незалежне переміщення фаз в різних модулях, або обертання осей решіток відносно одна одної в ЕК, уможливлює відмінні представлення нейронами місця в гіпокампі різних середовищ з малою імовірністю перекриття між двома нейронними кодами.[52][94]
Отже, якщо розглядати grid-код як код щодо множини незалежних груп решіток, то grid-код є компактним та комбінаторним, хоча використання нейронів у єдиній популяції решіток і може видаватись надлишковим та не економним. А висока інформаційна ємність та ефективність у виконанні арифметичних обчислень, автономна здатність до усунення помилок роблять grid-нейронний код ідеальним для інтегрування та репрезентації аналогової змінної із великим діапазоном. З цієї точки зору, без врахування динаміки, мЕК може бути нейронним інтегратором шляху і первинним місцем абстрактної репрезентації місцеположення в мозку щура.
Нейронні кореляти grid-коду
Головним типом провідних нейронів у мЕК ІІ є зіркоподібні нейрони, що складають близько 70 % всіх нейронів у цій ділянці енторіальної кори, тоді як пірамідальні нейрони — лише 15 %.[95][96] І як показали нещодавні дослідження, подібно до зіркоподібних нейронів ІІ шару,[97] grid-нейрони також здатні проектуватись на гіпокамп.[98] Отже, швидше за все зіркоподібні нейрони складають значну частину популяції нейронів решітки. Але беручи до уваги, що нейрони в інших шарах ЕК, не тільки ІІ, також мають решітко-подібні паттерни активності, очевидно, що фенотип grid-нейронів не обмежується єдиним типом нейронів.
Біофізичні основи і властивості розрядів решітки
Зіркоподібні нейрони характеризуються високою щільністю HCN-каналів (гіперполяризаційно-активованих керованих циклічними нуклеотидами), що активуються під час мембранних потенціалів спокою.[99] Така щільність обумовлює притаманний зіркоподібним нейронам низький вхідний опір, що накладає суттєві обмеження на мінімальну кількість вхідних сигналів, потрібних для генерації спайків протягом збудження нейронів решітки.[100][101][102]
Крім того, висока щільність HCN-каналів впливає на динамічні властивості мембранних потенціалів нейронів решітки. Після інжекції синусоїдного струму з різними частотами до зіркоподібних нейронів щура in vitro, їх мембранні потенціали характеризуються чітким резонансом в тета-частотному діапазоні, а спайки фазово зав'язані на вхідні сигнали в тета діапазоні.[103][104][105][106]
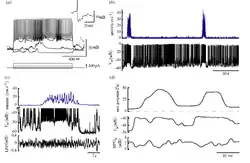
Зіркоподібні нейрони мЕК ІІ, разом із пірамідальними нейронами, також характеризуються стійкою тета-періодичністю мембранного потенціалу протягом потенціалу локального поля (LFP) тета-періодів in vivo,[12][103] при тому, що пірамідальні нейрони мають вдвічі сильнішу тета-періодичність та тета-фазову зав'язаність, аніж зіркоподібні.[107] Тоді як не зіркоподібні нейрони в глибших шарах мЕК позбавлені цієї тета активності.[100][108] Цікаво, що зіркоподібні нейрони в кажанів також позбавлені такого резонансу, що виражається у відсутності неперервних позаклітинних тета осциляцій під час збудження нейронів решітки у цих видів.[4][109]
Зіркоподібні нейрони гризунів здатні також спонтанно генерувати внутрішні осциляції мембранного потенціалу в тета-частотному діапазоні після близької до спайкового порогу деполяризації in vitro.[95][110] Частота цих внутрішніх коливань залежить від мембранного потенціалу та дорсо-вентрального положення зіркоподібних нейронів у мЕК ІІ, що напрочуд близько корелює із градієнтом інтервалів полів нейронів решітки вздовж тих самих дорсо-вентральних осей (див. Модульна організація).[111]
У свою чергу, градієнт у частотах внутрішніх осциляцій мембранних потенціалів відображає градієнт внутрішніх мембранних властивостей, що обумовлюють внутрішні темпоральні інтегративні функції зіркоподібних нейронів.[112] Дорсо-вентральна різниця в щільності HCN-каналів разом із провідністю калієвого витоку породжують дорсо-вентральний градієнт для ряду внутрішніх мембранних властивостей зіркоподібних нейронів — у вхідному опорі, часовій сталій мембрани та провисанні потенціалу.[102][111]
Як наслідок градієнту внутрішніх мембранних властивостей, дорсальні нейрони мають коротший період для синаптичної інтеграції й менше темпоральне об'єднання збуджувальних постпотенціальних потенціалів у гама-частотному діапазоні, аніж вентральні нейрони, що може означати, що інтегративні синаптичні властивості зіркоподібних нейронів прилаштовані до дорсо-вентрального градієнту інтервалів полів нейронів решіток.[102] Це також підтверджується тим, що відключення ключової складової одиниці HCN-каналу — HCN1 — призводить до розширення інтервалу та розміру поля решітки.[53]
У підсумку, коли тварина перетинає рецептивне поле зіркоподібного нейрона, мембранний потенціал характеризується тривалою деполяризацією, що веде до спайкового вихідного сигналу, що схоже на такий самий механізм у нейронів місця в області СА1 гіпокампа.[113] Не зіркоподібні нейрони із решіткоподібними розрядами також володіють такою повільною деполяризацією,[12] дозволяючи припустити існування єдиного механізму електричного збудження для всіх типів нейронів, що здатні породжувати решіткові розряди. І якщо така повільна деполяризація визначає частоту спайків протягом перетину рецепторного поля, то тета-осциляції мембранних потенціалів покладають часові параметри спайків.[112]
Мережа функціональних зв'язків мЕК
Одна з особливих і неочікуваних рис, що було відкрито в мережі нейронів мЕК, — це зовсім невелика кількість зворотних збуджувальних зв'язків між ними, на відміну від інших кіркових регіонів ссавців.[114][115] Зіркоподібні нейрони з'єднані між собою головним чином через інгібіторні інтернейрони, тоді як зворотні збуджувальні зв'язки або незначні, або взагалі відсутні.
На відміну від зіркоподібних нейронів, пірамідальні нейрони ІІ шару мЕК, що також генерують решітокподібні паттерни активності, отримують прямі збуджувальні вхідні сигнали, коли оптично простимулювати мЕК ІІ провідні нейрони, що може свідчить про те, що зіркоподібні нейрони можуть спонукати пірамідальні нейрони до генерації розрядів решітки.[114]
Розвиток нейронів решітки
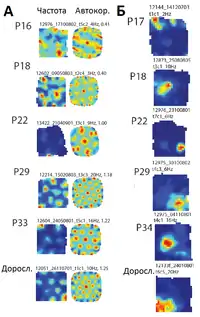
Медіальна енторіальна кора дорослого щура має розвинуті нейрони решітки та нейрони, що кодують напрямок голови (англ. head direction cells, НГ), які репрезентують два різні просторові параметри (напрямок і відстань), необхідні для підтримки інтеграції шляху[11]. Між цими двома типами нейронів існує значне запізнення у розвитку: 20-й день після пологів — це найбільш ранній вік, коли схожі на дорослі розряди нейронів решіток стають помітними, майже через тиждень після розвитку НГ-нейронів, які вже на 15-му дні (коли дослідники починають проводити їх реєстрацію) характеризуються сильною вибірковістю до напрямку і схожі на дорослі НГ-нейрони.[116][117] Це саме той період, коли у щурят з'являється здатність до вивчення середовища і вони починають навчатись пов'язаним з гіпокампом завданням на пам'ять.[118]
До 20-го дня в мЕК можна спостерігати деякі просторово локалізовані розряди, навіть багатопікові поля розрядів, але вони не мають характерної для дорослих нейронів решітки регулярності та гексагональної симетрії, як і стабільності під час реєстрації.[117]
Під час перших спроб навігації в середовищі, щурята також мали вже нейрони місця, кількість яких на 16-18 день була трохи менша, аніж в зрілому віці, хоча їх просторова вибірковість та стабільність не були цілком розвинуті і ще продовжували змінюватись.[116]
Останні дослідження показали, рудиментарна карта просторово-вибіркових нейронів вже присутня, коли тварини тільки вперше починають навігацію у зовнішньому світі. І хоча нейрони місця, НГ нейрони та нейрони решітки різняться темпами свого розвитку, вони можуть взаємодіяти між собою з самого початку.[118]
В основі взаємодії нейронів з різними етапами розвитку можуть бути інші, зріліші нейрони. До прикладу, зрілі репрезентативні образи в пре- та парапідставці гіпокампа (subiculum) щурят можуть направляти розвиток просторових репрезентацій в їх ЕК та гіпокампі. А рудиментарні нейрони решітки, не зважаючи на свою меншу зрілість порівняно з іншими, можуть відсилати достатньо структурований сигнал до гіпокампа, породжуючи в ньому специфічні для локального місця реакції. Суттєвим чинником у створенні об'єднаної, енторіально-гіпокампової картини простору, є еволюція внутрішніх зв'язків поміж нейронами в мЕК протягом чотирьох тижнів післяпологового періоду.[117]
Еволюція та функції grid-нейронів
Окрім гризунів нейрони решітки були також знайдені в кажанів — єгипетських летючих собак.[4] Всі характерні риси нейронів решіток щурів також проявлялись у кажанів: гексагональне поле розрядів, єдність інтервалу та орієнтації решітки, відсутність фазової топографії, збільшення масштабу решітки вздовж дорсовентральної осі та модуляція частоти розрядів швидкістю. Так само, як і в щурів, в кажанів нейрони решітки знаходились поруч із «нейронами напрямку голови» та «нейронами межі».[119]
Відокремлення кажанів на ранніх стадіях еволюції ссавців (ще до відокремлення гризунів та приматів), свідчить про те, що нейрони решітки існували вже на зорі еволюції і тому можуть бути присутніми серед багатьох видів ссавців. З цим узгоджується і той факт, що всі досі відкриті просторово-налаштовані нейрони знаходяться у філогенетично давніх областях кори — гіпокампі та парагіпокампальних регіонах.
Нейрони із решітко-подібними властивостями також були виявлені у приматів. На відміну від дослідів з гризунами, тут суб'єкти не рухались по просторовому середовищу. В одному дослідженні мавпи розглядали послідовність зображень у швидкому чергуванні.[5] Решіткоподібні паттерни ставали помітними, коли спайки нанесли на карту позицій очей мавпи, незалежно від змісту візуальних картинок, припускаючи, що grid-нейрони є складовою частиною системи, яка використовує рух очей для визначення розрядів і що положення розрядів обумовлюється окулярним механізмом інтеграції шляху. Відкриття залежності від місцезнаходження погляду в нейронах решітки мавп співзвучна із ранніми дослідженнями, які припускали, що гіпокампові та парагіпокампові нейрони в мавп збуджуються тоді, коли тварина дивиться на певне місце, незалежно від місцезнаходження самої мавпи.[120][121]
В іншому дослідженні на пацієнтах з фармакорезистентною епілепсією, суб'єкти рухались між наперед визначеними місцями у віртуальному середовищі.[122]
В обох експериментах паттерни решіток мали значно більше шумів, аніж під час руху у щурів, проте періодичність була сильніша, аніж можна було б очікувати в результаті дії випадкових чинників. Можливі причини цих шумів, це неточне розміщення електродів, усереднення активності в кількох шарах кори чи змішання суб'єктами віртуальних та реальних систем відліку. Тож, природа відкритих у приматів нейронів решіток залишається не до кінця зрозумілою і потребує ретельнішого вивчення та пояснення отриманих даних. В цілому ж, ці відкриття припускають, що в еволюції приматів, нейрони місця та нейрони решітки стали реагувати не тільки на зміни в швидкості та напрямку руху, як у гризунів, але також на швидкість руху очей тварин. Залишається відкритим питання, чи ті самі нейрони, які реагують на візуальний рух так само періодично будуть реагувати на саморух мавпи чи людини, чи для руху вони володіють окремою системою grid-нейронів.
Відносна еволюційна давність нейронного коду решіток та його присутність у різних видів ссавців спонукала нейробіологів замислитись над функціями цих нейронів, яку інформацію вони кодують і як допомагають тваринам виживати. З огляду на властивості grid-нейронів, відношення між ними в модулях мЕК та вплив на кодування нейронів місць, багато з дослідників дотримуються думки, що їх головними функціями є підтримка механізму інтеграції шляху, формування пам'яті або кодування метрики для рецепторних полів нейронів місця.
Інтеграція шляху
Інтеграція шляху — це одна з головних навігаційних стратегій, яка притаманна багатьом видам тварин і полягає в тому, що поточне положення тварини відносно деякої точки відліку утримується через неперервну інтеграцію напрямку та відстані, пройдених відповідно до активного саморуху тварини.[123][124] Хоча прямих свідчень про роль grid-нейронів в інтеграції шляху наразі не отримано, існує ряд непрямих даних про їх включеність в цей механізм навігації:
- нейрони решітки розташовані в мозку щурів поряд із так званими «кон'юнктивними» нейронами (англ. conjunctive cells) та нейронами, що реагують на напрямок повороту голови (англ. head direction cells), які характеризуються єдиною просторовою налаштованістю в різних середовищах, тому вся інформація, потрібна для реалізації інтеграції шляху, наявна в одному локальному нейронному ланцюгу;[2]
- поле нейрону решітки швидко генерується в новому середовищі, оновлюється за відсутності візуальних сигналів та є стабільнім після вилучення локальних розпізнавальних знаків;[61]
- просторовий масштаб поля решітки залишається фіксованим та незмінним у своїй впорядкованості у знайомих тварині середовищах, тим самим уможливлюючи, незалежно від контексту, цілісну та надійну оцінку відстані, пройденої твариною;[52]
- нейронна репрезентація повинна зберігати поточне положення у просторі настільки точно, наскільки можливо, не зважаючи на нейронний шум та мінливість, інакше незначні внутрішні відхилення від оцінки положення з часом накопичаться і перетворяться у великі помилки, що унеможливлять інтеграцію шляху. Така точність у репрезентації та динамічному оновленні карт середовища можлива тільки завдяки унікальним властивостям коду нейронів решітки (див. далі Grid-нейронний код);
- ураження мЕК-регіону у щурів призводить до неспроможності інтеграції шляху. Щурі з ураженнями мЕК не здатні обробляти просторову інформацію, пов'язану із вивчанням об'єкту та завданнями розпізнавання, виявляти просторову новизну, хоча непросторове розпізнавання об'єктів залишалось неушкодженим.[42]
Розряди нейронів решіток не просто відслідковують накопичені ідеоцентричні сигнали, вони кодують положення тварини в аллоцентричному просторі, після формування цього коду, він стабілізується і контролюється зовнішніми (аллоцентричними) сигналами. До прикладу, розряди решіток стабільні щодо відстаней та тривалості, а також між різними відвідуваннями локального середовища, що не може точно оцінюватись лише на основі ідеоцентричної інформації[1]. Крім того, орієнтація решітки контролюється рухом єдиного поляризованого зовнішнього сигналу в цілком симетричному круглому середовищі.
Формування пам'яті
Найменш вивченою, але не менш важливою проблемою у розумінні просторового коду нейронів місця та решітки є те, як енторіальна кора та гіпокамп можуть підтримувати одночасно такі, на перший погляд, різні операції, як навігація та запам'ятовування/пригадування. Функціонально-анатомічні особливості цих структур тільки проливають світло на їх тісний взаємозв'язок і взаємовплив,[125] але не пояснюють спосіб інтеграції їх різнорідних функцій.
Роль енторіальної кори в консолідації пам'яті
Характерною рисою кортикально-гіпокампального зв'язку у ссавців є існування асоціативних кіркових структур, що слугують сполучними ланками між гіпокампом та рештою кори. Ці асоціативні регіони включають перірінальну, енторінальну та парагіпокампальну кору, які разом називають «парагіпокампальною областю». Ця область характеризується двома головними шляхами обробки інформації. Перший — шлях «що», до якого входять перірінальна та латеральна енторіальна кора, і який є важливим для обробки та репрезентації властивостей специфічних об'єктів, стимулів.[126] У гризунів та приматів ця система отримує інформацію від усіх сенсорних модальностей, є критичною для об'єктної пам'яті та містить нейрони, що реагують на специфічні об'єкти.[127][128]
Другий шлях обробки інформації в парагіпокампальній області опрацьовує інформацію «де», і складається із парагіпокампальної/постріальна кора та медіальної енторіальної кори. Ця система головним чином отримує просторово-зорову інформацію та є ключовою для навігації та формування пам'яті.[129][130] Накопичені за останні десятиліття дані значно змінили і доповнили класичне уявлення про енторіальну кору, як лише перехідну структуру між гіпокампом та неокортексом у консолідації пам'яті, відводячи їй складнішу роль у формуванні та зміні асоціацій та спогадів. Навіть після того, як гіпокамп більше не потрібний для відновлення спогадів, ЕК продовжує впливати на цей процес, припускаючи, що протягом консолідації пам'яті, в кірковій мережі може мати місце додаткове синаптичне підсилення, яке може змінити зв'язки ЕК із іншими, не гіпокамповими, областями кори.[131]
Окрім того, в ЕК існує мережа, що обопільно з'єднує латеральну (лЕК) та медіальну енторіальну кору (мЕК), що дозволяє непросторовій інформації в лЕК та просторовій в мЕК бути пов'язаними вже на рівні ЕК.[132][133] Також анатомічно поєднаними є глибинні та поверхневі шари ЕК, що пояснює те, чому характерні розряди нейронів в усіх шарах мЕК мають чіткі кореляти у всіх шарах протягом навігації[11][134][135].
Такі складні взаємозв'язки в межах самої ЕК та з іншими, не гіпокамповими структурами кори, свідчать про те, що інформація інтегрується ще до того, як вона надійде до гіпокампової формації, що суттєво різниться від класичного уявлення про те, що ЕК лише формує просторову карту і метрику, надсилає їх гіпокампові, а останній вже формує консолідовану пам'ять. Відтак, ЕК разом з гіпокампом беруть участь в асоціації інформації, що згодом стає потрібною для формування пам'яті. Тільки ЕК володіє універсальнішою репрезентацією пам'яті асоційованої інформації, тоді як гіпокампова формація залучена в опрацювання деталей цієї інформації через такі процеси, як розділення та доповнення образів (англ. pattern separation & completion).[125] Нове розуміння того, що ЕК опрацьовує інформацію на ранньому та більш загальному рівні, аніж гіпокамп, відповідає накопиченим даним, що ЕК утримує універсальну карту, яка є важливою для навігації нейронів місця гіпокампа.
Від навігації до пам'яті
Ті самі системи мозку (гіпокамп та ЕК), які лежать в основі навігації тварини, також підтримують декларативну пам'ять. Втім, як саме просторові та мнемічні механізми взаємодіють в одній і тій же анатомічній структурі, наразі ще достеменно не відомо.
Очевидно, що для ефективної підтримки пам'яті, нейронна система, що еволюціювала для навігації, повинна відповідати двом вимогам: а) вона повинна володіти здатністю зберігати велику кількість здавалося б непов'язаних (ортогональних) репрезентативних образів, і б) бути спроможна до самостійного породження послідовності еволюціюючих з часом нейронних груп.[136]
Одна з найбільш експериментально обґрунтованих гіпотез зв'язку пам'яті та навігації припускає,[136] що нейронні механізми, які еволюціювали для визначення просторових відношень між зовнішніми орієнтирами, здатні також реалізувати асоціації між об'єктами, подіями та іншою фактичною інформацією в ментальному просторі. Це припущення ґрунтується на специфічній організації мережі нейронів решітки у напів-незалежні модулі. Подібна функціональна автономність модулів решіток, їхня спроможність по-різному відповідати на зміни середовища, забезпечує гіпокамп комбінацією великої кількості паттернів, що призводять до появи величезного різноманіття дискретних карт, специфічних для численних місць, які тварина відвідує у своєму житті.[137][138]
Формування численних незалежних карт у гіпокампі має ряд переваг для утворення пам'яті, оскільки воно дозволяє нейронній мережі зберігати нові репрезентативні образи світу в такий спосіб, щоб мінімізувати зіткнення із попередніми спогадами.
Якби система енторіально-гіпокампової кори еволюціювала тільки для навігації, тоді не було би потреби в її колосальному комбінаторному просторі та величезній комбінації потенційних нейронних груп.[139] Адже навіть комахи, маючи значно простіші нейронні ланцюги та меншу кількість нейронів, аніж ссавці, характеризуються ефективною навігацією.[140] Окрім того, локальне середовище, в якому рухається щур, може бути «картографоване» з сантиметровою точністю всього лише кількома десятками нейронів решітки чи нейронів місця.[52][141]
Скоріш за все ті самі нейронні механізми, що залучені у формування та зберігання пов'язаних із системою «енторіальна кора-гіпокамп» спогадів, еволюціювали від механізмів, первинно призначених для обчислення просторових відношень між орієнтирами та відстежування рухів тіла тварини в локальному середовищі. А оскільки активне вивчення твариною середовища є передумовою для обчислення відстаней та калібрування відношень між зовнішніми орієнтирами, то рух є первинним джерелом здатності мозку як формувати послідовності просторових образів, так і запам'ятовувати ці послідовності. Тому механізми репрезентації мозком шляху в середовищі повинні бути схожими із механізмами, що використовуються для репрезентації послідовностей спогадів у пам'яті.[136]
На користь цієї гіпотези свідчить і те, що подібно до позиційно обумовлених послідовних розрядів нейронів вздовж лінійного шляху, послідовність довільних об'єктів в епізодичній пам'яті є одномірною.[142] Тому один і той самий механізм кодування може бути використаний для темпоральної інтеграції просторових позицій та епізодичних об'єктів.[143] Односпрямований зв'язок об'єктів в епізодичній пам'яті (схожий на зв'язок нейронів місця) спроможний пояснити два головні принципи довільного пригадування (англ. free recall): а) асиметрію, тобто міцність асоціацій спрямованих вперед порівняно із зворотно-спрямованими асоціаціями, та б) часову суміжність — коли згадування деякого об'єкту полегшується презентацією або спонтанним пригадуванням іншого об'єкту, що був близьким по часу до щойно пригадуваного об'єкту.[144][145]
Отже, притаманне ЕК та гіпокампу величезне різноманіття ортогональних (неперекривних та незалежних) репрезентативних просторових образів, породжуваних модульним відображенням простору, протягом еволюції ссавців заклало підґрунтя для зберігання незалежних образів для різного роду середовищ та форм досвіду, з якими тварина щодня стикається. Подібна суттєво збільшена репрезентативна здатність відображати та зберігати різноманітні деталі середовища може бути тим, що власне різнить мозок ссавців від мізків тих видів, у яких навігація в просторі ґрунтується на меншій кількості нейронних груп.[136][146]
Трансформація нейронів решітки в нейрони місця

З часу відкриття grid-нейронів постало питання, чому в мозку тварин паралельно існують два способи репрезентації місця в просторі — гіпокамповий та енторіальний просторові коди. З одного боку, нейрони місця в гіпокампі репрезентують положення в просторі. В кожному місцезнаходженні щура активується лише невелика частка нейронів місця гіпокампа, тому, в принципі, група нейронів місця може бути використана для реконструкції положення щура в локальному середовищі.[141][147] З іншого боку, нейрони решітки в ЕК також репрезентують положення в просторі. І подібно до нейронів місця, в кожному місцезнаходженні щура лише невелика частина нейронів решітки є активною. Із достатньою варіацією в інтервалах та орієнтації решітки, група нейронів мЕК може, в принципі, бути використана для реконструкції положення щура в локальному середовищі.[35]
Навіщо мозку потрібні дві схожі, однаково ефективні і паралельно діючі системи позиціювання? Відповідь може бути дана на основі відмінності між нейронами місця та решітки, що найяскравіше проявляється в експериментах, де нейрони гіпокампа проявляють цілковиту реконфігурацію (англ. remapping) між середовищами або навіть між переживаннями в тому самому середовищі.[27][148] В таких випадках нейрони місця змінюють свою частоту розрядів систематично, тоді як нейрони решітки не проявляють жодних змін в частоті розрядів. При цьому положення поля нейрону місця не змінюється, а змінюється частота розрядів нейронів місця т. зв. «реконфігурація частоти». В інших випадках нейрони місця змінюють положення їх полів розрядів, т. зв. «глобальна реконфігурація».[149]
У випадках глобальної реконфігурації нейрони решітки, що належать до однакового модуля, можуть змінити фазу та орієнтацію решітки, але їхня відносна фаза залишається незмінною.[17] Також, тоді як протягом глобальної реконфігруації два прилеглі нейрони місця в одному середовищі не обов'язково залишаються прилеглими в іншому чи навіть можуть бути цілком замінені, то два нейрони решітки із малою фазовою різницею в одному середовищі зберігають її в іншому.[52] Тобто, grid-нейрони, що належать до одного модуля, на відміну від нейронів місця зберігають інформацію про відносну відстань.
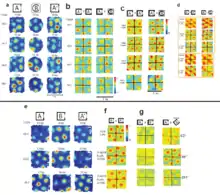
З цього випливає, що якщо нейрони місця можуть бути використані для визначення неперервності простору, то нейрони місця для цього не годяться. Це пов'язано з тим, що послідовність розрядів нейронів решітки репрезентує неперервність в просторі, тоді як подібна послідовність розрядів нейронів місця цього не може. Нейрони місця є специфічними для кожного середовища і тому просторова неперервність в одному середовищі не означає неперервність в іншому.[3]
Таким чином, енторіально-гіпокампова система має дві карти простору. Одна виражає метрику середовища незалежно від притаманної йому конфігурації орієнтирів (нейрони решітки), а інша карта складається із напів-ортогональних репрезентативних образів, що є унікальними для даного локального середовища (нейрони місця). Тобто, з одного боку, існує одна загальна карта простору, а з іншого — велика кількість карт для окремих просторів.[55]
Інше важливе питання впливу нейронів решіток на нейрони місця і навпаки полягає в тому, чи існує між їхніми відмінними нейронними кодами функціональний зв'язок.
З часу відкриття нейронів решітки виникло ряд обчислювальних моделей, які припускали, що нейрони місця виникають через трансформацію вхідних сигналів із нейронів решітки в ІІ і ІІІ шарах мЕК, які безпосередньо зв'язані з нейронами місця в гіпокампі. За аналогією з вибірковими до орієнтації нейронами, що постають через лінійну сумацію концентричних полів у візуальній корі,[150] було запропоновано і сконструйовано нейронні обчислювальні моделі, які показували, що нейрони місця також можуть виникати у спосіб схожий на перетворення Фур'є, через лінійну сумацію вихідних сигналів із нейронів решітки з фазою решітки, що перекривається, але відмінною орієнтацією,[2][14][92][115][151] і що поле розрядів гіпокампових нейронів місця проявлятиме масштабування дорсовентральної топографії, схожої на таку ж в мЕК.[51][62]
Запропоновані ранні математичні моделі трансформації нейронів решіток в поля нейронів місця визначили ряд суттєвих параметрів для побудови із множини полів решіток єдиного поля місця.[151] По-перше, для уникнення дублювання періодичності решіток в нейронах місця припускалось, що інтеграція сигналів решіток повинна включати невелику кількість частот решіток, оскільки тоді різні частоти взаємовиключаються й виникає єдиний нейронний пік місця в невеликому локальному середовищі. Ця ідея узгоджується з даними, що дорсальні поля місця гіпокампа зменшуються в розмірі після ураження вентральної та проміжної областей мЕК.[152] По-друге, для генерації багатоспрямованих полів місця в гіпокампі та усунення розрядів зайвих полів нейронів місця більшість моделей припускали інтеграцію вихідних сигналів від нейронів решіток з більш ніж однією орієнтацією решітки на кожен індивідуальний нейрон місця.[153][154]
І, по-третє, математичні моделі передбачали, що для формування єдиного місця розряду для нейронів гіпокампа необхідне вирівнювання в одну лінію просторових фаз нейронів решіток, що генерували це єдине поле місця.[151]
Поряд з тим, інші обчислювальні моделі припускають, що поля нейронів місця можуть виникати від не тільки від нейронів решіток, але і від будь-якого слабкого просторового вхідного сигналу — як періодичного, так і не періодичного — якщо локальний нейронний ланцюг в гіпокампі володіє механізмами для підсилення цього сигналу через рекурентні мережі або Хеббівську пластичність.[94][154][155][156]
Зокрема Хеббівські механізми навчання, застосовні до мереж з прямими зв'язками, можуть бути використані для вибору вхідних сигналів із тих нейронів решіток, що мають просторові фази, що перекриваються.[154][157]
Також поєднання точної темпоральної спайкової активності нейронів мЕК та гіпокампа із Хеббівською синаптичною пластичністю спроможне ще більше вдосконалити вибірковість нейронів місця.[55] Зокрема, темпоральний код розрядів нейронів решіток із можливим існуванням у них тета-фазової прецесії може забезпечити надійний механізм для відокремлення полів решіток з повним перекриттям від полів решіток з частковим перекриттям.[153] Нещодавнє відкриття незалежної від гіпокампа тета-фазової прецесії в нейронах решітки підтверджує ідею про фазове вирівнювання, запропоноване ранніми моделями перетворення полів решіток в поля нейронів місць.[48]
Третій тип моделей намагається пояснити перетворення періодичних полів розрядів нейронів решіток в нейрони місця використовуючи інгібування за типом зворотного зв'язку (англ. feedback inhibition) в межах групи нейронів місця.[94] У цій моделі корельовані вхідні сигнали решіток формують основу для активності нейронів місця в нових середовищах, які після того, які середовище стає знайомішим, уточнюються через механізми навчання. Розбивши в моделі зі зворотнім зв'язком групу нейронів решіток на просторові модулі таким чином, щоб решітки з різними інтервалами проектувались на нейрони місця, можна отримати надійний механізм для «глобальної реконфігурації» в гіпокампі, що підтверджує роль модульної організації решітки в ортогоналізації репрезентативних образів у гіпокампі.[27] Симуляція моделі чітко показала, як вхідні сигнали навіть лише з двох різних модулів решіток здатні призвести до суттєвої реконфігурації полів розрядів нейронів місця.[94]
Однак, розуміння взаємозв'язку між нейронами решітки та нейронами місця ще більш ускладнилось, коли було виявлено, що не тільки нейрони решітки, але й інші типи нейронів у мЕК відсилають сигнали до гіпокампу.[98] Особливими у цьому відношенні є сигнали із «нейронів границі» (англ. border cells), оскільки ще ранні моделі нейронів місця, до відкриття нейронів решітки, припускали, що паттерни розрядів цих нейронів можуть породжувати просторову вибірковість нейронів місця.[158][159] Вважалося, що нейрони місця отримують вхідні сигнали з кори поза гіпокампом від гіпотетичних «граничних векторних нейронів», чия активність повинна була виражати відстань та напрямок до певних границь локального середовища.[160] Наявні в мЕК «нейрони границі» є підмножиною таких граничних нейронів, але вони активізуються тільки на границі.
Нейронну пікову активність зі зростанням відстані від границь середовища було виявлено в підставці гіпокампа, але не серед нейронів мЕК, що проектують сигнали до гіпокампу.[45][161] Вплив нейронів границь в ЕК на формування поля нейронів місця узгоджується з даними про активізацію полів місця в гіпокампі біля кутів та стін локального середовища перебування тварини.[162] А оскільки нейрони границі мають риси дорослих нейронів з першого дня, коли щурята починають вивчати зовнішнє середовище,[163] вхідні до гіпокампа сигнали від цих нейронів можуть пояснити те, чому нейрони місця стають зрілими раніше від нейронів решітки, і чому вони, швидше за все, є від початку бодай частково вродженими,[116][117] всупереч моделі лінійної сумації для трансформації нейронів решітки в нейрони місця. З чого випливає, що нейрони границі відіграють суттєву роль у формуванні та керуванні нейронів місця в юних тварин, а нейрони решітки починають відігравати важливішу роль, коли тварини дорослішають, формуючи стійку метрику полів нейронів місця.
Ці дані підтримуються дослідженням активності нейронів місця у дорослих тварин, в яких нейрони місця зберігались, хоча періодичність полів решітки було порушено в результаті інактивації медіальної септальної області.[157] Хоча ці суперечливі дані частково можуть відображати складність реєстрації нейронів решіток і недоліки самих експериментів, оскільки паттерни решіток в юних щурят та дорослих із інактивованою септальною областю важко побачити через просторову нестабільність їхньої нейронної активності. Також можливо, що, незважаючи на меншу зрілість порівняно із нейронами місця, рудиментарної періодичності юних нейронів решітки, у поєднанні з Хеббівською пластичністю та фазовою прецесією, достатньо для того, щоб спонукати локальні розряди в нейронах місця.[164]
Проте не лише нейрони решітки впливають на нейрони місця, але й навпаки — активність нейронів місця визначає розряди полів решіток через прямі або непрямі зв'язки, навіть не зважаючи на те, що паттерни нейронів решітки зберігаються протягом перших хвилин після інактивації гіпокампа.[48] Адже хоча нейрони місця знаходяться нижче від нейронів решіток, вони також вище, оскільки нейрони області CA1 гіпокампа відсилають зворотні зв'язки до ЕК, як безпосередньо, так і через підставку гіпокампа (англ. subiculum).[135][165]
Специфічний зв'язок розрядів нейронів місця з контекстом та величезна ємність мережі нейронів гіпокампа відводять йому роль можливого місця зберігання асоціацій між інтегратором шляху та конкретними рисами локального середовища[14]. Через зворотній зв'язок в глибинні та поверхневі шари ЕК сигнали від нейронів місця в гіпокампі можуть оновлювати енторіальну інтеграцію шляху після накопичення помилок протягом руху тварини. А асоціації із зовнішніми орієнтирами, які зберігаються в гіпокампі, можуть також уможливлювати вирівнювання карт решіток від одного середовища до іншого, навіть коли точка відправлення тварини є іншою.[166]
Ключова роль зворотного зв'язку нейронів місця з гіпокампа у визначенні активності нейронів решітки підтверджується тим, що інактивація гіпокампа веде до втрати нейронами решітки їхніх гексагональних властивостей. Після відключення цілої мережі нейронів місця паттерни решітки ще кілька хвилин зберігаються, але тривала інактивація призводить до розмивання поля решіток і згодом до повної втрати їхньої гексагональної просторової структури.[167]
Зникнення гексагонального паттерну корелює зі спадом частоти розрядів нейронів решітки і узгоджується з ідеєю, що вони потребують зовнішніх збуджувальних сигналів для підтримки активності полів решітки та зворотніх зв'язків від гіпокампа для оновлення позиційних координат на основі специфічних карт середовища, які зберігаються в гіпокампі.[70][114]
Джерела
- Hafting Torkel, Fyhn Marianne, Molden Sturla, Moser May-Britt, Moser Edvard I. (2005). Microstructure of a spatial map in the entorhinal cortex. Nature 436 (7052): 801–806. ISSN 0028-0836. doi:10.1038/nature03721.
- McNaughton Bruce L., Battaglia Francesco P., Jensen Ole, Moser Edvard, Moser May-Britt (2006). Path integration and the neural basis of the 'cognitive map'. Nature Reviews Neuroscience 7 (8): 663–678. ISSN 1471-003X. doi:10.1038/nrn1932.
- Moser, Edvard I.; Kropff, Emilio; Moser, May-Britt (2008). Place Cells, Grid Cells, and the Brain's Spatial Representation System. Annual Review of Neuroscience 31 (1): 69–89. ISSN 0147-006X. doi:10.1146/annurev.neuro.31.061307.090723.
- Yartsev Michael M., Witter Menno P., Ulanovsky Nachum (2011). Grid cells without theta oscillations in the entorhinal cortex of bats. Nature 479 (7371): 103–107. ISSN 0028-0836. doi:10.1038/nature10583.
- Killian Nathaniel J., Jutras Michael J., Buffalo Elizabeth A. (2012). A map of visual space in the primate entorhinal cortex. Nature. ISSN 0028-0836. doi:10.1038/nature11587.
- Doeller, Christian F.; Barry, Caswell; Burgess, Neil (2010). Evidence for grid cells in a human memory network. Nature 463 (7281): 657–661. ISSN 0028-0836. doi:10.1038/nature08704.
- Bingman V. P. (2006). Neuronal Implementation of Hippocampal-Mediated Spatial Behavior: A Comparative Evolutionary Perspective. Behavioral and Cognitive Neuroscience Reviews 5 (2): 80–91. ISSN 1534-5823. doi:10.1177/1534582306289578.
- Moser, Edvard I.; Roudi, Yasser; Witter, Menno P.; Kentros, Clifford; Bonhoeffer, Tobias; Moser, May-Britt (2014). Grid cells and cortical representation. Nature Reviews Neuroscience 15 (7): 466–481. ISSN 1471-003X. doi:10.1038/nrn3766.
- O'Keefe, J.; Dostrovsky, J. (1971). The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat. Brain Research 34 (1): 171–175. ISSN 00068993. doi:10.1016/0006-8993(71)90358-1.
- Harris Kenneth D., Csicsvari Jozsef, Hirase Hajime, Dragoi George, Buzsáki György (2003). Organization of cell assemblies in the hippocampus. Nature 424 (6948): 552–556. ISSN 00280836. doi:10.1038/nature01834.
- Sargolini F. (2006). Conjunctive Representation of Position, Direction, and Velocity in Entorhinal Cortex. Science 312 (5774): 758–762. ISSN 0036-8075. doi:10.1126/science.1125572.
- Domnisoru Cristina, Kinkhabwala Amina A., Tank David W. (2013). Membrane potential dynamics of grid cells. Nature 495 (7440): 199–204. ISSN 0028-0836. doi:10.1038/nature11973.
- Fuhs Mark C. L. (2006). Space and Context in the Rodent Hippocampal Region (PhD thesis). Carnegie Mellon University. с. 237.
- O'Keefe John, Burgess Neil (2005). Dual phase and rate coding in hippocampal place cells: Theoretical significance and relationship to entorhinal grid cells. Hippocampus 15 (7): 853–866. ISSN 1050-9631. doi:10.1002/hipo.20115.
- Hubel David H. and Wiesel Torsten N. (1974). Sequence regularity and geometry of orientation columns in the monkey striate cortex. The Journal of Comparative Neurology 158 (3): 267–293. ISSN 0021-9967. doi:10.1002/cne.901580304.
- Mountcastle, V. (1997). The columnar organization of the neocortex. Brain 120 (4): 701–722. ISSN 14602156. doi:10.1093/brain/120.4.701.
- Stensola Hanne, Stensola Tor, Solstad Trygve, Frøland Kristian, Moser May-Britt, Moser Edvard I. (2012). The entorhinal grid map is discretized. Nature 492 (7427): 72–78. ISSN 0028-0836. doi:10.1038/nature11649.
- Tolman Edward C. (1948). Cognitive maps in rats and men.. Psychological Review 55 (4): 189–208. ISSN 0033-295X. doi:10.1037/h0061626.
- Tolman, E. C.; Ritchie, B. F.; Kalish, D. (1946). Studies in spatial learning. I. Orientation and the short-cut.. Journal of Experimental Psychology 36 (1): 13–24. ISSN 0022-1015. doi:10.1037/h0053944.
- Ranck, James B. (1973). Studies on single neurons in dorsal hippocampal formation and septum in unrestrained rats. Experimental Neurology 41 (2): 462–531. ISSN 00144886. doi:10.1016/0014-4886(73)90290-2.
- O'Keefe J., Nadel L. (1978). The hippocampus as a cognitive map. Clarendon Press. с. 570.
- O'Keefe, John (1979). A review of the hippocampal place cells. Progress in Neurobiology 13 (4): 419–439. ISSN 03010082. doi:10.1016/0301-0082(79)90005-4.
- Burgess, Neil; O'Keefe, John (1996). Neuronal computations underlying the firing of place cells and their role in navigation. Hippocampus 6 (6): 749–762. ISSN 1050-9631. doi:10.1002/(SICI)1098-1063(1996)6:6<749::AID-HIPO16>3.0.CO;2-0.
- O'Keefe, John (1976). Place units in the hippocampus of the freely moving rat. Experimental Neurology 51 (1): 78–109. ISSN 00144886. doi:10.1016/0014-4886(76)90055-8.
- Redish, A. David; Touretzky, David S. (1997). Cognitive maps beyond the hippocampus. Hippocampus 7 (1): 15–35. ISSN 1050-9631. doi:10.1002/(SICI)1098-1063(1997)7:1<15::AID-HIPO3>3.0.CO;2-6.
- Bostock, Elizabeth; Muller, Robert U.; Kubie, John L. (1991). Experience-dependent modifications of hippocampal place cell firing. Hippocampus 1 (2): 193–205. ISSN 1050-9631. doi:10.1002/hipo.450010207.
- Colgin, Laura Lee; Moser, Edvard I.; Moser, May-Britt (2008). Understanding memory through hippocampal remapping. Trends in Neurosciences 31 (9): 469–477. ISSN 01662236. doi:10.1016/j.tins.2008.06.008.
- Brun, V. H. (2002). Place Cells and Place Recognition Maintained by Direct Entorhinal-Hippocampal Circuitry. Science 296 (5576): 2243–2246. ISSN 00368075. doi:10.1126/science.1071089.
- McNaughton, B. L.; Barnes, C. A.; Meltzer, J.; Sutherland, R. J. (1989). Hippocampal granule cells are necessary for normal spatial learning but not for spatially-selective pyramidal cell discharge. Experimental Brain Research 76 (3): 485–496. ISSN 0014-4819. doi:10.1007/BF00248904.
- Quirk GJ, Muller RU, Kubie JL, and Ranck JB Jr (1992). The positional firing properties of medial entorhinal neurons: description and comparison with hippocampal place cells. Journal of Neuroscience 12 (5): 1945–1963. PMID 1578279.
- Frank L., Brown E.N. and Wilson M. (2000). Trajectory Encoding in the Hippocampus and Entorhinal Cortex. Neuron 27 (1): 169–178. ISSN 08966273. doi:10.1016/S0896-6273(00)00018-0.
- Barnes, Carol A.; McNaughton, Bruce L.; Mizumori, Shed J.Y.; Leonard, Brian W.; Lin, Lei-Huey (1990). Chapter 21 Chapter Comparison of spatial and temporal characteristics of neuronal activity in sequential stages of hippocampal processing 83. с. 287–300. ISSN 00796123. doi:10.1016/S0079-6123(08)61257-1.
- Carboni, A. A.; Lavelle, W. G.; Barnes, C. L.; Cipolloni, P. B. (1990). Neurons of the lateral entorhinal cortex of the rhesus monkey: A golgi, histochemical, and immunocytochemical characterization. The Journal of Comparative Neurology 291 (4): 583–608. ISSN 0021-9967. doi:10.1002/cne.902910407.
- Mizumori, S.J.Y.; Ward, K.E.; Lavoie, A.M. (1992). Medial septal modulation of entorhinal single unit activity in anesthetized and freely moving rats. Brain Research 570 (1-2): 188–197. ISSN 00068993. doi:10.1016/0006-8993(92)90581-S.
- Fyhn M., Molden S., Witter M.P., Moser E.I. and Moser M.-B. (2004). Spatial Representation in the Entorhinal Cortex. Science 305 (5688): 1258–1264. ISSN 0036-8075. doi:10.1126/science.1099901.
- Moser, May-Britt; Moser, Edvard I. (2011). Crystals of the brain. EMBO Molecular Medicine 3 (2): 69–71. ISSN 17574676. doi:10.1002/emmm.201000118.
- Moser, Edvard I.; Moser, May-Britt (2013). Grid Cells and Neural Coding in High-End Cortices. Neuron 80 (3): 765–774. ISSN 08966273. doi:10.1016/j.neuron.2013.09.043.
- Moser E, Moser MB and Andersen P (1993). Spatial learning impairment parallels the magnitude of dorsal hippocampal lesions, but is hardly present following ventral lesions. Journal of Neuroscience 13 (9): 3916–3925.
- Witter MP, Van Hoesen GW, and Amaral DG (1989). Topographical organization of the entorhinal projection to the dentate gyrus of the monkey. The Journal of Neuroscience 9 (1): 216–228.
- Witter, Menno P.; Groenewegen, Henk J. (1984). Laminar origin and septotemporal distribution of entorhinal and perirhinal projections to the hippocampus in the cat. Journal of Comparative Neurology 224 (3): 371–385. ISSN 00219967. doi:10.1002/cne.902240305.
- Steffenach, Hill-Aina; Witter, Menno; Moser, May-Britt; Moser, Edvard I. (2005). Spatial Memory in the Rat Requires the Dorsolateral Band of the Entorhinal Cortex. Neuron 45 (2): 301–313. ISSN 08966273. doi:10.1016/j.neuron.2004.12.044.
- Van Cauter, T.; Camon, J.; Alvernhe, A.; Elduayen, C.; Sargolini, F.; Save, E. (2012). Distinct Roles of Medial and Lateral Entorhinal Cortex in Spatial Cognition. Cerebral Cortex 23 (2): 451–459. ISSN 1047-3211. doi:10.1093/cercor/bhs033.
- Best, Phillip J.; White, Aaron M.; Minai, Ali (2001). SPATIALPROCESSING IN THEBRAIN: The Activity of Hippocampal Place Cells. Annual Review of Neuroscience 24 (1): 459–486. ISSN 0147-006X. doi:10.1146/annurev.neuro.24.1.459.
- Savelli, Francesco; Yoganarasimha, D.; Knierim, James J. (2008). Influence of boundary removal on the spatial representations of the medial entorhinal cortex. Hippocampus 18 (12): 1270–1282. ISSN 10509631. doi:10.1002/hipo.20511.
- Solstad, T.; Boccara, C. N.; Kropff, E.; Moser, M.-B.; Moser, E. I. (2008). Representation of Geometric Borders in the Entorhinal Cortex. Science 322 (5909): 1865–1868. ISSN 0036-8075. doi:10.1126/science.1166466.
- Reifenstein, E. T.; Kempter, R.; Schreiber, S.; Stemmler, M. B.; Herz, A. V. M. (2012). Grid cells in rat entorhinal cortex encode physical space with independent firing fields and phase precession at the single-trial level. Proceedings of the National Academy of Sciences 109 (16): 6301–6306. ISSN 0027-8424. doi:10.1073/pnas.1109599109.
- O'Keefe John, Recce Michael L. (1993). Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus 3 (3): 317–330. ISSN 1050-9631. doi:10.1002/hipo.450030307.
- Hafting Torkel, Fyhn Marianne, Bonnevie Tora, Moser May-Britt, Moser Edvard I. (2008). Hippocampus-independent phase precession in entorhinal grid cells. Nature 453 (7199): 1248–1252. ISSN 0028-0836. doi:10.1038/nature06957.
- Barry, Caswell; Hayman, Robin; Burgess, Neil; Jeffery, Kathryn J (2007). Experience-dependent rescaling of entorhinal grids. Nature Neuroscience 10 (6): 682–684. ISSN 1097-6256. doi:10.1038/nn1905.
- Krupic J., Burges N. and O'Keefe J. (2012). Neural Representations of Location Composed of Spatially Periodic Bands. Science 337 (6096): 853–857. ISSN 0036-8075. doi:10.1126/science.1222403.
- Brun, Vegard Heimly; Solstad, Trygve; Kjelstrup, Kirsten Brun; Fyhn, Marianne; Witter, Menno P.; Moser, Edvard I.; Moser, May-Britt (2008). Progressive increase in grid scale from dorsal to ventral medial entorhinal cortex. Hippocampus 18 (12): 1200–1212. ISSN 10509631. doi:10.1002/hipo.20504.
- Fyhn Marianne, Hafting Torkel, Treves Alessandro, Moser May-Britt, Moser Edvard I. (2007). Hippocampal remapping and grid realignment in entorhinal cortex. Nature 446 (7132): 190–194. ISSN 0028-0836. doi:10.1038/nature05601.
- Giocomo, Lisa M.; Hussaini, Syed A.; Zheng, Fan; Kandel, Eric R.; Moser, May-Britt; Moser, Edvard I. (2011). Grid Cells Use HCN1 Channels for Spatial Scaling. Cell 147 (5): 1159–1170. ISSN 00928674. doi:10.1016/j.cell.2011.08.051.
- Welinder Peter E., Burak Yoram, Fiete Ila R. (2008). Grid cells: The position code, neural network models of activity, and the problem of learning. Hippocampus 18 (12): 1283–1300. ISSN 10509631. doi:10.1002/hipo.20519.
- Bush, Daniel; Barry, Caswell; Burgess, Neil (2014). What do grid cells contribute to place cell firing?. Trends in Neurosciences 37 (3): 136–145. ISSN 01662236. doi:10.1016/j.tins.2013.12.003.
- A. David Redish (1999). Beyond the Cognitive Map: From Place Cells to Episodic Memory. MIT Press. с. 420. ISBN 0262181940.
- Derdikman, Dori; Whitlock, Jonathan R; Tsao, Albert; Fyhn, Marianne; Hafting, Torkel; Moser, May-Britt; Moser, Edvard I (2009). Fragmentation of grid cell maps in a multicompartment environment. Nature Neuroscience 12 (10): 1325–1332. ISSN 1097-6256. doi:10.1038/nn.2396.
- Derdikman, Dori; Moser, Edvard I. (2011). A Manifold of Spatial Maps in the Brain. с. 41–57. doi:10.1016/B978-0-12-385948-8.00004-9.
- Worden, Robert (1992). Navigation by fragment fitting: A theory of hippocampal function. Hippocampus 2 (2): 165–187. ISSN 1050-9631. doi:10.1002/hipo.450020208.
- Burak Yoram (2014). Spatial coding and attractor dynamics of grid cells in the entorhinal cortex. Current Opinion in Neurobiology 25: 169–175. ISSN 09594388. doi:10.1016/j.conb.2014.01.013.
- Witter Menno P. and Moser Edvard I. (2006). Spatial representation and the architecture of the entorhinal cortex. Trends in Neurosciences 29 (12): 671–678. ISSN 01662236. doi:10.1016/j.tins.2006.10.003.
- Kjelstrup, K. B.; Solstad, T.; Brun, V. H.; Hafting, T.; Leutgeb, S.; Witter, M. P.; Moser, E. I.; Moser, M.-B. (2008). Finite Scale of Spatial Representation in the Hippocampus. Science 321 (5885): 140–143. ISSN 0036-8075. doi:10.1126/science.1157086.
- Si, Bailu; Kropff, Emilio; Treves, Alessandro (2012). Grid alignment in entorhinal cortex. Biological Cybernetics 106 (8-9): 483–506. ISSN 0340-1200. doi:10.1007/s00422-012-0513-7.
- Bonhoeffer, Tobias; Grinvald, Amiram (1991). Iso-orientation domains in cat visual cortex are arranged in pinwheel-like patterns. Nature 353 (6343): 429–431. ISSN 0028-0836. doi:10.1038/353429a0.
- Hölscher, Christian (2003). Time, Space and Hippocampal Functions. Reviews in the Neurosciences 14 (3). ISSN 2191-0200. doi:10.1515/REVNEURO.2003.14.3.253.
- Stettler, Dan D.; Axel, Richard (2009). Representations of Odor in the Piriform Cortex. Neuron 63 (6): 854–864. ISSN 08966273. doi:10.1016/j.neuron.2009.09.005.
- Bonin, V.; Histed, M. H.; Yurgenson, S.; Reid, R. C. (2011). Local Diversity and Fine-Scale Organization of Receptive Fields in Mouse Visual Cortex. Journal of Neuroscience 31 (50): 18506–18521. ISSN 0270-6474. doi:10.1523/JNEUROSCI.2974-11.2011.
- Blasdel, Gary G.; Salama, Guy (1986). Voltage-sensitive dyes reveal a modular organization in monkey striate cortex. Nature 321 (6070): 579–585. ISSN 0028-0836. doi:10.1038/321579a0.
- Payne, B.R.; Berman, N.; Murphy, E.H. (1981). Organization of direction preferences in cat visual cortex. Brain Research 211 (2): 445–450. ISSN 00068993. doi:10.1016/0006-8993(81)90971-9.
- Sporns, Olaf; Burak, Yoram; Fiete, Ila R. (2009). Accurate Path Integration in Continuous Attractor Network Models of Grid Cells. PLoS Computational Biology 5 (2): e1000291. ISSN 1553-7358. doi:10.1371/journal.pcbi.1000291.
- Sreenivasan, Sameet; Fiete, Ila (2011). Grid cells generate an analog error-correcting code for singularly precise neural computation. Nature Neuroscience 14 (10): 1330–1337. ISSN 1097-6256. doi:10.1038/nn.2901.
- Samu, Dávid; Erős, Péter; Ujfalussy, Balázs; Kiss, Tamás (2009). Robust path integration in the entorhinal grid cell system with hippocampal feed-back. Biological Cybernetics 101 (1): 19–34. ISSN 0340-1200. doi:10.1007/s00422-009-0311-z.
- Fiete, I. R.; Burak, Y.; Brookings, T. (2008). What Grid Cells Convey about Rat Location. Journal of Neuroscience 28 (27): 6858–6871. ISSN 0270-6474. doi:10.1523/JNEUROSCI.5684-07.2008.
- Burak Yoram, Brookings Ted, Fiete Ila (2006). Triangular lattice neurons may implement an advanced numeral system to precisely encode rat position over large ranges. arXiv: 1–4.
- Amos R. Omondi; Benjamin Premkumar (2007). Residue Number Systems: Theory and Implementation. Imperial College Press. ISBN 978-1-86094-866-4.
- Gorchetchnikov, Anatoli; Grossberg, Stephen (2007). Space, time and learning in the hippocampus: How fine spatial and temporal scales are expanded into population codes for behavioral control. Neural Networks 20 (2): 182–193. ISSN 08936080. doi:10.1016/j.neunet.2006.11.007.
- Russell, James C.; McMorland, Angus J.C.; MacKay, Jamie W.B. (2010). Exploratory behaviour of colonizing rats in novel environments. Animal Behaviour 79 (1): 159–164. ISSN 00033472. doi:10.1016/j.anbehav.2009.10.020.
- Mathis, Alexander; Herz, Andreas V. M.; Stemmler, Martin (2012). Optimal Population Codes for Space: Grid Cells Outperform Place Cells. Neural Computation 24 (9): 2280–2317. ISSN 0899-7667. doi:10.1162/NECO_a_00319.
- Mathis, Alexander; Herz, Andreas V. M.; Stemmler, Martin B. (2013). Multiscale codes in the nervous system: The problem of noise correlations and the ambiguity of periodic scales. Physical Review E 88 (2). ISSN 1539-3755. doi:10.1103/PhysRevE.88.022713.
- Alexander Mathis (2012). The Representation of Space in Mammals: Resolution of Stochastic Place and Grid Codes (PhD dissertation). Universitätsbibliothek der Ludwig-Maximilians-Universität.
- Mathis, Alexander; Herz, Andreas V. M.; Stemmler, Martin B. (2012). Resolution of Nested Neuronal Representations Can Be Exponential in the Number of Neurons. Physical Review Letters 109 (1). ISSN 0031-9007. doi:10.1103/PhysRevLett.109.018103.
- Wei, X.‑X., Prentice, J. & Balasubramanian (2013). abs/1304.0031 The sense of place: grid cells in the brain and the transcendental number e. arXiv: 466–481.
- Ratliff, C. P.; Borghuis, B. G.; Kao, Y.-H.; Sterling, P.; Balasubramanian, V. (2010). Retina is structured to process an excess of darkness in natural scenes. Proceedings of the National Academy of Sciences 107 (40): 17368–17373. ISSN 0027-8424. doi:10.1073/pnas.1005846107.
- Gjorgjieva, J.; Sompolinsky, H.; Meister, M. (2014). Benefits of Pathway Splitting in Sensory Coding. Journal of Neuroscience 34 (36): 12127–12144. ISSN 0270-6474. doi:10.1523/JNEUROSCI.1032-14.2014.
- Conway J. H. and Sloane N.J.A. (January 1999). Sphere Packings, Lattices and Groups. Springer Science & Business Media. ISBN 978-0-387-98585-5.
- Ram Zamir (7 серпня 2014). Lattice Coding for Signals and Networks: A Structured Coding Approach to Quantization, Modulation, and Multiuser Information Theory. Cambridge University Press. ISBN 978-0-521-76698-2.
- Guanella Alexis and Verschure Paul F. M. J. (2007). Prediction of the position of an animal based on populations of grid and place cells: a comparative simulation study. Journal of Integrative Neuroscience 06 (03): 433–446. ISSN 0219-6352. doi:10.1142/S0219635207001556.
- Tóth, G. Fejes (1973). Sum of moments of convex polygons. Acta Mathematica Academiae Scientiarum Hungaricae 24 (3-4): 417–421. ISSN 0001-5954. doi:10.1007/BF01958055.
- Ласло Фейеш Тот (1958). Расположения на плоскости, на сфере и в пространстве: Пер. с нем. Государственное издательство физико-математической литературы.
- Robert G. Gallager (28 лютого 2008). Principles of Digital Communication. Cambridge University Press. ISBN 978-1-139-46860-2.
- Allen Gersho and Robert M. Gray (1992). Vector Quantization and Signal Compression. Springer Science & Business Media. ISBN 978-0-7923-9181-4.
- Fuhs M. C. & Touretzky D.S. (2006). A Spin Glass Model of Path Integration in Rat Medial Entorhinal Cortex. Journal of Neuroscience 26 (16): 4266–4276. ISSN 0270-6474. doi:10.1523/JNEUROSCI.4353-05.2006.
- Muller RU, Kubie JL (1987). The effects of changes in the environment on the spatial firing of hippocampal complex-spike cells.. Journal of Neuroscience 7 (7): 1951–68. PMID 3612226.
- Monaco, J. D.; Abbott, L. F. (2011). Modular Realignment of Entorhinal Grid Cell Activity as a Basis for Hippocampal Remapping. Journal of Neuroscience 31 (25): 9414–9425. ISSN 0270-6474. doi:10.1523/JNEUROSCI.1433-11.2011.
- Alonso A and Klink R. (1993). Differential electroresponsiveness of stellate and pyramidal-like cells of medial entorhinal cortex layer II.. Journal of Neurophysiology 1 (70): 128–43. PMID 8395571.
- Gatome, C.W.; Slomianka, L.; Lipp, H.P.; Amrein, I. (2010). Number estimates of neuronal phenotypes in layer II of the medial entorhinal cortex of rat and mouse. Neuroscience 170 (1): 156–165. ISSN 03064522. doi:10.1016/j.neuroscience.2010.06.048.
- Steward, Oswald; Scoville, Sheila A. (1976). Cells of origin of entorhinal cortical afferents to the hippocampus and fascia dentata of the rat. The Journal of Comparative Neurology 169 (3): 347–370. ISSN 0021-9967. doi:10.1002/cne.901690306.
- Zhang, S.-J.; Ye, J.; Miao, C.; Tsao, A.; Cerniauskas, I.; Ledergerber, D.; Moser, M.-B.; Moser, E. I. (2013). Optogenetic Dissection of Entorhinal-Hippocampal Functional Connectivity. Science 340 (6128): 1232627–1232627. ISSN 0036-8075. doi:10.1126/science.1232627.
- Nolan, M. F.; Dudman, J. T.; Dodson, P. D.; Santoro, B. (2007). HCN1 Channels Control Resting and Active Integrative Properties of Stellate Cells from Layer II of the Entorhinal Cortex. Journal of Neuroscience 27 (46): 12440–12451. ISSN 0270-6474. doi:10.1523/JNEUROSCI.2358-07.2007.
- Schmidt-Hieber, Christoph; Häusser, Michael (2013). Cellular mechanisms of spatial navigation in the medial entorhinal cortex. Nature Neuroscience 16 (3): 325–331. ISSN 1097-6256. doi:10.1038/nn.3340.
- Pastoll, Hugh; Ramsden, Helen L.; Nolan, Matthew F. (2012). Intrinsic electrophysiological properties of entorhinal cortex stellate cells and their contribution to grid cell firing fields. Frontiers in Neural Circuits 6. ISSN 1662-5110. doi:10.3389/fncir.2012.00017.
- Garden, Derek L.F.; Dodson, Paul D.; O'Donnell, Cian; White, Melanie D.; Nolan, Matthew F. (2008). Tuning of Synaptic Integration in the Medial Entorhinal Cortex to the Organization of Grid Cell Firing Fields. Neuron 60 (5): 875–889. ISSN 08966273. doi:10.1016/j.neuron.2008.10.044.
- Quilichini, P.; Sirota, A.; Buzsaki, G. (2010). Intrinsic Circuit Organization and Theta-Gamma Oscillation Dynamics in the Entorhinal Cortex of the Rat. Journal of Neuroscience 30 (33): 11128–11142. ISSN 0270-6474. doi:10.1523/JNEUROSCI.1327-10.2010.
- Haas, J. S. (2002). Frequency Selectivity of Layer II Stellate Cells in the Medial Entorhinal Cortex. Journal of Neurophysiology 88 (5): 2422–2429. ISSN 0022-3077. doi:10.1152/jn.00598.2002.
- Schreiber, S. (2004). Subthreshold Resonance Explains the Frequency-Dependent Integration of Periodic as Well as Random Stimuli in the Entorhinal Cortex. Journal of Neurophysiology 92 (1): 408–415. ISSN 0022-3077. doi:10.1152/jn.01116.2003.
- Fernandez, F. R.; Malerba, P.; Bressloff, P. C.; White, J. A. (2013). Entorhinal Stellate Cells Show Preferred Spike Phase-Locking to Theta Inputs That Is Enhanced by Correlations in Synaptic Activity. Journal of Neuroscience 33 (14): 6027–6040. ISSN 0270-6474. doi:10.1523/JNEUROSCI.3892-12.2013.
- Ray, S.; Naumann, R.; Burgalossi, A.; Tang, Q.; Schmidt, H.; Brecht, M. (2014). Grid-Layout and Theta-Modulation of Layer 2 Pyramidal Neurons in Medial Entorhinal Cortex. Science 343 (6173): 891–896. ISSN 0036-8075. doi:10.1126/science.1243028.
- Erchova, I; Kreck, G; Heinemann, U; Herz, A. V. M (2004). Dynamics of rat entorhinal cortex layer II and III cells: characteristics of membrane potential resonance at rest predict oscillation properties near threshold. The Journal of Physiology 560 (1): 89–110. ISSN 0022-3751. doi:10.1113/jphysiol.2004.069930.
- Heys, J. G.; MacLeod, K. M.; Moss, C. F.; Hasselmo, M. E. (2013). Bat and Rat Neurons Differ in Theta-Frequency Resonance Despite Similar Coding of Space. Science 340 (6130): 363–367. ISSN 0036-8075. doi:10.1126/science.1233831.
- Alonso, Angel; Llinás, Rodolfo R. (1989). Subthreshold Na+-dependent theta-like rhythmicity in stellate cells of entorhinal cortex layer II. Nature 342 (6246): 175–177. ISSN 0028-0836. doi:10.1038/342175a0.
- Giocomo, L. M.; Zilli, E. A.; Fransen, E.; Hasselmo, M. E. (2007). Temporal Frequency of Subthreshold Oscillations Scales with Entorhinal Grid Cell Field Spacing. Science 315 (5819): 1719–1722. ISSN 0036-8075. doi:10.1126/science.1139207.
- Schmidt-Hieber, C.; Hausser, M. (2013). How to build a grid cell. Philosophical Transactions of the Royal Society B: Biological Sciences 369 (1635): 20120520–20120520. ISSN 0962-8436. doi:10.1098/rstb.2012.0520.
- Harvey, Christopher D.; Collman, Forrest; Dombeck, Daniel A.; Tank, David W. (2009). Intracellular dynamics of hippocampal place cells during virtual navigation. Nature 461 (7266): 941–946. ISSN 0028-0836. doi:10.1038/nature08499.
- Couey, Jonathan J; Witoelar, Aree; Zhang, Sheng-Jia; Zheng, Kang; Ye, Jing; Dunn, Benjamin; Czajkowski, Rafal; Moser, May-Britt; Moser, Edvard I; Roudi, Yasser; Witter, Menno P (2013). Recurrent inhibitory circuitry as a mechanism for grid formation. Nature Neuroscience 16 (3): 318–324. ISSN 1097-6256. doi:10.1038/nn.3310.
- Pastoll, Hugh; Solanka, Lukas; van Rossum, Mark C.W.; Nolan, Matthew F. (2013). Feedback Inhibition Enables Theta-Nested Gamma Oscillations and Grid Firing Fields. Neuron 77 (1): 141–154. ISSN 08966273. doi:10.1016/j.neuron.2012.11.032.
- Wills, T. J.; Cacucci, F.; Burgess, N.; O'Keefe, J. (2010). Development of the Hippocampal Cognitive Map in Preweanling Rats. Science 328 (5985): 1573–1576. ISSN 0036-8075. doi:10.1126/science.1188224.
- Langston, R. F.; Ainge, J. A.; Couey, J. J.; Canto, C. B.; Bjerknes, T. L.; Witter, M. P.; Moser, E. I.; Moser, M.-B. (2010). Development of the Spatial Representation System in the Rat. Science 328 (5985): 1576–1580. ISSN 0036-8075. doi:10.1126/science.1188210.
- Wills, T. J.; Muessig, L.; Cacucci, F. (2013). The development of spatial behaviour and the hippocampal neural representation of space. Philosophical Transactions of the Royal Society B: Biological Sciences 369 (1635): 20130409–20130409. ISSN 0962-8436. doi:10.1098/rstb.2013.0409.
- Yartsev, M. M.; Ulanovsky, N. (2013). Representation of Three-Dimensional Space in the Hippocampus of Flying Bats. Science 340 (6130): 367–372. ISSN 0036-8075. doi:10.1126/science.1235338.
- Rolls, Edmund T.; O'Mara, Shane M. (1995). View-responsive neurons in the primate hippocampal complex. Hippocampus 5 (5): 409–424. ISSN 1050-9631. doi:10.1002/hipo.450050504.
- Rolls, Edmund T.; Robertson, Robert G.; Georges-François, Pierre (1997). Spatial View Cells in the Primate Hippocampus. European Journal of Neuroscience 9 (8): 1789–1794. ISSN 0953816X. doi:10.1111/j.1460-9568.1997.tb01538.x.
- Jacobs, Joshua; Weidemann, Christoph T; Miller, Jonathan F; Solway, Alec; Burke, John F; Wei, Xue-Xin; Suthana, Nanthia; Sperling, Michael R; Sharan, Ashwini D; Fried, Itzhak; Kahana, Michael J (2013). Direct recordings of grid-like neuronal activity in human spatial navigation. Nature Neuroscience 16 (9): 1188–1190. ISSN 1097-6256. doi:10.1038/nn.3466.
- Etienne, Ariane S.; Jeffery, Kathryn J. (2004). Path integration in mammals. Hippocampus 14 (2): 180–192. ISSN 1050-9631. doi:10.1002/hipo.10173.
- Mittelstaedt, M. -L.; Mittelstaedt, H. (1980). Homing by path integration in a mammal. Naturwissenschaften 67 (11): 566–567. ISSN 0028-1042. doi:10.1007/BF00450672.
- van Strien, N. M.; Cappaert, N. L. M.; Witter, M. P. (2009). The anatomy of memory: an interactive overview of the parahippocampal–hippocampal network. Nature Reviews Neuroscience 10 (4): 272–282. ISSN 1471-003X. doi:10.1038/nrn2614.
- Allen, T. A.; Fortin, N. J. (2013). The evolution of episodic memory. Proceedings of the National Academy of Sciences 110 (Supplement_2): 10379–10386. ISSN 0027-8424. doi:10.1073/pnas.1301199110.
- Naya, Y.; Suzuki, W. A. (2011). Integrating What and When Across the Primate Medial Temporal Lobe. Science 333 (6043): 773–776. ISSN 0036-8075. doi:10.1126/science.1206773.
- Lavenex, Pierre; Amaral, David G. (2000). Hippocampal-neocortical interaction: A hierarchy of associativity. Hippocampus 10 (4): 420–430. ISSN 1050-9631. doi:10.1002/1098-1063(2000)10:4<420::AID-HIPO8>3.0.CO;2-5.
- Suzuki, W; Amaral, D (2004). Functional Neuroanatomy of the Medial Temporal Lobe Memory System. Cortex 40 (1): 220–222. ISSN 00109452. doi:10.1016/S0010-9452(08)70958-4.
- Furtak, Sharon C.; Wei, Shau-Ming; Agster, Kara L.; Burwell, Rebecca D. (2007). Functional neuroanatomy of the parahippocampal region in the rat: The perirhinal and postrhinal cortices. Hippocampus 17 (9): 709–722. ISSN 10509631. doi:10.1002/hipo.20314.
- Takehara-Nishiuchi, Kaori (2014). Entorhinal cortex and consolidated memory. Neuroscience Research 84: 27–33. ISSN 01680102. doi:10.1016/j.neures.2014.02.012.
- Kohler Christer (1986). Intrinsic connections of the retrohippocampal region in the rat brain. II. The medial entorhinal area. The Journal of Comparative Neurology 246 (2): 149–169. ISSN 0021-9967. doi:10.1002/cne.902460202.
- Dolorfo Cynthia L. and Amaral David G. (1998). Entorhinal cortex of the rat: Organization of intrinsic connections. The Journal of Comparative Neurology 398 (1): 49–82. ISSN 0021-9967. doi:10.1002/(SICI)1096-9861(19980817)398:1<49::AID-CNE4>3.0.CO;2-9.
- Lingenhohl, K.; Finch, D.M. (1991). Morphological characterization of rat entorhinal neurons in vivo: soma-dendritic structure and axonal domains. Experimental Brain Research 84 (1). ISSN 0014-4819. doi:10.1007/BF00231762.
- van Haeften, Theo; Baks-te-Bulte, L.; Goede, Peter H.; Wouterlood, Floris G.; Witter, Menno P. (2003). Morphological and numerical analysis of synaptic interactions between neurons in deep and superficial layers of the entorhinal cortex of the rat. Hippocampus 13 (8): 943–952. ISSN 1050-9631. doi:10.1002/hipo.10144.
- Buzsáki, György; Moser, Edvard I (2013). Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nature Neuroscience 16 (2): 130–138. ISSN 1097-6256. doi:10.1038/nn.3304.
- Eichenbaum, H; Dudchenko, P; Wood, E; Shapiro, M; Tanila, H (1999). The Hippocampus, Memory, and Place CellsIs It Spatial Memory or a Memory Space?. Neuron 23 (2): 209–226. ISSN 08966273. doi:10.1016/S0896-6273(00)80773-4.
- Buzsáki, György (2005). Theta rhythm of navigation: Link between path integration and landmark navigation, episodic and semantic memory. Hippocampus 15 (7): 827–840. ISSN 1050-9631. doi:10.1002/hipo.20113.
- Hasselmo, M.E. (2011). How We Remember: Brain Mechanisms of Episodic Memory. MIT Press. с. 384. ISBN 9780262016353.
- Menzel, Randolf; Geiger, Karl; Joerges, Jasdan; Müller, Uli; Chittka, Lars (1998). Bees travel novel homeward routes by integrating separately acquired vector memories. Animal Behaviour 55 (1): 139–152. ISSN 00033472. doi:10.1006/anbe.1997.0574.
- Wilson, M.; McNaughton, B. (1993). Dynamics of the hippocampal ensemble code for space. Science 261 (5124): 1055–1058. ISSN 0036-8075. doi:10.1126/science.8351520.
- Burgess, Neil; Maguire, Eleanor A; O'Keefe, John (2002). The Human Hippocampus and Spatial and Episodic Memory. Neuron 35 (4): 625–641. ISSN 08966273. doi:10.1016/S0896-6273(02)00830-9.
- Jensen, Ole; Lisman, John E. (2005). Hippocampal sequence-encoding driven by a cortical multi-item working memory buffer. Trends in Neurosciences 28 (2): 67–72. ISSN 01662236. doi:10.1016/j.tins.2004.12.001.
- Lisman, John E (1999). Relating Hippocampal Circuitry to Function. Neuron 22 (2): 233–242. ISSN 08966273. doi:10.1016/S0896-6273(00)81085-5.
- Howard, Marc W.; Kahana, Michael J. (1999). Contextual variability and serial position effects in free recall.. Journal of Experimental Psychology: Learning, Memory, and Cognition 25 (4): 923–941. ISSN 0278-7393. doi:10.1037/0278-7393.25.4.923.
- Rowland, David C; Moser, May-Britt (2014). From cortical modules to memories. Current Opinion in Neurobiology 24: 22–27. ISSN 09594388. doi:10.1016/j.conb.2013.08.012.
- Jezek, Karel; Henriksen, Espen J.; Treves, Alessandro; Moser, Edvard I.; Moser, May-Britt (2011). Theta-paced flickering between place-cell maps in the hippocampus. Nature 478 (7368): 246–249. ISSN 0028-0836. doi:10.1038/nature10439.
- Muller RU and Kubie JL (1987). The effects of changes in the environment on the spatial firing of hippocampal complex-spike cells. Journal of Neuroscience=7 (7): 1951–1968.
- Leutgeb, S. (2005). Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science 309 (5734): 619–623. ISSN 0036-8075. doi:10.1126/science.1114037.
- Hubel, D. H. & Wiesel, T. N. (1962). Receptive fields, binocular interaction and functional architecture in the cat's visual cortex. Journal of Physiology=7 (160): 106–154.
- Solstad, Trygve; Moser, Edvard I.; Einevoll, Gaute T. (2006). From grid cells to place cells: A mathematical model. Hippocampus 16 (12): 1026–1031. ISSN 10509631. doi:10.1002/hipo.20244.
- Van Cauter, Tiffany; Poucet, Bruno; Save, Etienne (2008). Unstable CA1 place cell representation in rats with entorhinal cortex lesions. European Journal of Neuroscience 27 (8): 1933–1946. ISSN 0953-816X. doi:10.1111/j.1460-9568.2008.06158.x.
- Molter, Colin; Yamaguchi, Yoko (2008). Impact of temporal coding of presynaptic entorhinal cortex grid cells on the formation of hippocampal place fields. Neural Networks 21 (2-3): 303–310. ISSN 08936080. doi:10.1016/j.neunet.2007.12.032.
- Savelli, F.; Knierim, J. J. (2010). Hebbian Analysis of the Transformation of Medial Entorhinal Grid-Cell Inputs to Hippocampal Place Fields. Journal of Neurophysiology 103 (6): 3167–3183. ISSN 0022-3077. doi:10.1152/jn.00932.2009.
- Rolls, Edmund T.; Stringer, Simon M.; Elliot, Thomas (2006). Entorhinal cortex grid cells can map to hippocampal place cells by competitive learning. Network: Computation in Neural Systems 17 (4): 447–465. ISSN 0954-898X. doi:10.1080/09548980601064846.
- de Almeida, L.; Idiart, M.; Lisman, J. E. (2009). The Input-Output Transformation of the Hippocampal Granule Cells: From Grid Cells to Place Fields. Journal of Neuroscience 29 (23): 7504–7512. ISSN 0270-6474. doi:10.1523/JNEUROSCI.6048-08.2009.
- Si, Bailu; Treves, Alessandro (2009). The role of competitive learning in the generation of DG fields from EC inputs. Cognitive Neurodynamics 3 (2): 177–187. ISSN 1871-4080. doi:10.1007/s11571-009-9079-z.
- O'Keefe, John; Burgess, Neil (1996). Geometric determinants of the place fields of hippocampal neurons. Nature 381 (6581): 425–428. ISSN 0028-0836. doi:10.1038/381425a0.
- Barry, C.; Lever, C.; Hayman, R.; Hartley, T.; Burton, S.; O'Keefe, J.; Jeffery, K.; Burgess, Ν. (2006). The Boundary Vector Cell Model of Place Cell Firing and Spatial Memory. Reviews in the Neurosciences 17 (1-2). ISSN 2191-0200. doi:10.1515/REVNEURO.2006.17.1-2.71.
- Hartley, Tom; Burgess, N.; Lever, C.; Cacucci, F.; O'Keefe, J. (2000). Modeling place fields in terms of the cortical inputs to the hippocampus. Hippocampus 10 (4): 369–379. ISSN 1050-9631. doi:10.1002/1098-1063(2000)10:4<369::AID-HIPO3>3.0.CO;2-0.
- Lever, C.; Burton, S.; Jeewajee, A.; O'Keefe, J.; Burgess, N. (2009). Boundary Vector Cells in the Subiculum of the Hippocampal Formation. Journal of Neuroscience 29 (31): 9771–9777. ISSN 0270-6474. doi:10.1523/JNEUROSCI.1319-09.2009.
- O'Keefe, J.; Conway, D.H. (1978). Hippocampal place units in the freely moving rat: Why they fire where they fire. Experimental Brain Research 31 (4). ISSN 0014-4819. doi:10.1007/BF00239813.
- Bjerknes Tale L., Moser Edvard I., Moser May-Britt (2014). Representation of Geometric Borders in the Developing Rat. Neuron 82 (1): 71–78. ISSN 08966273. doi:10.1016/j.neuron.2014.02.014.
- Giocomo, Lisa M.; Moser, May-Britt; Moser, Edvard I. (2011). Computational Models of Grid Cells. Neuron 71 (4): 589–603. ISSN 08966273. doi:10.1016/j.neuron.2011.07.023.
- Canto, Cathrin B.; Wouterlood, Floris G.; Witter, Menno P. (2008). What Does the Anatomical Organization of the Entorhinal Cortex Tell Us?. Neural Plasticity 2008: 1–18. ISSN 2090-5904. doi:10.1155/2008/381243.
- Moser, Edvard I.; Moser, May-Britt (2008). A metric for space. Hippocampus 18 (12): 1142–1156. ISSN 10509631. doi:10.1002/hipo.20483.
- Bonnevie, Tora; Dunn, Benjamin; Fyhn, Marianne; Hafting, Torkel; Derdikman, Dori; Kubie, John L; Roudi, Yasser; Moser, Edvard I та ін. (2013). Grid cells require excitatory drive from the hippocampus. Nature Neuroscience 16 (3): 309–317. ISSN 1097-6256. doi:10.1038/nn.3311.
Література
Книги
- Michael E. Hasselmo (2012). How We Remember: Brain Mechanisms of Episodic Memory. MIT Press. ISBN 978-0-262-01635-3.
- Dori Derdikman and James J. Knierim, ред. (2014). Space,Time and Memory in the Hippocampal Formation. Springer Vienna. ISBN 978-3-7091-1291-5.
- John O'Keefe and Lynn Nadel (1978). The hippocampus as a cognitive map. Clarendon Press.
- A. David Redish (1999). Beyond the Cognitive Map: From Place Cells to Episodic Memory. MIT Press. с. 19–. ISBN 978-0-262-18194-5.
- Sheri J.Y. Mizumori, ред. (2008). Hippocampal Place Fields : Relevance to Learning and Memory: Relevance to Learning and Memory. Oxford University Press. ISBN 978-0-19-804345-4.
- Rodrigo Quian Quiroga and Stefano Panzeri, ред. (2013). Principles of Neural Coding. CRC Press. ISBN 978-1-4398-5330-6.
- Per Andersen, Richard Morris, David Amaral, Tim Bliss, John O'Keefe, ред. (2006). The Hippocampus Book. Oxford University Press. с. 637–. ISBN 978-0-19-988013-3.
- Shintaro Funahashi (2009). Representation and Brain. Springer Science & Business Media. с. 228–. ISBN 978-4-431-73021-7.
- Lars-Anders Hansson, Susanne Akesson, ред. (2014). Animal Movement Across Scales. OUP Oxford. с. 176–. ISBN 978-0-19-166487-8.
- Sue Healy (1998). Spatial Representation in Animals. Oxford University Press. ISBN 978-0-19-850007-0.
- Patricia E. Sharp, ред. (2001). The Neural Basis of Navigation: Evidence from Single Cell Recording. Springer Science & Business Media. с. 41–. ISBN 978-0-7923-7579-1.
- George Paxinos (2014). The Rat Nervous System. Academic Press. ISBN 978-0-08-092137-2.
- Charles Watson, George Paxinos, Luis Puelles (2011). The Mouse Nervous System. Academic Press. с. 15–. ISBN 978-0-08-091918-8.
Оглядові статті
- Казанович Я. Б., Мысин И. Е. Как животные ориентируются в пространстве? Клетки места и клетки решетки cтатя з журналу «Математическая биология и биоинформатика» Том 10, Випуск 1, Рік 2015
- Moser Edvard I., Kropff Emilio, Moser May-Britt (2008). Place Cells, Grid Cells, and the Brain's Spatial Representation System. Annual Review of Neuroscience 31 (1): 69–89. ISSN 0147-006X. doi:10.1146/annurev.neuro.31.061307.090723.
- Barry Caswell & Bush Daniel (2012). From A to Z: a potential role for grid cells in spatial navigation. Neural Systems & Circuits 2 (1): 6. ISSN 2042-1001. doi:10.1186/2042-1001-2-6.
- Moser Edvard I., Moser May-Britt (2013). Grid Cells and Neural Coding in High-End Cortices. Neuron 80 (3): 765–774. ISSN 08966273. doi:10.1016/j.neuron.2013.09.043.
- Moser Edvard I. & Moser May-Britt (2008). A metric for space. Hippocampus 18 (12): 1142–1156. ISSN 10509631. doi:10.1002/hipo.20483.
- Giocomo Lisa M., Moser May-Britt & Moser Edvard I. (2011). Computational Models of Grid Cells. Neuron 71 (4): 589–603. ISSN 08966273. doi:10.1016/j.neuron.2011.07.023.
- Welinder Peter E., Burak Yoram, Fiete Ila R. (2008). Grid cells: The position code, neural network models of activity, and the problem of learning. Hippocampus 18 (12): 1283–1300. ISSN 10509631. doi:10.1002/hipo.20519.
- Derdikman Dori & Moser Edvard I. (2011). A Manifold of Spatial Maps in the Brain. с. 41–57. doi:10.1016/B978-0-12-385948-8.00004-9.
- Buzsáki =György and Moser Edvard I (2013). Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nature Neuroscience 16 (2): 130–138. ISSN 1097-6256. doi:10.1038/nn.3304.
- Rowland David C. & Moser May-Britt (2014). From cortical modules to memories. Current Opinion in Neurobiology 24: 22–27. ISSN 09594388. doi:10.1016/j.conb.2013.08.012.
- Moser Edvard I., Roudi Yasser, Witter Menno P., Kentros Clifford, Bonhoeffer Tobias, Moser May-Britt (2014). Grid cells and cortical representation. Nature Reviews Neuroscience 15 (7): 466–481. ISSN 1471-003X. doi:10.1038/nrn3766.
- McNaughton Bruce L., Battaglia Francesco P., Jensen Ole, Moser Edvard, Moser May-Britt (2006). Path integration and the neural basis of the 'cognitive map'. Nature Reviews Neuroscience 7 (8): 663–678. ISSN 1471-003X. doi:10.1038/nrn1932.
- Canto Cathrin B., Wouterlood Floris G., Witter Menno P. (2008). What Does the Anatomical Organization of the Entorhinal Cortex Tell Us?. Neural Plasticity 2008: 1–18. ISSN 2090-5904. doi:10.1155/2008/381243.
- Schmidt-Hieber C. & Hausser M. (2013). How to build a grid cell. Philosophical Transactions of the Royal Society B: Biological Sciences 369 (1635): 20120520–20120520. ISSN 0962-8436. doi:10.1098/rstb.2012.0520.
- Burak Yoram (2014). Spatial coding and attractor dynamics of grid cells in the entorhinal cortex. Current Opinion in Neurobiology 25: 169–175. ISSN 09594388. doi:10.1016/j.conb.2014.01.013.
- Barry C. & Burgess N. (2014). Neural Mechanisms of Self-Location. Current Biology 24 (8): R330–R339. ISSN 09609822. doi:10.1016/j.cub.2014.02.049.
- Bush Daniel, Barry Caswell, Burgess Neil (2014). What do grid cells contribute to place cell firing?. Trends in Neurosciences 37 (3): 136–145. ISSN 01662236. doi:10.1016/j.tins.2013.12.003.
- Sasaki T., Leutgeb S., Leutgeb J.K. (2015). Spatial and memory circuits in the medial entorhinal cortex. Current Opinion in Neurobiology 32: 16–23. ISSN 09594388. doi:10.1016/j.conb.2014.10.008.
- Zilli Eric A. (2012). Models of Grid Cell Spatial Firing Published 2005–2011. Frontiers in Neural Circuits 6. ISSN 1662-5110. doi:10.3389/fncir.2012.00016.
