Період 5 періодичної системи елементів
До п'ятого періоду періодичної системи входять елементи п'ятого рядка періодичної системи хімічних елементів. Період містить вісімнадцять елементів: рубідій, стронцій, ітрій, цирконій, ніобій, молібден, технецій, рутеній, родій, паладій, срібло, кадмій, індій, олово, стибій, телур, йод і ксенон. Всі елементи цього періоду мають п'ять електронних оболонок. Перші два з них, рубідій і стронцій, входять в s-блок періодичної системи, тоді як інші відносяться до р-блоку. Як правило, елементи п'ятого періоду спочатку заповнюють 5s оболонки, а потім 4d і 5p оболонки, в зазначеному порядку, але є винятки, такі як родій.
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Uuh | Uus | Uuo | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| П'ятий період періодичної системи |
Елементи та їхні властивості
Хімічний елемент Група періодичної системи Електронна конфігурація 37 Rb Рубідій Лужні метали [Kr] 5s1 38 Sr Стронцій Лужноземельні метали [Kr] 5s2 39 Y Ітрій Перехідні метали [Kr] 4d1 5s2 40 Zr Цирконій Перехідні метали [Kr] 4d2 5s2 41 Nb Ніобій Перехідні метали [Kr] 4d4 5s1 42 Mo Молібден Перехідні метали [Kr] 4d5 5s1 43 Tc Технецій Перехідні метали [Kr] 4d5 5s2 44 Ru Рутеній Перехідні метали [Kr] 4d7 5s1 45 Rh Родій Перехідні метали [Kr] 4d8 5s1 46 Pd Паладій Перехідні метали [Kr] 4d10 47 Ag Аргентум Перехідні метали [Kr] 4d10 5s1 48 Cd Кадмій Перехідні метали [Kr] 4d10 5s2 49 In Індій Метали [Kr] 4d10 5s2 5p1 50 Sn Станум Метали [Kr] 4d10 5s2 5p2 51 Sb Стибій Напівметали [Kr] 4d10 5s2 5p3 52 Te Телур Напівметали [Kr] 4d10 5s2 5p4 53 I Йод Галогени [Kr] 4d10 5s2 5p5 54 Xe Ксенон Інертні гази [Kr] 4d10 5s2 5p6
Електронна оболонка
 Рубідій - Rb - 37
Рубідій - Rb - 37 Стронцій - Sr - 38
Стронцій - Sr - 38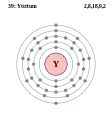 Ітрій - Y - 39
Ітрій - Y - 39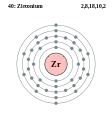 Цирконій - Zr - 40
Цирконій - Zr - 40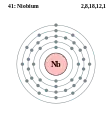 Ніобій - Nb - 41
Ніобій - Nb - 41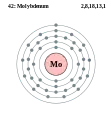 Молібден - Mo - 42
Молібден - Mo - 42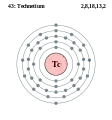 Технецій - Tc - 43
Технецій - Tc - 43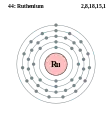 Рутеній - Ru - 44
Рутеній - Ru - 44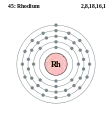 Родій - Rh - 45
Родій - Rh - 45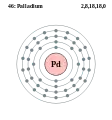 Паладій - Pd - 46
Паладій - Pd - 46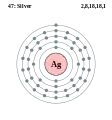 Срібло - Ag - 47
Срібло - Ag - 47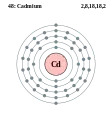 Кадмій - Cd - 48
Кадмій - Cd - 48 Індій - In - 49
Індій - In - 49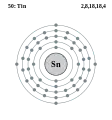 Олово - Sn - 50
Олово - Sn - 50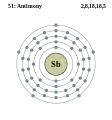 Стибій - Sb - 51
Стибій - Sb - 51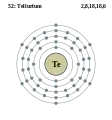 Телур - Te - 52
Телур - Te - 52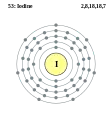 Йод - I - 53
Йод - I - 53 Ксенон - Xe - 54
Ксенон - Xe - 54
Фізичні властивості
Цей період відомий великою кількістю винятків з правила Маделунга (або правило Клечковського). Наприклад, технецій є одним з двох елементів періодичної системи, що не містить стабільних ізотопів, молібден і йод відомі своєю біологічною роллю, а ніобій має найбільшу магнітну проникність. В той час, коли цирконій є одним з основних компонентів кристалів циркону, найстаріших відомих мінералів в земній корі, а родій дуже часто використовується в ювелірних виробах через те, що він є неймовірно блискучим.
Елементи s-блоку
Рубідій

Рубідій — перший елемент п'ятого періоду, першої групи, лужний метал з атомним номером 37 і атомною масою 85,4678. Він знаходиться в найбільш реакційно-здатній групі періодичної таблиці, має схожі властивості з обома іншими лужними металами і деякими елементами п'ятого періоду. Наприклад, рубідій, як і всі елементи 5 періоду, має 5 електронних оболонок, але його електронна конфігурація схожа на конфігурацію лужних металів, бо закінчується на s1. Також рубідій має такий самий відтінок при горінні, як інший елемент першої групи — калій. Так як рубідій лужний метал, він легко окиснюється і утворює оксид рубідію — Rb2O.
У природі зустрічається у вигляді суміші стабільного ізотопу 85Rb (72,15 %) і радіоактивного ізотопу 87Rb (27,86 %) з періодом напіврозпаду 4,8.1010 років. Штучно отримано ще 26 радіоактивних ізотопів рубідію з масовими числами від 75 до 102 і періодами напіврозпаду від 37 мс (рубідій-102) до 86 днів (рубідій-83). А вміст рубідію в земній корі становить 7,8·10−3%. Це приблизно стільки ж, скільки нікелю, міді або цинку. За поширеністю в земній корі рубідій знаходиться приблизно на 20-му місці, проте в природі він знаходиться в розсіяному стані, рубідій — типовий розсіяний елемент.
Стронцій

Стронцій — другий елемент розміщений в 5-му періоді, відноситься до другої групи та лужноземельних металів, атомний номер 38 і атомна маса 87,62. Реакційна здатність групи дещо менше ніж лужних металів. Як і рубідій, він має 5 електронних оболонок, а також відповідно до правила Маделунга він має два електрони в 5s комірці. Стронцій є м'який метал і швидко реагує з водою. Якщо він контактує з водою, то буде поєднуватися з атомами кисню і водню з утворенням гідроксиду стронцію і чистого газоподібного водню, який швидко дифундує в повітрі. Крім того, стронцій, як рубідій, окислюється на повітрі і повертає жовтий колір. Горить з сильним червоним полум'ям.
Елементи d-блоку
Ітрій

Ітрій — хімічний елемент третьої групи із символом Y, атомним номером 39, атомною масою 88,90585. Це сріблясто-металевий перехідний метал, хімічно подібний на лантаноїди і часто класифікується як рідкоземельний елемент. Ітрій майже завжди знаходиться в поєднанні з лантаноїдами в рідкоземельних мінералах і ніколи не зустрічається в природі як вільний елемент. Його єдиний стабільний ізотоп — 89Y. Окиснюється на повітрі, при кімнатній температурі поглинає Н2, також реагує з Н2О, О2, HCI, HNO3 i H2SO4. Застосовують ітрій в створенні люмінофори, виробництві електродів, електролітів, електронних фільтрів, лазерів, надпровідників і як компонент в різних матеріалах для покращення властивостей.
Цирконій

Цирконій — хімічний елемент із символом Zr і атомним номером 40. Назва цирконій походить від мінералу Циркон. Його атомна маса 91,224. Це блискучий, сіро-білий, сильний перехідний метал, який нагадує титан. Особливістю цирконію є стійкість до корозії. Реагує з киснем, галогенами, поглинає водень і азот. При нагріванні взаємодіє з розчинами HF, концентрованою H2SO4 та царською горілкою. Використовується в сплавах. У природі існує 5 стабільних ізотопів 90Zr (51,46 %), 91Zr (11,23 %), 92Zr (17,11 %), 94Zr (17,40 %) і 96Zr (2,80 %).
Ніобій

Ніобій — хімічний елемент п'ятої групи із атомним номером 41, астомною масою 92,90638. Це м'який, сірий, ковкий перехідний метал. Назва походить від грецької богині Ніоби, дочки Тантала. За хімічними властивостями ніобій близький до танталу.
У 1801 р. англійським хіміком Ч. Гатчетом з мінералу, знайденого в Колумбії, уперше був виділений оксид нового елемента, названий колумбієм. У 1802 р. шведський хімік Андерс Ґустаф Екеберг виділив схожий оксид іншого елемента, названого танталом. Обидва елементи вважалися ідентичними, але в 1844 р. Г. Розе довів, що у всіх мінералах поряд з танталом присутній ще один елемент, вельми близький до нього за властивостями, який був ним названий ніобієм. Колумбіт Гатчета виявився сумішшю ніобію і танталу, але назва колумбіт аж до 1949 р. зберігалася за ніобієм, поки не було прийняте рішення залишити за елементом назву ніобій.
Обидва елементи надзвичайно стійкі на холоді і при невеликому нагріванні до дії багатьох агресивних середовищ. Ніобій активно реагує з багатьма неметалами: галогеном, азотом, воднем, вуглецем, сіркою. При цьому ніобій може проявляти різні валентності— від двох до п'яти. Також цей елемент утворює ніобієві кислоти, які у свою чергу — ніобати, солі ніобієвих кислот та фторніобати— подвійні солі.
Молібден

Молібден — хімічний елемент шостої групи періодичної таблиці з атомним номером 42 та атомною масою 95,94. Він має хороші електропровідні властивості, кращі ніж у платини, нікелю, ртуті, заліза і багатьох інших металів. Також є стійким навіть у вологому повітрі. Реакційна здатність молібдену залежить від ступеня подрібності: чим дрібніше він подрібнений, тим краще він реагує з іншими елементами.
Молібден був відкритий К.Шеєле в 1778 р., але почав використовуватися тільки в ХХ ст. Основна галузь його застосування — металургія (85-90%), де він входить до складу легованих сталей і сплавів з V, W, Cu, Ni і Co (стеліти), а також з С (карбіди). Крім того, молібден використовується в електротехніці, радіотехніці, термотехніці, хімічній і нафтопереробній промисловості і як мікроелемент добрив. Основна сировина для виробництва молібдену, його сплавів і сполук — молібденітові концентрати, що містять 45-52% Мо, 28-32% S і домішки ряду хімічних елементів. Технічними умовами на молібденовий концентрат передбачено, що при вмісті Мо 47-50% кількість Cu не повинна перевищувати 0,5-2,0%, Р — 0,07-0,15%, As — 0,07%, Sn — 0,07%, кварцу — 5-9%. Молібден отримують молібденових, вольфрам-молібденових, мідно-молібденових і уран-молібденових руд.
Технецій
Технецій — радіоактивний, перший штучно отриманий хімічний елемент VII групи періодичної системи Менделєєва, атомний номер 43, атомна маса 98, 9062. Проста речовина — технецій. Метал сріблясто-білого (сріблясто-коричневого) кольору. Кристалічна ґратка гексагональна, у надтонких шарах (бл. 10—8 мкм і менше) гранецентрована кубічна. Густина 11,5, tплав— 2172oС, tкип— 4877oС. Ступені окиснення +5 і +6, також +4. У вищих ступенях окиснення — слабкий оксидант. Оксиди: Тс2О7, ТсО3, ТсО2. Розчиняється в Н2О2. Взаємодіє з хлором, сіркою, киснем. Cтабільних ізотопів технецій не має, а з радіоактивних (їх є близько 20) практичного значення мають лише два: 99Тс і 99mTc з періодами піврозпаду відповідно 2,12·105 років і 6,04 год.
У природі елемент перебуває у незначних кількостях — 10−10 гр в одній тонні уранової смолки. Проте технецій — перспективний метал в техніці. Він може бути високотемпературним каталізатором і надпровідним матеріалом. А 99mTc використовується в медицині як джерело γ-випромінювання.
Рутеній

Рутеній — хімічний елемент VIII групи з атомним номером 44, атомною масою 101,07 а.о.м. та густиною при 20 °C 12370 кг/м3. Російський учений Карл-Ернст Клаус відкрив елемент в 1844 році і назвав його на честь латинського слова Русь. Проста речовина цього елемента — дуже крихкий сріблясто-сірий метал. Як і інші метали платинової групи, рутеній є інертним по відношенню до більшості хімічних елементів та речовин. У природі існує 7 стабільних ізотопів з масовими числами 96, 98-102, 104. Рутеній — рідкісний і дуже розсіяний елемент, середній вміст рутенію в земній корі 5•10−7% (мас). Існує один мінерал, утворений в основному рутенієм — лаурит (RuS2). Крім того, міститься у мінералах: рутенистому сисертськіті (містить до 19 % Ru), рутенистому нев'янськіті (до 14 % Ru), ауросміриді (різновид нев'янськіту, Ir, Os, Au), осрутині (Ru, Os), як ізоморфна домішка присутній у самородній платині і мінералах сульфідних, мідно-нікелевих руд. Добувають Рутеній у основному з платинових руд і його річний обсяг виробництва становить лише близько 12 тонн по всьому світу. Найчастіше рутеній використовується для зносостійких електричних контактів і виробництва товстоплівкових резисторів.
Родій

Родій — хімічний елемент VIII групи з атомним номером 45, атомною масою 102,9055 а.о.м. та густиною 12410 кг/м3; tплав 1963 °С; tкип 3700 °С. Його проста речовина — сріблястий блискучий метал, що належить до платинових металів. Це рідкісний і розсіяний елемент. У природі є один стабільний ізотоп 103Rh. Родій також хімічно пасивний, як і Рутеній. В природі Родій зустрічається у вигляді вільного металу, легованих з аналогічними металами і ніколи як хімічна сполука. Це один з найбільш рідкісних і найдорожчих дорогоцінних металів.
Родій є благородним металом, стійким до корозії. У 1803 році Вільям Волластон знайшов його в платиновій або нікелевій руді разом з іншими металами платинової групи. Назвали його від грецького ροδον, що означає рожевий, оскільки багато його сполук мають рожевий колір.
Основне застосування родію (близько 80% світового виробництва) є як одного з каталізаторів в трикомпонентних каталітичних нейтралізаторах автомобілів. Оскільки металевий родій не кородує і є стійким до найбільш агресивних хімічних речовин, то його зазвичай сплавляють з платиною або паладієм і застосовують для корозійно-резистивних покриттів. Також родій використовують у ядерній хімії.
Паладій
.jpg.webp)
Паладій — хімічний елемент VIII групи з атомним номером 46, атомною масою 106,4 а.о.м. та густиною 12000 кг/м3; tплав 1552 °С. Це є рідкісний і блискучий сріблясто-білий метал, виявив його у 1803 році Вільям Волластон і назвав на честь астероїда Паллада, який сам по собі був названий на честь Паллади — доньки Тритона і подруги Афіни. Паладій, платина, родій, рутеній, іридій і осмій, утворюють групу платинових металів (МПГ). Вони мають подібні хімічні властивості, але паладій має найнижчу точку плавлення і є найменш щільним з них.
Унікальні властивості паладію та інших металів платинової групи доводить їх широке застосування. Чверть всіх товарів, що вироблено сьогодні, або містять (МПГ) або мають значну роль в процесі їх виробництва. Більше половини поставок паладію використовують у Каталітичних нейтралізаторах, які перетворять до 90% вихлопних газів на менш шкідливі речовини (азот, вуглекислий газ і водяну пару). Паладій також використовується в електроніці, стоматології, медицині, хімічній промисловості та в обробці ґрунтових вод. Паладій грає ключову роль для виробництва електроенергії, тепла і води, де використовується технологія, яка поєднує водень і кисень.
Аргентум (Срібло)

Аргентум — хімічний елемент I групи з атомним номером 47, атомною масою 107,87 а.о.м. та густиною 10500 кг/м3. М'який, білий, блискучий перехідний метал, він має найвищу електропровідність(серед елементів) і найвищу теплопровідність (серед металів). Аргентум зустрічається в природі в чистому, вільному вигляді (самородне срібло), а також в таких мінералах, як аргентит і кераргірит. Більша частина срібла (близько 80%) отримується з поліметалічних руд, а також з руд золота і міді.
Срібло здавна цінується як дорогоцінний метал, з нього виготовляють прикраси, ювелірні вироби, високої вартості посуд, столові прибори (звідси термін вироби з срібла) і валютні монети. Сьогодні срібло також використовують в електричних провідниках, в дзеркалах і в каталізі хімічних реакцій. Його з'єднання використовуються в фотоплівках, а розбавлений розчин нітрату срібла і інших сполук срібла використовують як дезінфікуючі засоби. Хоча антибіотики витіснили срібло, як антимікробний засіб, дослідження властивостей срібла в медицині досі тривають.
Кадмій

Кадмій — хімічний елемент II групи з атомним номером 48, атомною масою 112,40 та густиною 8650 кг/м3. У 1817 році німецький хімік Фрідріх Штромеєр, при ревізії однієї з аптек, виявив, що карбонат цинку, який там був, містить домішки невідомого металу і назвав відкритий ним елемент кадмієм. Кадмій білий, блискучий, важкий, м'який, тягучий метал. Елемент складається з суміші 8 стабільних ізотопів з масовими числами: 106 (1,215%), 108 (0,875%), 110 (12,39%), 111 (12,75%), 112 (24,07%), 113 (12 ,26%), 114 (28,86%), 116 (7,58%). У вологому повітрі покривається захисною оксидаційною плівкою з CdO, при сильному нагріванні згорає до CdO. Галогенами легко оксидується до галідів. Розчиняється в мінеральних кислотах, у лугах не розчинний. Реагує з киснем при нагріванні, а також з кислотами.
Кадмій отримують з побічних продуктів переробки цинкових, свинцево-цинкових і мідно-цинкових руд. Металевий кадмій застосовують в ядерних реакторах, для антикорозійних і декоративних покриттів, в акумуляторах. Також він є основою деяких підшипникових сплавів, входить до складу легкоплавких сплавів (наприклад, сплав Вуда).
Література
- Романова Н.В. Загальна і неорганічна хімія
- Популярная библиотека химических элементов Електронна версія.