Рилін
Рилі́н (англ. reelin) — білок, який кодується геном RELN, розташованим у людини на довгому плечі 7-ї хромосоми.[4] Довжина поліпептидного ланцюга білка становить 3 460 амінокислот, а молекулярна маса — 388 388[5]. Рилін міститься у мозку та в інших тканинах і органах тіла людини та тварин. Цей глікопротеїн виконує багато функцій, найважливішою з яких є регулювання міграції та позиціонування нервових стовбурових клітин у період фетального і раннього післяпологового розвитку, необхідне для нормального формування кори та інших структур головного мозку. У дорослому мозку рилін регулює позиціонування нейронів, які утворюються у процесі дорослого нейрогенезу, а також дає внесок у роботу механізмів пам'яті та навчання, модулює синаптичну пластичність, посилює та підтримує довготривалу потенціацію,[6][7] що стимулює розвиток дендритів[8][9].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MERSGWARQT | FLLALLLGAT | LRARAAAGYY | PRFSPFFFLC | THHGELEGDG | ||||
| EQGEVLISLH | IAGNPTYYVP | GQEYHVTIST | STFFDGLLVT | GLYTSTSVQA | ||||
| SQSIGGSSAF | GFGIMSDHQF | GNQFMCSVVA | SHVSHLPTTN | LSFIWIAPPA | ||||
| GTGCVNFMAT | ATHRGQVIFK | DALAQQLCEQ | GAPTDVTVHP | HLAEIHSDSI | ||||
| ILRDDFDSYH | QLQLNPNIWV | ECNNCETGEQ | CGAIMHGNAV | TFCEPYGPRE | ||||
| LITTGLNTTT | ASVLQFSIGS | GSCRFSYSDP | SIIVLYAKNN | SADWIQLEKI | ||||
| RAPSNVSTII | HILYLPEDAK | GENVQFQWKQ | ENLRVGEVYE | ACWALDNILI | ||||
| INSAHRQVVL | EDSLDPVDTG | NWLFFPGATV | KHSCQSDGNS | IYFHGNEGSE | ||||
| FNFATTRDVD | LSTEDIQEQW | SEEFESQPTG | WDVLGAVIGT | ECGTIESGLS | ||||
| MVFLKDGERK | LCTPSMDTTG | YGNLRFYFVM | GGICDPGNSH | ENDIILYAKI | ||||
| EGRKEHITLD | TLSYSSYKVP | SLVSVVINPE | LQTPATKFCL | RQKNHQGHNR | ||||
| NVWAVDFFHV | LPVLPSTMSH | MIQFSINLGC | GTHQPGNSVS | LEFSTNHGRS | ||||
| WSLLHTECLP | EICAGPHLPH | STVYSSENYS | GWNRITIPLP | NAALTRNTRI | ||||
| RWRQTGPILG | NMWAIDNVYI | GPSCLKFCSG | RGQCTRHGCK | CDPGFSGPAC | ||||
| EMASQTFPMF | ISESFGSSRL | SSYHNFYSIR | GAEVSFGCGV | LASGKALVFN | ||||
| KDGRRQLITS | FLDSSQSRFL | QFTLRLGSKS | VLSTCRAPDQ | PGEGVLLHYS | ||||
| YDNGITWKLL | EHYSYLSYHE | PRIISVELPG | DAKQFGIQFR | WWQPYHSSQR | ||||
| EDVWAIDEII | MTSVLFNSIS | LDFTNLVEVT | QSLGFYLGNV | QPYCGHDWTL | ||||
| CFTGDSKLAS | SMRYVETQSM | QIGASYMIQF | SLVMGCGQKY | TPHMDNQVKL | ||||
| EYSTNHGLTW | HLVQEECLPS | MPSCQEFTSA | SIYHASEFTQ | WRRVIVLLPQ | ||||
| KTWSSATRFR | WSQSYYTAQD | EWALDSIYIG | QQCPNMCSGH | GSCDHGICRC | ||||
| DQGYQGTECH | PEAALPSTIM | SDFENQNGWE | SDWQEVIGGE | IVKPEQGCGV | ||||
| ISSGSSLYFS | KAGKRQLVSW | DLDTSWVDFV | QFYIQIGGES | ASCNKPDSRE | ||||
| EGVLLQYSNN | GGIQWHLLAE | MYFSDFSKPR | FVYLELPAAA | KTPCTRFRWW | ||||
| QPVFSGEDYD | QWAVDDIIIL | SEKQKQIIPV | INPTLPQNFY | EKPAFDYPMN | ||||
| QMSVWLMLAN | EGMVKNETFC | AATPSAMIFG | KSDGDRFAVT | RDLTLKPGYV | ||||
| LQFKLNIGCA | NQFSSTAPVL | LQYSHDAGMS | WFLVKEGCYP | ASAGKGCEGN | ||||
| SRELSEPTMY | HTGDFEEWTR | ITIVIPRSLA | SSKTRFRWIQ | ESSSQKNVPP | ||||
| FGLDGVYISE | PCPSYCSGHG | DCISGVCFCD | LGYTAAQGTC | VSNVPNHNEM | ||||
| FDRFEGKLSP | LWYKITGAQV | GTGCGTLNDG | KSLYFNGPGK | REARTVPLDT | ||||
| RNIRLVQFYI | QIGSKTSGIT | CIKPRTRNEG | LIVQYSNDNG | ILWHLLRELD | ||||
| FMSFLEPQII | SIDLPQDAKT | PATAFRWWQP | QHGKHSAQWA | LDDVLIGMND | ||||
| SSQTGFQDKF | DGSIDLQANW | YRIQGGQVDI | DCLSMDTALI | FTENIGKPRY | ||||
| AETWDFHVSA | STFLQFEMSM | GCSKPFSNSH | SVQLQYSLNN | GKDWHLVTEE | ||||
| CVPPTIGCLH | YTESSIYTSE | RFQNWKRITV | YLPLSTISPR | TRFRWIQANY | ||||
| TVGADSWAID | NVVLASGCPW | MCSGRGICDA | GRCVCDRGFG | GPYCVPVVPL | ||||
| PSILKDDFNG | NLHPDLWPEV | YGAERGNLNG | ETIKSGTSLI | FKGEGLRMLI | ||||
| SRDLDCTNTM | YVQFSLRFIA | KSTPERSHSI | LLQFSISGGI | TWHLMDEFYF | ||||
| PQTTNILFIN | VPLPYTAQTN | ATRFRLWQPY | NNGKKEEIWI | VDDFIIDGNN | ||||
| VNNPVMLLDT | FDFGPREDNW | FFYPGGNIGL | YCPYSSKGAP | EEDSAMVFVS | ||||
| NEVGEHSITT | RDLNVNENTI | IQFEINVGCS | TDSSSADPVR | LEFSRDFGAT | ||||
| WHLLLPLCYH | SSSHVSSLCS | TEHHPSSTYY | AGTMQGWRRE | VVHFGKLHLC | ||||
| GSVRFRWYQG | FYPAGSQPVT | WAIDNVYIGP | QCEEMCNGQG | SCINGTKCIC | ||||
| DPGYSGPTCK | ISTKNPDFLK | DDFEGQLESD | RFLLMSGGKP | SRKCGILSSG | ||||
| NNLFFNEDGL | RMLMTRDLDL | SHARFVQFFM | RLGCGKGVPD | PRSQPVLLQY | ||||
| SLNGGLSWSL | LQEFLFSNSS | NVGRYIALEI | PLKARSGSTR | LRWWQPSENG | ||||
| HFYSPWVIDQ | ILIGGNISGN | TVLEDDFTTL | DSRKWLLHPG | GTKMPVCGST | ||||
| GDALVFIEKA | STRYVVSTDV | AVNEDSFLQI | DFAASCSVTD | SCYAIELEYS | ||||
| VDLGLSWHPL | VRDCLPTNVE | CSRYHLQRIL | VSDTFNKWTR | ITLPLPPYTR | ||||
| SQATRFRWHQ | PAPFDKQQTW | AIDNVYIGDG | CIDMCSGHGR | CIQGNCVCDE | ||||
| QWGGLYCDDP | ETSLPTQLKD | NFNRAPSSQN | WLTVNGGKLS | TVCGAVASGM | ||||
| ALHFSGGCSR | LLVTVDLNLT | NAEFIQFYFM | YGCLITPNNR | NQGVLLEYSV | ||||
| NGGITWNLLM | EIFYDQYSKP | GFVNILLPPD | AKEIATRFRW | WQPRHDGLDQ | ||||
| NDWAIDNVLI | SGSADQRTVM | LDTFSSAPVP | QHERSPADAG | PVGRIAFDMF | ||||
| MEDKTSVNEH | WLFHDDCTVE | RFCDSPDGVM | LCGSHDGREV | YAVTHDLTPT | ||||
| EGWIMQFKIS | VGCKVSEKIA | QNQIHVQYST | DFGVSWNYLV | PQCLPADPKC | ||||
| SGSVSQPSVF | FPTKGWKRIT | YPLPESLVGN | PVRFRFYQKY | SDMQWAIDNF | ||||
| YLGPGCLDNC | RGHGDCLREQ | CICDPGYSGP | NCYLTHTLKT | FLKERFDSEE | ||||
| IKPDLWMSLE | GGSTCTECGI | LAEDTALYFG | GSTVRQAVTQ | DLDLRGAKFL | ||||
| QYWGRIGSEN | NMTSCHRPIC | RKEGVLLDYS | TDGGITWTLL | HEMDYQKYIS | ||||
| VRHDYILLPE | DALTNTTRLR | WWQPFVISNG | IVVSGVERAQ | WALDNILIGG | ||||
| AEINPSQLVD | TFDDEGTSHE | ENWSFYPNAV | RTAGFCGNPS | FHLYWPNKKK | ||||
| DKTHNALSSR | ELIIQPGYMM | QFKIVVGCEA | TSCGDLHSVM | LEYTKDARSD | ||||
| SWQLVQTQCL | PSSSNSIGCS | PFQFHEATIY | NSVNSSSWKR | ITIQLPDHVS | ||||
| SSATQFRWIQ | KGEETEKQSW | AIDHVYIGEA | CPKLCSGHGY | CTTGAICICD | ||||
| ESFQGDDCSV | FSHDLPSYIK | DNFESARVTE | ANWETIQGGV | IGSGCGQLAP | ||||
| YAHGDSLYFN | GCQIRQAATK | PLDLTRASKI | MFVLQIGSMS | QTDSCNSDLS | ||||
| GPHAVDKAVL | LQYSVNNGIT | WHVIAQHQPK | DFTQAQRVSY | NVPLEARMKG | ||||
| VLLRWWQPRH | NGTGHDQWAL | DHVEVVLVST | RKQNYMMNFS | RQHGLRHFYN | ||||
| RRRRSLRRYP |
Цей білок за функціями належить до серинових протеаз, білків розвитку. Білок клітинної адгезії, має сайти зв'язування з іонами цинку та кальцію, локалізований у позаклітинному матриксі.
Загальна характеристика
Термін «рилін» походить від англ. to reel — «крутитися», «вертітися», «йти нетвердою ходою». Саме така, «закручена», нерівна хода була помічена у мишей з генетично зумовленою нестачею риліну. Гостра нестача білка призводить до порушення міграції нейронів. Якщо ген, який кодує синтез риліну, виключено повністю (гомозиготний генотип), спостерігається інверсія шарів кори головного мозку. При гетерозиготному генотипі, порушення мозку у мишей менш помітні, але нагадують порушення мозку людини при психотичних розладах[10]. У людини генетично зумовлена відсутність риліну приводить до лісенціфалії, важкої розумової відсталості та епілепсії. Значна нестача риліну у людини спостерігається при шизофренії та біполярному розладі[12], але слід відзначити ймовірну дію медикаментів. Є дані про ймовірні зв'язки поліморфізмів гена RELN з шизофренією[13] та хворобою Альцгеймера[14].
Історія відкриття і дослідження
 Кортикогенез у дикої миші. Клітини Кахаля-Ретціуса (червоні) виділяють рилін (оранжевий). |
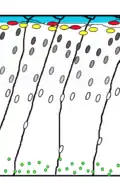 Порушений кортикогенез у миші-мутанта reeler. Рилін відсутній, шари кори інвертовані. |
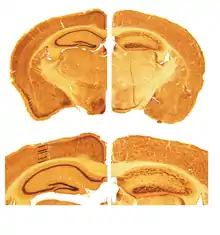
Дослідження мишей-мутантів дозволило ученим заглянути в глибинні механізми розвитку центральної нервової системи. Ідентифікацією спонтанних мутацій у мишей вперше зайнялися нейрофізіологи, що досліджували моторну поведінку. Виявити потрібних мишей у поносі було відносне легко: мутанти не були здатні нормально пересуватися у клітці. Було знайдено кілька подібних мишей, що отримали назви відповідно до характеру порушень моторики: reeler («той, що крутиться»), weaver («той, що коливається»), lurcher («той, що перехиляється»), nervous («нервовий»), і staggerer («той, що похитується»).
Миша, названа reeler, була вперше описана в 1951 році британським генетиком Дугласом Скоттом Фальконером[15]. У 1960-ті роки було виявлено, що мозочок у цих мишей набагато менший від норми, до того ж порушена нормальна організація нейрональних шарів[16]. Мутація особливо зацікавила дослідників після того, як було виявлено, що шари нейронів у мишей вистроюються «навпаки»: молодші нейрони були нездатні подолати шари клітин, що вже «осіли» на своєму рівні[17].
У 1995 році Ґабріеле Д'Арканджело і її колегам вдалося виявити ген RELN (що кодує білок рилін), розташований на хромосомі 7q22[18]. В тому ж році японськими ученими з медичної школи міста Коті було успішно створено перше моноклональне антитіло до риліну, назване CR-50[19]. Вони відзначили, що клітини Кахаля-Ретціуса, функція яких на той час була невідома, демонстрували особливо сильну реакцію на CR-50.
Клітинні рецептори, що реагують на рилін, апоЕ-рецептор 2 (apolipoprotein E receptor 2, apoER2) і рецептор ліпопротеїнів дуже низької щільності (very-low-density lipoprotein receptor, VLDLR), були виявлені випадково в ході експерименту, проведеного Тромсдорфом і колегами в 1997 році[20]. У використаних в експерименті мутантів, так званих «нокаутних» мишей з відсутніми рецепторами apoER2 і VLDLR, виявилися дефекти в будові кори головного мозку, ідентичні дефектам миші reeler.
З метою глибше вивчити механізм сигнального шляху білка риліну й знайти інші його елементи, учені використовували два інших типи мишей-мутантів — yotari і scrambler. Ці миші за фенотипом схожі з мишею reeler, але сам ген RELN у них нормальний. Дослідження цих мутантів виявили порушення в гені DAB1, який кодує білок Dab1. Миші yotari, як виявилось, були позбавлені білка Dab1 повністю, а у мишей scrambler його вдавалося виявити ледь-ледь[21]. Цілеспрямоване руйнування гена DAB1 також викликало фенотип, аналогічний фенотипу миші reeler. Визначення того, що саме Dab1 є ключовим регулятором сигнального каскаду риліну, поклало початок доскональному вивченню його складних внутріклітинних взаємодій.
Відкриття можливого зв'язку риліну з шизофренією та біполярним розладом, хворобою Альцгеймера і аутизмом та іншими дисфункціями, а також перспектива розкриття механізмів, що зумовили виникнення складно організованого людського мозку, привели до активного дослідження білка і його сигнальних взаємодій. До початку другого десятиліття після відкриття гена RELN, число наукових статей про рилін обчислювалося сотнями[22], а в 2008 році була опублікована збірка, численні автори якої розглядають різні структурні і функціональні особливості риліна в нормі і при патологіях[23].
Секреція і локалізація білка

Рилін є секретується позаклітинною матрицею. Швидкість секреції риліну пов'язана зі швидкістю його утворення і не залежить від деполяризації мембрани. Рилін виявляється в секреторних гранулах апарату Гольджі і відсутній в синаптичних бульбашках, що характерно для більшості білків позаклітинної матриці.
В період розвитку мозку рилін в корі головного мозку і гіпокампі синтезується клітинами Кахаля-Ретціуса, клітинами Кахаля та клітинами Ретціуса[24].
Клітини в пренатальному і ранньому постнатальному мозку, що виробляють рилін, переважно розміщуються в маргінальній зоні (MZ) кори і в тимчасовому субпіальному гранулярному шарі (SGL), найрозвиненішому в людини[25], а в гіпокампі — в молекуляно-перенхімальному шарі (лат. stratum lacunosum-moleculare) і верхньому маргінальному шарі зубчастої звивини.
У мозочку рилін виробляється в зовнішньому шарі гранулярних клітин перед міграцією гранулярних клітин у внутрішній шар[26].
Загалом у постнатальний період відбувається перехід від пошарової до дифузної експресії риліну. В дорослому мозку білок синтезується кірковими ГАМК-ергічними інтернейронами, що експресують кальретинін і кальбіндин, такими як клітини Мартінотті. Парвальбумін-місткі ГАМКергічні інтернейрони, такі як канделяберні і корзинчасті клітини, ніколи не утворюють рилін або роблять це украй рідко[27][28]. У мозочку дорослих особин рилін виробляється глутаматергічними гранулярними нейронами внутрішнього шару[29].
За межами мозку рилін у дорослих ссавців виявляється в крові, печінці, середній частці гіпофізу і хромафінних клітинах надниркової залози[30].
У печінці рилін був ідентифікований в клітинах Іто[31]. При пошкодженні печінки рівень мРНК риліну різко підвищується та знизується після завершення процесу відновлення[32].
В очах рилін виробляється в шарі гангліонарних клітин сітківки та ендотеліальному шарі рогівки[33]. Як і в печінці, експресія цього білка підвищується при пошкодженнях.
Рилін виробляється також одонтобластами, клітинами, що розташовані на периферії зубної пульпи. Білок виявляється тут як в процесі одонтогенезу, так і в дорослому зубі[34]. Як припускають деякі автори, одонтобласти є сенсорними клітками, здатними передавати болеві сигнали нервовим закінченням[35]. Згідно з цією гіпотезою, рилін грає роль в цьому процесі[23], тому що він може сприяти встановленню контакту одонтобластів з нервовими закінченнями[36].
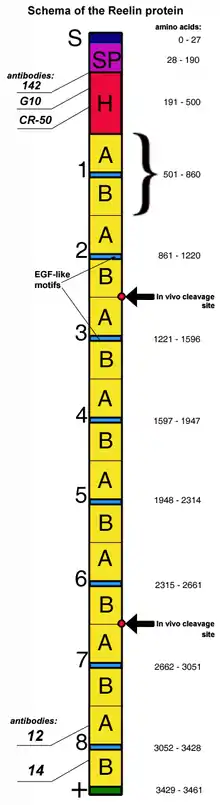
Структура білка
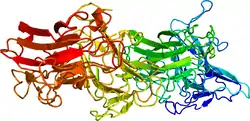
Рилін складається з 3461 амінокислотних залишків і має молекулярну масу 388 кДа. У мишачому гені Reln міститься 65 екзонів, що мають загальну довжину близько 450 kb[38].
N-термінальні екзони розділені великими інтронами, решта екзонів розташовані ближче один до одного. Один екзон, що кодує всього дві амінокислоти поряд з C-кінцем, схильний до альтернативному сплайсингу, але невідомо, як це відображається на функції білка[23]. В структурі гена ідентифіковані дві основні ділянки ініціації транскрипції і дві ділянки поліаденілювання[38].
Молекула білка починається сигнальним пептидом завдовжки в 27 амінокислотних залишків. Потім слідує ділянка, за будовою схожа з білком позаклітинної матриці F-спондіном (на схемі відмічений як SP, амінокислотні залишки 28—190). Потім — унікальна для риліна ділянка (сегмент H на схемі), після якої йдуть підряд 8 ділянок схожої структури, так звані «рилиновые повторы», завдовжки приблизно 350 амінокислот кожен. У центрі кожного повтору розташовується EGF-подібне включення, що ділить повтор на два субповтори, A і B, структура яких має мало загального. Незважаючи на розділення, ці субповтори контактують один з одним, що додає компактність загальній структурі риліну[39]. Останньою йде коротка ділянка завдовжки в 32 амінокислоти, багата основними залишками (C terminal region, CTR), відмічена на схемі знаком «плюс». Ця ділянка відрізняється високою еволюційною консервативністю: вона повністю ідентична у всіх ссавців зі встановленою структурою гена RELN. Раніше вважалося, що ця ділянка необхідна для виділення білка з клітки, оскільки секреція риліна порушена у миші reeler підтипу Orleans, що виробляє неповний протеїн, — без частини 8-го повтору і без CTR. Було встановлено, що секреція порушується в першу чергу через відсікання білка посередині будь-якого з повторів, а чисте відсікання CTR призводить лише до зниження секреції[40].
У організмі рилін піддається росттрансляційній модифікації і розділяється на три частини. Позиції розділення знаходяться приблизно між 2 і 3 риліновим повтором і між повторами 6 і 7 (на схемі відмічені стрілками)[41]. Розщеплення риліну не знижує його активності, навпаки, воно може бути необхідним для правильного кортикогенезу[42]. Конструкції, утворені центральними сегментами білка (повтори 3—6) ефективно зв'язуються з ліпопротеїновимі рецепторами, викликають подальше фосфорилування DAB1 і сприяють розвитку кортикальной пластинки так само, як і цілий білок[43].
Епітопи риліну, що взаємодіють з антитілами 142, G-10, CR-50, 12 і 14, також помічені на схемі.
Функції білка і механізм його дії
Найважливіша передбачувана роль риліну — участь в регулюванні правильної будови шарів мозку, позиціонування клітин і утворення зв'язків протягом пренатального періоду розвитку. Проте білок задіяний в множині інших, ще не вивчених, процесів.
Функції білка
Виявлення всіх функцій білка ускладнене передбачуваним різноманіттям його ролей і широкою поширеністю в організмі. Можна умовно розділити сфери дії білка за двома показниками — тимчасовому (стадія розвитку організму) і просторовому (локалізація в організмі).
На ранніх періодах розвитку, експресія риліна тимчасово виявляється в безлічі органів, що розвиваються, за межами центральної нервової системи, зникаючи після закінчення їхнього формування. Роль білка в цих процесах вивчена недостатньо, оскільки порушення вироблення риліна у нокаутних мишей-мутантів не приводить до явних патологій цих органів. У дорослому організмі, присутність риліну спостерігається в меншій кількості органів, причому спалах активності білка часто спостерігається при пошкодженні органу[33][32]. Проте і в цих випадках точна функція риліну надалі залишається об'єктом наукових досліджень.
Роль риліна в ранньому розвитку нервової системи досліджена не достатньо. Білок сприяє диференціації волокон радіальної глії, уздовж яких мігрують нейробласти[45]. Положення шару клітин, що виробляють рилін, грає важливу роль, оскільки радіальна глія орієнтує свої волокна у напрямі більшої концентрації риліну[44].
Другий процес в розвитку мозку, що залежить від наявності риліна — кортикогенез, зокрема, розщеплювання передпластинки (англ. preplate) на маргінальну зону і субпластинку і заселення простору між ними — кортикальної пластинки — п'ятьма горизонтальними шарами нейронів в «зворотному» порядку. Зворотний порядок побудови шарів кортикальної пластинки, при якому молодші нейробласти долають ряди клітин, що вже прижилися, і вибудовують свій шар вище, відрізняє мозок ссавців від еволюційно стародавнішого мозку зауропсидів, в якому шари будуються «зовні всередину». За відсутності риліну, кортикальні шари миші-мутанта reeler також будуються зовні всередину, причому молодші клітини не можуть подолати вже створені кортикальні шари. При цьому в просторі, розташованому під м'якою мозковою оболоною, утворюється так звана «суперпластинка» — перенаселений шар, в якому змішані неправильно розташовані нейрони субпластинки, клітини Кахаля-Ретціуса, і нейрони, які повинні були подолати субпластинку і зупинитися безпосередньо за нею, залишивши місце вгорі для наступних шарів.
Не існує єдиної думки відносно ролі риліну в правильній побудові шарів. Початкове припущення про те, що білок служить стоп-сигналом для мігруючих клітин, підтверджується його здатністю провокувати роз'єднання нейронів[46], його роллю в створенні рівного шару гранулярних клітин в зубчастій звивині гіпокампу, а також тим, що мігруючі нейробласти уникають впровадження в зони, насичені риліном. Проте дані про те, що нормальний кортикогенез відновлюється незалежно від положення шару клітин, що виробляють рилін, в дослідженнях на мишах[47], а також відсутність експериментальних доказів дії білка на конуси росту і провідні відростки нейронів, породили додаткові гіпотези. Згідно з одною з них, рилін підвищує чутливість клітин до ще невідомого сигналу позиціонування.
Роль риліну в нервовій системі дорослого організму пов'язана з двома найактивнішими ділянками нейрогенезу в дорослому мозку — субвентрикулярною зоною і зубчастою звивиною. Ланцюжки нейробластів, що здійснюють в мозку деяких видів тварин тангенціальну міграцію ростральним міграційним трактом з субвентрикулярної зони до нюхової цибулини, під впливом риліну розпадаються на окремі клітини. Ці клітини набувають здатності долати вже існуючі шари нейронів і здійснюють радіальну міграцію уздовж гліальних волокон. У зубчастій звивині рилін відповідає за підтримку компактного шару гранулярных клітин, що постійно поповнюється новими нейронами, які зароджуються в субгранулярній зоні[48].
Рилін у дорослих також продовжує виділятися ГАМКергічними інтернейронамі кори мозку, що зародилися в медіальному гангліонарному горбику. Рилін, що виділяється ними, підсилює синаптичну пластичність і довготривалу потенціацію[7], взаємодіючи з рецепторами ApoER2 і VLDLR.
За даними одного дослідження, рилін може брати участь у віковій зміні композиції NMDA-рецептору, підвищуючи мобільність рецепторів, що містять субодиницю NR2B[49].
Див. також
Примітки
- Захворювання, генетично пов'язані з RELN переглянути/редагувати посилання на ВікіДаних.
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:9957 (англ.). Процитовано 26 квітня 2018.
- UniProt, P78509 (англ.). Процитовано 26 квітня 2018.
- Weeber, E. J., U. Beffert, C. Jones, J. M. Christian, E. Forster, J. D. Sweatt, and J. Herz. 2002. Reelin and ApoE receptors cooperate to enhance hippocampal synaptic plasticity and learning. J. Biol. Chem. 277:39944-39952. PMID 12167620
- D'Arcangelo G. (2005) Apoer2: a reelin receptor to remember. Neuron. 47(4):471-3. PMID 16102527 Повнотекстова стаття в вільному доступі[недоступне посилання з липня 2019](англ.)
- Niu S, Renfro A, Quattrocchi CC, Sheldon M, D'Arcangelo G. (2004) Reelin promotes hippocampal dendrite development through the VLDLR/ApoER2-Dab1 pathway. Neuron. 2004 Jan 8;41(1):71-84. PMID 14715136
- Matsuki T, Pramatarova A, Howell BW (May 2008). Reduction of Crk and CrkL expression blocks reelin-induced dendritogenesis. J. Cell. Sci. PMID 18477607. doi:10.1242/jcs.027334.
- Tueting P, Doueiri MS, Guidotti A, Davis JM, Costa E (2006). Reelin down-regulation in mice and psychosis endophenotypes. Neurosci Biobehav Rev 30 (8): 1065–77. PMID 16769115. doi:10.1016/j.neubiorev.2006.04.001.
- Torrey EF, Barci BM, Webster MJ, Bartko JJ, Meador-Woodruff JH, Knable MB (February 2005). Neurochemical markers for schizophrenia, bipolar disorder, and major depression in postmortem brains. Biol. Psychiatry 57 (3): 252–60. PMID 15691526. doi:10.1016/j.biopsych.2004.10.019.
- Gene Overview of All Published Schizophrenia-Association Studies for RELN Архівовано 21 лютого 2009 у Wayback Machine., «Огляд публікацій щодо асоціації гена RELN с шизофренією», база даних Schizophrenia Gene
- Seripa D, Matera MG, Franceschi M, et al (July 2008). The RELN locus in Alzheimer's disease. J. Alzheimers Dis. 14 (3): 335–44. PMID 18599960.
- Falconer DS (1951) 2 new mutants, trembler and reeler, with neurological actions in the house mouse (mus-musculus l). Journal of Genetics 50 (2): 192—201 (англ.)
- Hamburgh M. (1963) Analysis of the postnatal developmental effects of «reeler», a neurological mutation in mice. A study in developmental genetics. Dev Biol. 19:165-85. PMID 14069672
- Caviness VS Jr. (1976) Patterns of cell and fiber distribution in the neocortex of the reeler mutant mouse. J Comp Neurol. 170(4):435-47. PMID 1002868
- D'Arcangelo G, Miao GG, Chen SC, Soares HD, Morgan JI, Curran T (1995) A protein related to extracellular matrix proteins deleted in the mouse mutant reeler. Nature 374: 719—723. PMID 7715726
- Ogawa M, Miyata T, Nakajima K, Yagyu K, Seike M, Ikenaka K, Yamamoto H, Mikoshiba K. (1995) The reeler gene-associated antigen on Cajal-Retzius neurons is а crucial molecule for laminar organization of cortical neurons. Neuron. 14(5):899-912. PMID 7748558
- Trommsdorff M, Gotthardt M, Hiesberger T, Shelton J, Stockinger W, Nimpf J, Hammer RE, Richardson JA, Herz J. (1997) Reeler/Disabled-like disruption of neuronal migration in knockout mice lacking the VLDL receptor and APOE receptor 2. Cell. 97(6):689-701. PMID 10380922
- Sheldon M, Rice DS, D'Arcangelo G, Yoneshima H, Nakajima K, Mikoshiba K, Howell BW, Cooper JA, Goldowitz D, Curran T. (1997) Scrambler and yotari disrupt the disabled gene and produce a reeler-like phenotype in mice. Nature. 389(6652):730-3. PMID 9338784
- Пошук за рядком «reelin» у назвах наукових статей — Google Scholar
- під ред. Hossein S. Fatemi, ред. (2008). Reelin Glycoprotein: Structure, Biology and Roles in Health and Disease. Springer. ISBN 978-0-387-76760-4.
- Meyer G, Goffinet AM, Fairen A. (1999) What is a Cajal-Retzius cell? A reassessment of a classical cell type based on recent observations in the developing neocortex. Cereb Cortex. 9(8):765-75. PMID 10600995
- Meyer G, Goffinet AM (July 1998). Prenatal development of reelin-immunoreactive neurons in the human neocortex. J. Comp. Neurol. 397 (1): 29–40. PMID 9671277.
- Schiffinann, S. N., Bernier, B. & Goffinet, A. M. (1997) Reelin mRNA expression during mouse brain development. Eur. J. Neurosci. 9, 1055—1071 PMID 9182958
- Alcantara S, Ruiz M, D’Arcangelo G, Ezan F, de Lecea L, Curran T, Sotelo C, Soriano E. (1998). Regional and cellular patterns of reelin mRNA expression in the forebrain of the developing and adult mouse. J Neurosci. 18 (19): 7779–99. PMID 9742148.
- Pesold C, Liu WS, Guidotti A, Costa E, Caruncho HJ. (1999). Cortical bitufted, horizontal, and Martinotti cells preferentially express and secrete reelin into perineuronal nets, nonsynaptically modulating gene expression. Proc Natl Acad Sci USA 96 (6): 3217–22. PMID 10077664.
- Pesold C, Impagnatiello F, Pisu MG, Uzunov DP, Costa E, Guidotti A, Caruncho HJ. (1998). Reelin is preferentially expressed in neurons synthesizing gamma-aminobutyric acid in cortex and hippocampus of adult rats. Proc Natl Acad Sci USA 95 (6): 3221–6. PMID 9501244. Архів оригіналу за 8 травня 2006. Процитовано 11 жовтня 2008.
- Smalheiser NR, Costa E, Guidotti A, Impagnatiello F, Auta J, Lacor P, Kriho V, Pappas GD. (2000). Expression of reelin in adult mammalian blood, liver, pituitary pars intermedia, and adrenal chromaffin cells. Proc Natl Acad Sci USA 97 (3): 1281–6. PMID 10655522.
- Samama B, Boehm N. (2005). Reelin immunoreactivity in lymphatics and liver during development and adult life. Anat Rec A Discov Mol Cell Evol Biol. 285 (1): 595–9. PMID 15912522.[недоступне посилання з квітня 2019]
- Kobold D, Grundmann A, Piscaglia F, Eisenbach C, Neubauer K, Steffgen J, Ramadori G, Knittel T. (2002). Expression of reelin in hepatic stellate cells and during hepatic tissue repair: a novel marker for the differentiation of HSC from other liver myofibroblasts. J Hepatol. 36 (5): 607–13. PMID 11983443.
- Pulido JS, Sugaya I, Comstock J, Sugaya K (June 2007). Reelin expression is upregulated following ocular tissue injury. Graefes Arch. Clin. Exp. Ophthalmol. 245 (6): 889–93. PMID 17120005. doi:10.1007/s00417-006-0458-4.
- Buchaille R, Couble ML, Magloire H, Bleicher F (September 2000). A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix biology : journal of the International Society for Matrix Biology 19 (5): 421–30. PMID 10980418.
- Allard B, Magloire H, Couble ML, Maurin JC, Bleicher F (September 2006). Voltage-gated sodium channels confer excitability to human odontoblasts: possible role in tooth pain transmission. The Journal of biological chemistry 281 (39): 29002–10. PMID 16831873. doi:10.1074/jbc.M601020200.
- Maurin JC, Couble ML, Didier-Bazes M, Brisson C, Magloire H, Bleicher F (August 2004). Expression and localization of reelin in human odontoblasts. Matrix biology : journal of the International Society for Matrix Biology 23 (5): 277–85. PMID 15464360. doi:10.1016/j.matbio.2004.06.005.
- Yasui N, Nogi T, Kitao T, Nakano Y, Hattori M, Takagi J (June 2007). Structure of а receptor-binding fragment of reelin and mutational analysis reveal а recognition mechanism similar to endocytic receptors. Proc. Natl. Acad. Sci. U.S.A. 104 (24): 9988–93. PMC 1891246. PMID 17548821. doi:10.1073/pnas.0700438104.
- Royaux I, Lambert de Rouvroit C, D'Arcangelo G, Demirov D, Goffinet AM (December 1997). Genomic organization of the mouse reelin gene. Genomics 46 (2): 240–50. PMID 9417911.
- Nogi T, Yasui N, Hattori M, Iwasaki K, Takagi J. (2006). Structure of a signaling-competent reelin fragment revealed by X-ray crystallography and electron tomography. EMBO Journal. PMID 16858396.
- Nakano Y, Kohno T, Hibi T, Kohno S, Baba A, Mikoshiba K, Nakajima K, Hattori M. (2007). The extremely conserved C-terminal region of reelin is not necessary for secretion but is required for efficient activation of downstream signaling. The Journal of Biological Chemistry. PMID 17504759.
- Lambert de Rouvroit C, de Bergeyck V, Cortvrindt C, Bar I, Eeckhout Y, Goffinet AM (1999). Reelin, the extracellular matrix protein deficient in reeler mutant mice, is processed by a metalloproteinase. Exp Neurol. 156 (1): 214–7. PMID 10192793.
- Jossin Y, Gui L, Goffinet AM (April 2007). Processing of Reelin by embryonic neurons is important for function in tissue but not in dissociated cultured neurons. J. Neurosci. 27 (16): 4243–52. PMID 17442808. doi:10.1523/JNEUROSCI.0023-07.2007.
- Jossin Y, Ignatova N, Hiesberger T, Herz J, Lambert de Rouvroit C, Goffinet AM (January 2004). The central fragment of Reelin, generated by proteolytic processing in vivo, is critical to its function during cortical plate development. J. Neurosci. 24 (2): 514–21. PMID 14724251. doi:10.1523/JNEUROSCI.3408-03.2004.
- Nomura T, Takahashi M, Hara Y, Osumi N (2008). Patterns of neurogenesis and amplitude of Reelin expression are essential for making a mammalian-type cortex. PLoS ONE 3 (1): e1454. PMC 2175532. PMID 18197264. doi:10.1371/journal.pone.0001454.
- Hartfuss E, Förster E, Bock HH, et al (October 2003). Reelin signaling directly affects radial glia morphology and biochemical maturation. Development 130 (19): 4597–609. PMID 12925587. doi:10.1242/dev.00654.
- Hack I, Bancila M, Loulier K, Carroll P, Cremer H (October 2002). Reelin is a detachment signal in tangential chain-migration during postnatal neurogenesis. Nat. Neurosci. 5 (10): 939–45. PMID 12244323. doi:10.1038/nn923.
- Yoshida M, Assimacopoulos S, Jones KR, Grove EA (February 2006). Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order. Development 133 (3): 537–45. PMID 16410414. doi:10.1242/dev.02209.
- Frotscher M, Haas CA, Forster E (2003). Reelin controls granule cell migration in the dentate gyrus by acting on the radial glial scaffold. Cereb Cortex. 13 (6): 634–40. PMID 12764039.
- Groc L, Choquet D, Stephenson FA, Verrier D, Manzoni OJ, Chavis P (2007). NMDA receptor surface trafficking and synaptic subunit composition are developmentally regulated by the extracellular matrix protein Reelin. J. Neurosci. 27 (38): 10165–75. PMID 17881522. doi:10.1523/JNEUROSCI.1772-07.2007.
Література
- Lambert de Rouvroit C., Bernier B., Royaux I., de Bergeyck V., Goffinet A.M. (1999). Evolutionarily conserved, alternative splicing of reelin during brain development.. Exp. Neurol. 156: 229 — 238. PubMed DOI:10.1006/exnr.1999.7019