C4-фотосинтез
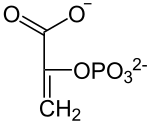
C4-фотосинтез, або цикл Хетча — Слека — шлях зв'язування вуглецю, характерний для вищих рослин, першим продуктом якого є чотиривуглецева щавелевооцтова кислота, а не тривуглецева 3-фосфогліцеринова кислота, як у більшості рослин зі звичайним C3-фотосинтезом.
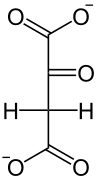
По суті C4-фотосинтез є модифікацією звичайного C3-фотосинтезу і з'явився в процесі еволюції набагато пізніше від нього. В циклі Хетча — Слека рослини здійснюють первинну фіксацію вуглецю в клітинах мезофіла через карбоксилювання фосфоенолпірувату (ФЕП) за участі ферменту фосфоенолпіруваткарбоксилази (ФЕП-карбоксилаза). Утворений в результаті реакції оксалоацетат перетворюється в малат чи аспартат і в такому вигляді транспортується в клітини обкладки провідного пучка, де в результаті декарбоксилювання вивільняється CO2, що надходить у відновлювальний пентозо-фосфатний цикл[1]. В циклі Кальвіна у C4-рослин, як і в C3-рослин, CO2 перетворюється в триатомний цукор, який іде на синтез сахарози. Транспорт CO2 із клітин мезофіла в клітини обкладки у вигляді проміжних продуктів фіксації дозволяє значно підвищити його концентрацію в місці локалізації рубіско і таким чином значно збільшити її ефективність, уникнувши побічної реакції з киснем і, як наслідок, повністю позбутися фотодихання.
Завдяки ефективнішому способу фіксації CO2 відпадає необхідність тримати продихи увесь час відкритими, а отже знижуються втрати води в ході транспірації. Через це C4-рослини здатні рости в посушливих місцях, при високих температурах, в умовах засолення і недостачі CO2. Тим не менш додаткові кроки з фіксації вуглецю в C4-шляху потребують додаткових витрат енергії у формі АТФ. Якщо покласти, що в циклі Кальвіна у C4-рослин, так само як і в C3-рослин, для фіксації однієї молекули CO2 використовується 3 молекули АТФ і 2 молекули НАДФН, то для регенерації акцептора вуглецю в циклі Хетча — Слека, тобто перетворення пірувату в ФЕП, потрібні додаткові 2 молекули АТФ. В результаті на одну молекулу CO2 в C4-шляху витрачається 5 молекул АТФ і 2 молекули НАДФН[2]. Через це C4-рослинам для оптимального росту потрібен вищий рівень інсоляції.
Історія відкриття
Перша згадка про те, що в цукрової тростини першим продуктом фотосинтезу може бути дикарбонова чотиривуглецева кислота, з'явилася 1954 року, у вигляді короткої замітки без посилання, і була опублікована в щорічному звіті експериментальної станції гавайської асоціації цукрових плантаторів. У більш детальному вигляді ця робота з'явилася у вигляді короткого повідомлення за авторством Х. П. Корчака, К. К.Хартта і Г. O. Бурра. Повноцінна стаття цієї групи дослідників була опублікована лише 1965 року. Така велика затримка пояснюється тим, що отримані результати суперечили результатам лабораторії Мелвіна Калвіна, з якою у гавайської групи в той час був тісний контакт[3].
Схожі результати приблизно в той самий час отримали й радянські вчені. В роботах Л. Незговорової (1956—1957 рр.), було встановлено, що при коротких експозиціях листя кукурудзи на світлі 14C із 14CO2 виявляється в аспарагіновій кислоті[4]. Приблизно в той самий час, 1960 року, російський вчений Ю. С. Карпілов опублікував дані, що при радіоактивному міченні в кукурудзи першими утворюються яблучна й аспарагінова кислоти[5]. 1963 року Ю. С. Карпілов спільно зі своїм старшим колегою І. А. Тарчевським опублікував другу статтю, в якій розглядався вплив процедури вбивства листя на радіоактивне мічення продуктів фотосинтезу. Свою наступну статтю на цю тему Карпілов опублікував лише 1969 року. Ні російські, ні гавайські вчені не знали про досягнення один одного аж до 1969 року[3].
Вчені Маршал Девідсон Хетч і Чарльз Роджер Слек, які працювали в лабораторії австралійської компанії CSR Limited у місті Брисбен, знали про результати гавайської групи, починаючи з 1960 року, і 1965 року, коли була опублікована повноцінна стаття, вирішили перевірити ще раз ці дані. Повторивши результати гавайської групи з радіоактивного мічення продуктів фотосинтезу цукрової тростини, вони визначили оксалоацетат як перший акцептор вуглецю, використавши особливу техніку умертвіння. На основі своїх даних вони склали просту робочу модель і 1966 року опублікували статтю, в якій вперше описали цей біохімічний шлях як новий тип фотосинтезу, що принципово відрізняється від циклу Кальвіна[6].
Протягом наступних чотирьох років Хетч і Слек виконали велику роботу з розшифровки C4-шляху: вони постулювали та підтвердили роль ФЕП-карбоксилази у первинній фіксації CO2, ними була відкрита рослинна піруватфосфатдикіназа, трохи раніше виявлена у бактерій, а також раніше невідома НАДФ-залежна малатдегідрогеназа. Крім того вони дослідили локалізацію цих, а також багатьох інших ферментів у клітинах мезофілу і обкладки пучка. Вважалося, що чотиривуглецеві дикарбонові кислоти повинні передавати один атом вуглецю до деякого попередника з утворенням тріозофосфату в реакції перекарбоксилювання. Однак пізніше, коли було виявлено, що в клітинах обкладки у великих кількостях локалізується декарбоксилюючий НАДФ-малік ензим, стало зрозуміло, що CO2 потрапить у цикл Кальвіна в результаті повторної фіксації, і ця гіпотеза відпала. 1970 року Хетч і Слек на міжнародному зібранні в Канберрі представили детальну схему C4-фотосинтезу НАДФ-малатдегідрогеназного типу, де учасниками було висловлено припущення, що цей шлях слугує для концентрування CO2 в клітинах обкладки провідного пучка, яке невдовзі підтвердилося. Значення цього нагнітаючого механізму для подавлення оксигеназної активності Рубіско і фотодихання стало зрозумілим лише протягом наступних кількох років[3].
Спочатку Хетч і Слек назвали описаний ними тип фотосинтезу C4-фотосинтетичним шляхом дикарбонових кислот[3], назвою, яка пізніше була скорочена до C4-фотосинтез. Згодом в літературі цей процес отримав також назву цикл або шлях Хетча — Слека. Також іноді зустрічається назва шлях Хетча — Слека — Карпілова, що підкреслює внесок радянського дослідника.
Анатомія листа
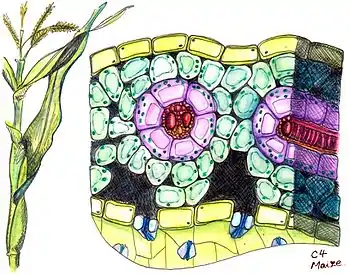
Для C4-рослин характерна особлива структура листа, так звана кранц-анатомія (нім. Kranz — корона, вінець). Вперше такий тип будови листа був описаний 1884 року німецьким ботаніком Готлібом Хаберландтом[7]. Провідні пучки у таких рослин оточені двома шарами зелених клітин асиміляційної паренхіми. Зовнішній шар утворюють клітини мезофілу, не диференційованого на губчасту і палісадну паренхіму, а внутрішній — клітини обкладки судинного пучка. Клітини обкладки зв'язані з клітинами мезофілу великою кількістю плазмодесм, завдяки чому між ними можливий активний обмін метаболітами. Особливістю будови листа C4-рослин є наявність не більше 2—3 шарів клітин мезофілу, що дозволяє легко обмінюватися продуктами фотосинтезу через плазмодесми. Клітини мезофілу та клітини обкладки провідного пучка відрізняються структурно й функціонально. Клітини мезофілу дрібні, розташовані пухко, хлоропласти в них завжди мають грані та вони рідко містять крохмаль. У цих клітинах і розташовується ФЕП-карбоксилаза, яка приєднує CO2 до фосфоенолпірувату з утворенням оксалоацетату. Клітини обкладки більші, з потовщеною, часто суберинізованою, клітинною стінкою, щільно прилягають до судин листа, хлоропласти в них можуть не мати гран і часто містять зерна крохмалю. Тут локалізується фермент Рубіско та протікає звичайний цикл Кальвіна[8].
Для деяких C4-рослин також характерний диморфізм хлоропластів, коли у хлоропластів клітин мезофілу є численні грани, а в клітинах обкладки грани рудиментарні та практично повністю відсутні[9]. Тим не менш такий диморфізм не є необхідним для C4-фотосинтезу й зустрічається лише серед рослин з певним його біохімічним типом[10].
Не у всіх видів C4-рослин є субериновий шар, але всі вони прагнуть запобігти дифузії CO2 із клітин обкладки, тому розташування хлоропластів у цих клітинах стає особливо важливим. У видів із субериновим шаром хлоропласти розташовані відцентрово, тобто на максимальному віддаленні від провідного пучка та ближче до мезофілу. У видів без суберинового шару хлоропласти розташовані доцентрово, впритул до клітинної стінки, максимально наближеної до провідного пучка й на відстані від мезофілу. Такий розподіл хлоропластів подовжує шлях дифузії CO2 та знижує витік у клітини мезофілу[11].
Біохімія
.svg.png.webp)
У C3-рослин темнові реакції фотосинтезу починаються з фіксації CO2 ферментом Рубіско на акцепторі рибулозо-1,5-бісфосфаті з утворенням двох молекул 3-фосфогліцерату. Однак через подвійну, карбоксилазну та оксигеназну активність Рубіско, частина субстрату для фіксації CO2 взаємодіє з киснем і окиснюється, що призводить до втрати субстрату та енергії, а також викликає додаткові витрати з утилізації утвореної двохвуглецевої сполуки, 2-фосфогліколату. Сума цих процесів називається фотодиханням і робить суттєвий внесок у зниження загальної ефективності фотосинтезу.
Щоб подолати обмеження, пов'язані з побічною реакцією Рубіско в умовах низького вмісту в сучасній атмосфері CO2 і високого O2, C4-рослини виробили ефективний механізм концентрування CO2 в місці локалізації Рубіско, створюючи сприятливі умови для роботи цього ферменту. Замість прямої фіксації Рубіско в циклі Кальвіна, CO2 асимілюється в клітинах мезофілу у вигляді чотиривуглецевої органічної кислоти, яка потім транспортується в клітини обкладки судинних пучків, де декарбоксилюється, вивільняючи CO2. Анатомічною передумовою нагнітання CO2 є більша кількість клітин мезофілу (близько 5—7 на одну клітину обкладки). Таким чином, CO2, попередньо зафіксований у п'яти клітинах, потрапляє в одну[12]. В клітинах обкладки CO2 надходить до звичайного циклу Кальвіна, де вторинно фіксується Рубіско та використовується для синтезу вуглеводів. Завдяки постійному градієнту метаболітів, а також непроникній для CO2 стінці клітин обкладки, концентрація CO2 в сайті карбоксилювання Рубіско навіть при закритих продихах зростає у 14 разів порівняно з рівноважною концентрацією CO2 у воді (з 5 мкмоль/л до 70 мкмоль/л відповідно)[13]. При таких високих концентраціях CO2 в сайті карбоксилювання оксигеназна реакція значно подавлена, зростає ефективність фотосинтезу, знижуються втрати енергії на фотодихання.
Первинну фіксацію CO2 у C4-рослин здійснює фермент фосфоенолпіруваткарбоксилаза або ФЕП-карбоксилаза, розташована в клітинах мезофілу. На відміну від Рубіско, вона фіксує вуглекислий газ у формі гідрокарбонат-іона HCO3−, а не CO2. Оскільки як субстрат використовується заряджена молекула, то повністю виключається побічна реакція з незарядженою молекулою на кшталт O2, яка до того ж відрізняється від гідрокарбонату за просторовою будовою. Ефективність механізму попередньої фіксації CO2 з допомогою ФЕП-карбоксилази полягає не у високій спорідненості ферменту до субстрату (Km(HCO3−) = 0,2—0,4 ммоль/л для ФЕП-карбоксилази[12] проти Km(CO2) = 10—15 мкмоль/л для Рубіско[14]), а в тому, що в цитозолі при нормальній температурі та pH 8 відношення HCO3−:CO2 становить близько 50:1. Таким чином, ФЕП-карбоксилаза, на відміну від Рубіско, може приєднувати форму вуглекислоти, що домінує в цій рівноважній реакції, та результативно виконувати фіксацію CO2, навіть якщо при напівзакритих продихах концентрація розчиненого у воді CO2 впаде нижче рівня, прийнятного для Рубіско[15]. Утворення HCO3− з CO2 відбувається за участі цинковмісного ферменту карбоангідрази, яка також локалізована в цитозолі клітин мезофілу та прискорює встановлення рівноваги між двома формами вуглекислоти:
ФЕП-карбоксилаза каталізує необоротну конденсацію молекул ФЕП і HCO3− з утворенням оксалоацетату. ФЕП-карбоксилаза має дуже високу спорідненість із ФЕП. Оксалоацетат перетворюється в малат або ж в аспартат і в такому вигляді транспортується в клітини обкладки, де знову стає малатом і піддається окиснювальному декарбоксилюванню:
|
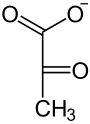
В результаті окислювального декарбоксилювання з малату утворюється CO2 і піруват, який в тій чи іншій формі повертається в клітини мезофілу, де знову перетворюється у ФЕП з допомогою розташованого в хлоропластах ферменту піруватортофосфатдикінази. Реакція, що каталізується ферментом, є доволі незвичною, назва «дикіназа» означає фермент, який каталізує двократне фосфорилювання. На першій, оборотній стадії реакції один фосфатний залишок передається з АТФ на неорганічний фосфат з утворенням пірофосфату, а другий (Фβ) приєднується до пірувату. Локалізована в стромі хлоропластів пірофосфатаза миттєво гідролізує утворений пірофосфат, що робить реакцію необоротною[16]. Таким чином відбувається регенерація акцептора вуглекислого газу та замикання циклу.
|
Ефективний механізм вуглекислотного концентрування дозволяє C4-рослинам створити такий дифузний тік, щоб забезпечити достатнє надходження вуглекислого газу навіть при збільшеному опорі продихів. Саме цей ефект дозволяє витрачати майже у два рази менше води на фіксацію однієї молекули CO2, ніж у C3-рослин, адже зі зменшенням ширини продихової щілини пропорційно падають і втрати води[13].
Три типи C4-фотосинтезу
У відповідності до типу C4-кислоти, яка є переносником вуглекислого газу в клітини обкладки (малат чи аспартат), C3-продукту, який повертається в клітини мезофілу для регенерації (пируват чи аланін), а також до характеру декарбоксилюючих реакцій в клітинах обкладки виділяють три варіанти C4-шляху фотосинтезу[17]:
- НАДФ+-малатдегідрогеназний тип: Малат піддається окислювальному декарбоксилюванню в хлоропластах під дією НАДФ-залежної декарбоксилюючої малатдегідрогенази (НАДФ-залежний малік-ензим) з утворенням молекули НАДФH і CO2.
- НАД+-малатдегідрогеназний тип: Малат декарбоксилюється в мітохондріях з допомогою НАД-залежної декарбоксилюючої малатдегідрогенази (НАД-залежний малік-ензим) з утворенням однієї молекули НАДН. Виділений діоксид вуглецю дифундує в хлоропласти.
- ФЕП-карбоксикіназний тип: Малат декарбоксилюється в мітохондріях за НАД-малатдегідрогеназним типом, але на додаток відбувається пряме декарбоксилювання оксалоацетату в цитоплазмі ФЕП-карбоксикіназою з витратою однієї молекули АТФ і утворенням ФЕП.
ФЕП-карбоксикіназа (ФЕПКК) була виявлена у такої типової НАДФ-МДГ рослини, як кукурудза, що дозволяє їй транспортувати вуглекислоту в формі аспартату (близько 25 %); багато дводольних C4-рослин також містять ФЕПКК на додачу до основного декарбоксилюючого ферменту. Співіснування різних типів C4-фотосинтезу, наприклад, НАДФ-МДГ і ФЕПКК чи НАД-МДГ і ФЕПКК, забезпечує рослині додаткову гнучкість та можливість транспортувати інші типи C4-кислот і продуктів, які повертаються в клітини мезофілу для регенерації. Більше того, деякі рослини без ФЕПКК-активності все ж здатні транспортувати декілька метаболітів, наприклад аспартат і малат, як це відбувається у сорго зернового. Кожен зі змішаних типів C4-фотосинтезу, так само як і «чисті» НАДФ- і НАД-малатдекарбоксилазні шляхи мають свої певні екологічні переваги. У цьому смислі слід вважати розділення на три незалежних біохімічних типи відносно умовним[18].
ФЕП-карбоксикіназний тип ніколи не зустрічається у чистому вигляді, і навіть у рослин, що традиційно належать до цього типу, ФЕП-карбоксикіназа забезпечує хоч і більшу, але ніколи всю декарбоксилюючу активність. Крім цього, ФЕП-карбоксикіназа широко використовується як допоміжна декарбоксилаза рослинами з НАДФ- і НАД-МДГ типами. Через це було запропоновано поділяти C4-фотосинтез лише на НАДФ- і НАД-малатдегідрогеназні типи, які чітко відрізняються за декарбоксилюючим ферментом та планом будови, а ФЕП-карбоксилазний тип розглядати як допоміжний, анаплеротичний шлях, який в різній мірі використовується різними рослинами[18]
НАДФ-малатдегідрогеназний тип (НАДФ-МДГ)
.svg.png.webp)
НАДФ-малатдегідрогеназний тип (НАДФ-МДГ)[12] або НАДФ-малікензимний тип (НАДФ-МЕ)[19] історично був першим дослідженим біохімічним типом C4-фотосинтезу. Цим шляхом здійснюють фотосинтез такі важливі сільськогосподарські культури, як кукурудза, сорго, росичка і цукрова тростина[20]. Як транспортні продукти використовуються малат і піруват.
Оксалоацетат, що утворюється в результаті карбоксилювання ФЕП, з допомогою специфічного переносника транспортується в хлоропласти, де відновлюється НАДФ-малатдегідрогеназою до малату. Утворений малат виноситься в цитозоль і дифундує з клітин мезофілу в клітини обкладки через плазмодесми. Малік-ензим, який локалізований в хлоропластах клітин обкладки, каталізує перетворення малату в піруват з виділенням CO2, який фіксується Рубіско. Утворенний піруват за участі специфічного переносника експортується з хлоропластів клітин обкладки та дифундує через плазмодесми в клітини мезофілу, де він з допомогою іншого переносника входить у хлоропласти, де фермент піруватфосфатдикіназа знову перетворює його у ФЕП[12].
Оскільки хлоропласти клітин обкладки, на відміну від хлоропластів клітин мезофілу, не містять карбоангідрази, дифузія CO2 в стромі клітин обкладки відбувається повільніше, ніж у клітинах мезофілу. Субериновий шар між клітинами обкладки та мезофілу в деяких рослин, ймовірно, також ускладнює витік CO2 через клітинні стінки, так що залишається лише можливість витоку через плазмодесми. Частку CO2, який був сконцентрований у клітинах обкладки, але внаслідок витоку дифундував назад у клітини мезофілу, оцінюють як 10—30 % для різних видів[21].
Для рослин, що мають цей тип C4-фотосинтезу, характерна наявність диморфізму хлоропластів. Хлоропласти клітин мезофілу мають багато гран, у той час як хлоропласти клітин обкладки містять переважно стромальні ламели й малу кількість гранальних стопок з низькою активністю фотосистеми II, що дозволяє зменшити вміст кисню в сайті активності Рубіско. Існує градація в кількості гран хлоропластів клітин обкладки, починаючи з рудиментарних гран у кукурудзи й росички та аж до повної їх відсутності в сорго і цукрової тростини[22]. Агранальні хлоропласти клітин обкладки здійснюють циклічне фосфорилювання за участі фотосистеми I і синтезують лише АТФ. Усі відновлювальні еквіваленти, необхідні для циклу Кальвіна, забезпечують клітини мезофілу за рахунок нециклічного електронного транспорту. Окиснення в клітинах обкладки малату забезпечує не більше третини від необхідних для роботи циклу Кальвіна НАДФН. Інша частина НАДФН разом із АТФ поставляється з хлоропластів клітин мезофілу в хлоропласти клітин обкладки з допомогою тріозофосфат-3-фосфогліцератного човникового механізму, через тріозофосфатний переносник внутрішньої мембрани відповідних хлоропластів[23].
НАД-малатдегідрогеназний тип (НАД-МДГ)
.svg.png.webp)
НАД-малатдегідрогеназний тип (НАД-МДГ)[12] або НАД-малікензимний тип (НАД-МЕ)[19] виявлений у більшості видів, включаючи просо, амарант, портулак[17], іван-чай і лободу[24]. Хлоропласти як клітин мезофілу, так і клітин обкладки мають грани та активну фотосистему II[25]. Клітини обкладки містять багато великих мітохондрій з добре розвинутими кристами[26]. Як транспортні продукти використовуються аспартат і аланін.
У цьому випадку оксалоацетат, який утворюється в реакції ФЕП-карбоксилази, перетворюється в аспартат шляхом переамінування, яке каталізує глутамат-аспартатамінотрансфераза. Оскільки концентрація глутамату в клітині велика, він зручний для підтримання дифузійного потоку між клітинами мезофілу та обкладки. В результаті трансамінування концентрація аспартату стає у 5 разів вища від концентрації оксалоацетату, що створює сильний дифузійний потік. Після дифузії в клітини обкладки аспартат транспортується в мітохондрії. Мітохондріальна ізоферментная форма глутамат-аспартатамінотрансферази каталізує перетворення аспартату в оксалоацетат, який потім відновлюється НАД-малатдегідрогеназою до малату. Малат декарбоксилюється НАД-малік-ензимом з утворенням пірувату, а НАД+, утворений в реакції відновлення оксалоацетату, знову відновлюється до НАДН. Утворений в ході реакції CO2 дифундує в хлоропласти, де асимілюється за участі Рубіско. Піруват виходить із мітохондрій і в цитозолі перетворюється в аланін за участі аланін-глутаматамінотрансферази. Оскільки ця реакція рівноважна, а концентрація аланіну набагато вища, ніж пірувату, виникає інтенсивний дифузійний потік аланіну в клітини мезофілу. В клітинах мезофілу аланін перетворюється у піруват за участі тієї ж амінотрансферази, яка згадувалася вище. Піруват транспортується в хлоропласти, де перетворюється у ФЕП за участі піруватфосфатдикінази так само, як і у випадку з НАДФ-МДГ типом[25].
ФЕП-карбоксикіназний тип (ФЕПКК)
.svg.png.webp)
ФЕП-карбоксикіназний тип (ФЕПКК чи ФЕП-КК)[12] був виявлений у кількох швидкорослих тропічних злаків, які використовуються як кормові культури. Цей шлях фотосинтезу використовує частина представників роду просо (гвінейська трава), хлоріс гаянська[20] та баклажан[24]. Хлоропласти як клітин мезофілу, так і клітин обкладки мають грани й активну фотосистему II[25]. Як транспортні продукти використовуються аспартат, аланін, малат і фосфоенолпіруват.
Як і в C4-метаболізмі НАД-МДГ типу, оксалоацетат перетворюється в аспартат у клітинах мезофілу. Аспартат дифундує в клітини обкладки, де за участі амінотрансферази, локалізованої в цитозолі, відбувається регенерація оксалоацетату. В цитозолі під дією ферменту ФЕП-карбоксикінази оксалоацетат перетворюється у ФЕП з витратою АТФ. Виділений в реакції CO2 дифундує в хлоропласти, а ФЕП дифундує назад у клітини мезофілу. У рослин цього типу витрати АТФ на накачування CO2 в клітини обкладки пов'язані виключно зі споживанням АТФ ФЕП-карбоксикіназою. Мітохондрії забезпечують цю реакцію необхідною кількістю АТФ, окиснюючи малат за участі НАД-малік-ензиму. Джерелом малату, як і у випадку НАДФ-малатдегідрогеназного типу, є клітини мезофілу. Таким чином, у метаболізмі C4-ФЕП-карбоксикіназного типу лише невелика частина CO2 вивільняється в мітохондріях, а більша частина — в цитозолі[27].
Регуляція
C4-фотосинтез регулюється за трьома головними ферментами, кожен з яких активується світлом, так що C4-шлях активний виключно у світлу пору доби.
ФЕП-карбоксилаза регулюється двома шляхами: через фосфорилювання та алостерично. Основними алостеричними інгібіторами ФЕП-карбоксилази є карбонові кислоти, такі як малат і аспартат[28][29]. Оскільки малат утворюється на наступному кроці САМ- і C4-циклів, одразу після того, як ФЕП-карбоксилаза каталізує конденсацію CО2 та ФЕП в оксалоацетат, то утворюється зворотний зв'язок. І аспартат, і оксалоацетат легко перетворюються один в одного за механізмом трансамінування; таким чином, високі концентрації аспартату шляхом зворотного зв'язку інгібують ФЕП-карбоксилазу.
Основні алостеричні активатори ФЕП-карбоксилази у рослин — це тріозофосфати[30] і фруктозо-1,6-бісфосфат[31]. Обидві молекули є індикаторами активного гліколізу та сигналізують про необхідність виробництва оксалоацетату, щоб підсилити потік речовини через цикл трикарбонових кислот. Крім того, збільшення гліколізу означає підсилене постачання ФЕП і, отже, більше акцептора для фіксації CО2 та транспорту його в цикл Кальвіна.
Коли лист перебуває у темряві, активність ФЕП-карбоксилази низька. У цьому випадку спорідненість ферменту до субстрату, ФЕП, дуже низька; процес також інгібується низькими концентраціями малату. Тому в темну пору доби фермент у листі практично неактивний. При освітленні листа невідомим шляхом активується кіназа ФЕП-карбоксилази, яка фосфорилює гідроксильну групу серинового залишку в білці ФЕП-карбоксилази. Кіназа ФЕП-карбоксилази швидко розпадається, тому кількість ферменту в клітині визначається інтенсивністю транскрипції гена. ФЕП-карбоксилаза може знову бути інактивована у випадку вилучення фосфатної групи специфічною фосфатазою. Активований (фосфорильований) фермент також інгібується малатом, але в цьому випадку для досягнення ефекту необхідні вищі концентрації малату. Як кіназа, так і фосфатаза регулюються на рівні транскрипції. Існує також думка, що малат забезпечує зворотний зв'язок у цьому процесі, знижуючи рівень експресії кінази та підвищуючи експресію фосфатази[29]
.svg.png.webp)
Піруватфосфатдикіназа (ПФДК) також є залежним від світла ферментом. Вона інактивується в темряві за рахунок фосфорилювання за залишком треоніну. Цю реакцію здійснює незвичайний біфункціональний ПФДК-регулюючий протеїн (ПФДК-РП чи ПДРП). Він одночасно має кіназну та фосфатазну активність. Фосфорилювання доволі незвичне, оскільки як донор фосфатної групи використовується переважно АДФ, а не АТФ. Незвична і реакція дефосфорилювання: замість молекули води ПФРП переносить відщеплювану фосфатну групу на вільний неорганічний фосфат (Фн) з утворенням пірофосфату (ФФн). Активність ПДРП залежить від рівня АДФ в стромі хлоропластів. АДФ є субстратом для кіназної активності та одночасно сильним конкурентним інгібітором фосфатазної. У темряві рівень АДФ значно підвищується, в результаті чого подавляється фосфатазна активність. На світлі, за рахунок фотофосфорилювання, концентрація АДФ різко зменшується, не залишається субстрату для кіназної реакції, а фосфатазна перестає подавлятися. В результаті ПДРП відщеплює фосфат від піруватфосфатдикінази та активує її[32].
НАДФ-малатдепадрогеназа активується світлом за рахунок роботи фередоксин-тіоредоксинової системи. В ході світлових реакцій фотосинтезу енергія світла живить транспорт електронів від води до фередоксину. Фермент фередоксин-тіоредоксинредуктаза використовує відновлений фередоксин для відновлення дисульфідного зв'язку тіоредоксину з дисульфіду до дитіолу. Відновлений тіоредоксин відновлює цистеїн-цистеїновий дисульфідний зв'язок у НАДФ-малатдепадрогеназі, що переводить фермент в активну форму[27].
Дискримінація ізотопів
Зручний метод ідентифікації C4-рослин базується на визначенні співвідношення ізотопів вуглецю 13C/12C. Метод базується на тому, що рослини під час фотосинтезу поглинають природні ізотопи вуглецю в різних кількостях (в атмосферному CO2 міститься 98,89 % 12C і 1,11 % 13C). В цілому рослини надають перевагу 12CO2, в меншій мірі поглинають 13CO2 і ще менше — 14CO2. Франкціонування 13CO2 більш виражене при роботі Рубіско, оскільки каталізована цим ферментом реакція протікає повільніше, і легший ізотоп 12CO2 фіксується ферментом набагато охочіше, ніж повільно дифундуючий 13CO2. Швидша ФЕП-карбоксидаза не розрізняє ізотопи, а оскільки у C4-рослин Рубіско реалізує практично увесь попередньо зафіксований ФЕП-карбоксилазою CO2, то відсоток 13C в C4-рослині відповідає продукту ФЕП-карбоксилазної реакції, в той час як у C3-рослині визначається за співвідношенням ізотопів, характерним для Рубіско. Відповідно C4-рослини містять відносно вищий відсоток 13C, вуглеводи, виділені з C4-рослин, важчі, ніж цукри з C3-рослин[20]. Співвідношення 13C/12C визначається мас-спектрометричними методами і виражається значенням δ13C, яке є відхиленням ізотопного складу досліджуваного зразка (13C/12C)зраз від ізотопного складу стандарту (13C/12C)ст. Стандартом (PDB або Чиказьким стандартом) є співвідношення ізотопів у кальциті скам'янілості Belemnitella americana крейдового періоду; δ13C у досліджуваному зразку прийнято виражати в проміле таким чином[33]:
Чим більше за модулем від'ємне значення δ13C, тим менше вміст ізотопу 13C. У C4-рослин значення δ13C становить близько −14 ‰, у C3-рослин — близько −28 ‰. Оскільки цукрова тростина є C4-рослиною, а цукровий буряк — C3-рослиною, за вмістом ізотопу 13C можна мас-спектрометрично визначити походження сахарози. Таким способом можна, наприклад, відрізнити справжній ром (виготовлений із цукрової тростини) від купажованого (з додаванням цукру, виготовленого з буряка)[20].
Особливі форми C4-фотосинтезу
C4-фотосинтез без кранц-анатомії
.svg.png.webp)
Хоча більшість C4-рослин мають кранц-анатомію, є декілька видів, що здійснюють C4-цикл без розділення на клітини обкладки та мезофілу. Ці чотири рослини належать до підродини лободові: Suaeda aralocaspica, Bienertia cycloptera, Bienertia sinuspersici і Bienertia kavirense. Вони ростуть у пустельних, засолених районах Середнього Сходу: B. sinuspersici у різних країнах Перської затоки, B. cycloptera в Туреччині, Афганістані та Ірані, B. kavirense в іранській соляній пустелі (Деште-Кевір), а С. aralocaspica біля соляних заводів у Центральній Азії. Для них характерний унікальний C4-механізм нагнітання CO2 в рамках однієї клітини[34][35][36][37]. Усі перераховані вище рослини належать до НАД-МДГ біохімічного типу[38].
Хоча цитологічна будова у двох родах відрізняється, головний принцип в обидвох випадках полягає у використанні великих вакуолей для розділення клітини на два відсіки. S. aralocaspica має дуже довгі клітини палісадної паренхіми, розділені на два відсіки великою вакуоллю, яка займає майже увесь простір клітини. Паренхіма розташовується в один шар і щільніше упакована з зовнішнього боку листа, але пухкіше з внутрішнього. У ближньому до епідерми листа (дистальному) регіоні розташовуються хлоропласти з низьким вмістом гран і без Рубіско, тут відбувається синтез ФЕП із пірувату з допомогою фермент піруватфосфатдикінази. На внутрішній (проксимальній) ділянці розташовані звичайні гранальні хлоропласти й мітохондрії, тут є Рубіско та діє цикл Кальвіна[38].
Представники роду Bienertia мають іншу будову. Паренхіма листа розташовується у два-три шари. Більша частина клітини заповнена вакуолями та розбита на тонку цитозольну смужку на периферії та незвичайний центральний відсік з великою кількістю хлоропластів всередині. Тут спостерігається деякий аналог кранц-анатомії, на периферії розташовуються великі хлоропласти зі зменшеною кількістю гран і неповним набором ферментів циклу Кальвіна, де відбувається регенерація ФЕП, а в центрі розташоване скупчення вдвічі менших хлоропластів з нормальними гранами й активною Рубіско, де протікає цикл Кальвіна. Разом із цими хлоропластами в центрі розташовані мітохондрії та пероксисоми[38].
В обидвох випадках за розподіл двох типів хлоропластів по клітині відповідає актиновий та мікротрубочковий цитоскелет. Також при одноклітинному C4-фотосинтезі не відбувається відособлення ФЕП-карбоксилази, вона рівномірно розташовується по всій клітині. У зв'язку з цим виникає питання про можливий механізм її інгібування в місці роботи Рубіско, щоб уникнути повторної фіксації вивільненого CO2[38].
Іншим прикладом C4-фотосинтезу без кранц-анатомії може бути морська зелена макроводорость Udotea flabellum[39] і одноклітинна діатомею Thalassiosira weissflogii[40].
Факультативний C4-фотосинтез

Hydrilla verticillata — прісноводна занурена квіткова рослина, яка в літній час збирається у великі мати під поверхнею води. В умовах високої температури, низького вмісту CO2 та високого O2 рослина переходить від C3- до C4-фотосинтезу. Оскільки в Hydrilla verticillata немає кранц-анатомії, увесь процес відбувається всередині однієї клітини. Фотосинтез іде за НАДФ-МДГ біохімічним шляхом, у цитоплазмі відбувається індукція синтезу ФЕП-карбоксилази, а також ряду інших білків: малік-ензиму, ПФДК та амінотрансфераз. Головний декарбоксилюючий фермент — НАДФ-малік-ензим розташовується в хлоропластах, там само діє піруватфосфатдикіназа, що регенерує ФЕП[41].
Іншим прикладом переключення між C3- і C4-метаболізмом може бути безлисту осоку Елеохаріс живородний, яка може рости як у зануреному вигляді, так і на суші. Листя цієї рослини повністю редуковані й функцію фотосинтезу беруть на себе стебла. При росте під водою вона фотосинтезує за C3-шляхом, але на суші переходить до C4-метаболізму разом з утворенням кранц-анатомії — цей процес контролюється абсцизиновою кислотою. При цьому до C4 можуть переходити навіть просто пагони, що опинилися над поверхнею води[41].
Суміщення C4 і CAM
 Portulaca mundula |
.jpg.webp) Portulaca grandiflora |
Portulaca mundula і дика Portulaca grandiflora |
Метаболізм за типом товстолистих (САМ-фотосинтез) включає в себе деякі ферменти C4-фотосинтезу, необхідні для нагнітання і концентрування CO2. Однак у випадку САМ-рослин попередня та остаточна фіксація CO2 розділені не у просторі, а в часі. Тим не менш протягом дня в облігатних CAM-рослинах може паралельно працювати CAM-шлях і класичний C3-фотосинтез. Були навіть виявлені види факультативних CAM-рослин (C3-CAM), які переключалися з C3- на CAM-метаболізм лише в умовах посухи чи засолення. У цьому випадку всередині однієї клітини може протікати C3- і CAM-фотосинтез.
Існує дуже мало прикладів, коли CAM- і C4-метаболізм протікають в одній рослині. Більшість C4-рослин представлено злаками, в яких ніколи не виявляється CAM-фотосинтез, так само як і в типових CAM-рослин, таких як орхідеї чи бромелієві, не виявлений чистий C4-фотосинтез. Лише декілька видів рослин із роду портулак можуть використовувати обидва шляхи, до них належать Portulaca grandiflora і Portulaca mundula[42]. У цих рослин CAM-фотосинтез відбувається в наповнених соком внутрішніх клітинах стебла та листя, де запасається вода, в той час як C4-фотосинтез іде у зовнішніх клітинах листа. Таким чином, навіть у цих рослин обидва шляхи не працюють в одній і тій самій клітині, з чого випливає, що CAM- і C4- фотосинтез несумісні[43].
Як пояснення наводяться декілька причин. Наприклад, було б важко точно регулювати обидва шляхи через їхню біохімічну подібність. До того ж в основі кожного з них лежить різна анатомічна будова та транспортні механізми, які мають важливе значення для відповідної функції, але не можуть бути об'єднані в одній клітині. І, нарешті, два одночасних шляхи концентрації CO2 не забезпечують екологічної переваги.
C3-C4 перехідні форми
Деякі C3-рослини мають типові морфологічні ознаки C4-рослин, такі як анатомічна організація листя з розділенням паренхіми на мезофіл і обкладку провідного пучка, де вони можуть концентрувати вуглекислий газ. Крім того, значення їх вуглекислотного компенсаційного пункту розташовується між такими для C3- і C4-рослин. В той самий час використовуваний ними механізм концентрування CO2 зовсім не характерний для C4-рослин[44].
Такі рослини через їхню анатомічну подібність помилково назвали C3-C4 перехідними формами або «C3-C4-гібридами», хоча така назва в принципі не правильна через іншу біохімію механізму концентрації CO2[45].
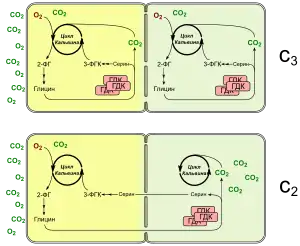
В основі концентрувального механізму цих рослин лежить так званий C2-фотосинтез, що використовує ферменти фотодихання. Якщо Рубіско використовує як субстрат кисень замість вуглекислого газу, утворюється 2-фосфогліколат, який переробляється в процесі фотодихання. В пероксисомах гліколат перетворюється в гліцин, дві молекули гліцину конденсуються з утворенням серину та CO2 з допомогою гліциндекарбоксилазного комплексу (ГДК). У C3-C4 перехідних рослин активний ГДК локалізується лише в клітинах обкладки пучка, так що транспортований із мезофілу гліцин декарбоксилюється там і збагачує клітини CO2. У клітинах мезофілу також експресуються білки ГДК, але тут він не активний, оскільки одна чи декілька експресованих субодиниць містять мутації. Через гліцин-сериновий човник і транспорт C2-сполук таку форму обміну речовин іноді називають «C2-фотосинтезом». Перевага такого човникового механізму полягає в тому, що CO2 вивільняється не у кожній клітині окремо, а концентрується всередині клітин обкладки. В результаті значно збільшується шанс для повторного захоплення вуглекислого газу, покращуються умови роботи Рубіско, а отже знижується фотодихання та пов'язані з ним витрати енергії.
Подібний механізм, спрямований на зниження фотодихання, виявлений принаймні у таких восьми родин вищих рослин: Aizoaceae, Poaceae, Boraginaceae, Brassicaceae, Asteraceae, Amaranthaceae, Chenopodiaceae і Cleomaceae[46]. У деяких рослин із роду Flaveria (Asteraceae) гліциновий човник функціонує разом зі звичайним C4-фотосинтезом[46].
Екологія
Згідно з останніми даними C4-фотосинтез незалежно виникав принаймні 65 разів у 19 різних родинах, і є неперевершеним прикладом конвергентної еволюції[47][48]. У багатьох родах зустрічаються види як C3, так і C4.
C4-рослини становлять 5 % від усієї рослинної біомаси та 3 % від загальної кількості видів рослин[49][50]. Ними заселено всього 17 % поверхні Землі, але вони здійснюють близько 30 % наземного фотосинтезу[51]. Всього відомо близько 8100 видів[52], що використовують C4-шлях фіксації вуглецю, всі вони належать до квіткових рослин. Серед дводольних цей шлях використовують лише 4,5 % від усіх рослин, а серед однодольних — 40 %. Незважаючи на це, в кладі однодольних C4-рослини зустрічаються лише у трьох родинах, у той час як у дводольних — в 16 родинах. Найбільш численна група C4-рослин серед однодольних — це, без сумніву, трави; 46 % від усіх трав використовують C4-фотосинтез, що відповідає 60 % від усіх видів C4-рослин. До цієї групи належать такі сільськогосподарські культури як кукурудза, цукрова тростина, пшоно та сорго[53][54]. В кладі дводольних максимальна кількість C4-видів припадає на ряд Caryophyllales. З усіх родин Caryophyllales найбагатшою в цьому відношенні є родина Chenopodiaceae, в якій 550 із 1400 видів використовують C4-фотосинтез. Близько 250 із 1000 видів близькоспоріднених Amaranthaceae також використовують C4-фотосинтез[49][55].
Більшість C4-рослин росте у тропіках і субтропіках нижче широти 45° в умовах високої температури, недостачі води й надлишку сонячного світла. Саме в таких кліматичних умовах вони можуть успішно конкурувати з C3-рослинами завдяки відсутності фотодихання. Однак це не означає домінування C4-метаболізму в посушливих і теплих умовах. Так, у південно-східних Каракумах було знайдено лише чотири види C4-рослин[56]. Розповідаючи про посушливі й теплі місця, слід відмітити, що C4-види ростуть у помірно-арідних умовах, коли вода є, але її не завжди вистачає. В екстра-арідних умовах переважають CAM-рослини[57].
Аналіз флори Північної Америки показав, що в Каліфорнії C4-рослини становлять 4,38 % усіх видів, а серед злаків — 82 %, в той час як в районі Великих озер у Квебеку — лише 0,17 % усіх видів і 12 % серед злаків. У тропічних дощових лісах C4-види практично відсутні[56]. В каліфорнійській Долині Смерті 70 % від усіх видів є C4-рослинами[57]. Переважають вони і в південних степах та саванах. C4-види становлять понад дві третини від усіх видів трав нижче широти 30°, в той час як вище широти 50° переважають C3-трави. На широті 35—38° флора однаково багата C3- і C4-видами[58].
У помірному кліматі C4-види переважно активні пізно навесні та влітку. C3-види, навпаки, активні протягом усього року. В місцях із суворими зимами C3-види зазвичай починають рости на кілька тижнів раніше, ніж C4-види.
Зазвичай, C4-трави рідко зустрічаються в холодних регіонах, наприклад, у бореальній зоні між 50-м і 65-м градусом широти або на великій висоті. Винятком є зона безлісої альпійської тундри з її сухим кліматом. Крім того, в Тибеті була виявлена C4-трава Orinus thoroldii, що росте на висоті 5200 метрів. У цілому ж вони не заходять в полярну та приполярну області (за широту 65°)[58].
Багато C4-рослин є стійкими до холоду, сотні C4-багаторічників здатні у стані спокою переживати мороз до −20 °C. Вони прекрасно почувають себе навіть у районах з помірним і прохолодним кліматом, таких як південне узбережжя Нової Зеландії чи прибережні болота на атлантичному узбережжі Канади і Сполученого Королівства. В холодних і посушливих умовах ростуть чагарники з C4-фотосинтезом, наприклад, види роду Atriplex, які можуть вегетувати вже у квітні, при наявності снігу і від'ємних температур. Особливо багато таких рослин в альпійській тундрі, де вони у великій кількості зустрічаються на висоті понад 3500 або навіть 4800 метрів, як це відбувається в Андах. При рості на висоті понад 3500 метрів гірські C4-види здатні переносити нічні заморозки з від'ємними температурами та епізодичні снігопади, які тут можуть відбуватися навіть у середині літа[58].
Аналіз показує, що такі гірські C4-види ростуть у певних мікросайтах, часто на південно-східних схилах між каменів, де не буває вітру, а інтенсивне сонячне світло протягом дня може нагрівати лист на 10—25 °C вище температури повітря, так що фотосинтез протікає при температурі 25—35 °C. Підвищення температури листа вдень є обов'язковою умовою для успішної конкуренції таких високогірних рослин із C3-видами[58].
Абіотичні фактори
.svg.png.webp)
Фотосинтез залежить від ряду абіотичних факторів, що впливають один на одного. Один із таких факторів — концентрація CO2, який фіксується в процесі фотосинтезу. Якщо припустити, що кількість світла у надлишку і сама по собі не є обмежувальним фактором, то можна помітити, що буде відбуватися збільшення швидкості фотосинтезу з ростом концентрації CO2 у навколишньому середовищі. Цей процес обмежений — швидкість фотосинтезу досягає насичення, а при достатньо високих концентраціях навіть може знижуватися. З іншого боку, при занадто низькій концентрації діоксиду вуглецю його фіксація в ході фотосинтезу урівноважується процесами фотодихання та дихання. Точка, в якій обидва процеси перебувають у рівновазі, і називається точкою компенсації CO2.
C4-рослини мають ефективний механізм асиміляції CO2 через фермент ФЕП-карбоксилазу та слабке фотодихання, тому їхня точка компенсації CO2 прямує практично до нуля (< 0,001 об'ємних відсотків CO2[59]). Як видно з графіка, швидкість фотосинтезу в C4-рослин при низькому вмісті CO2 зростає значно швидше, ніж у C3, тому при низьких концентраціях вуглекислого газу C4-рослини завжди мають конкурентну перевагу. Для більшості вищих C3-рослин точка компенсації CO2 відповідає доволі високим концентраціям і становить 0,005—0,015 % CO2[60] у навколишньому повітрі.
З іншого боку, швидкість фотосинтезу C4-рослин виходить на плато та припиняє зростати при вмісті CO2, який трохи вищий за його звичайну концентрацію в повітрі, що пов'язано з повним насиченням ферменту ФЕП-карбоксилази. У C3-рослин швидкість фотосинтезу продовжує зростати і після двократного збільшення вмісту CO2 у порівнянні з нормою. Насичення фотосинтезу в них досягається приблизно при 0,05—0,10 % CO2[59]. У зв'язку з цим неодноразово висловлювалася думка, що збільшення антропогенних викидів CO2 зміщує екологічну рівновагу на користь C3-рослин[52].
Як уже згадувалося, завдяки нагнітанню вуглекислоти C4-рослини можуть тримати продихи у більш закритому положенні та значно економити воду. Втрати води на транспірацію у C4-рослин становлять 250—350 г H2O при збільшенні сухої ваги рослини на 1 г, а у C3 — 450—950 г[24].
У C4-рослин світлова точка компенсації розташовується значно вище, ніж у C3-рослин, їм потрібно набагато більше світла, щоб повноцінно існувати та рости. Тим не менш, при високій освітленості вони набагато переважають C3-рослини за інтенсивністю фотосинтезу та швидкістю росту[61]. У природних умовах у C4-рослин світлове насичення не досягається, і в ясні дні вони використовують світло повністю навіть у південь, однак висока точка світлової компенсації накладає обмеження на їхній ріст в умовах низької освітленості, тобто їхній ріст обмежується світлом, і лише тоді, коли сильна недостача води змушує їх закрити продихи, і, отже, знизити споживання вуглекислого газу, їхній ріст обмежується концентрацією CO2[62].
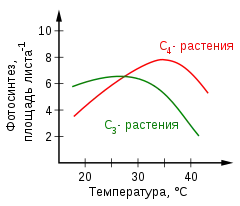
Відомо, що робота концентруючого механізму C4-рослин потребує додаткових витрат енергії у формі АТФ та НАДФН: 3 молекули АТФ і 2 молекули НАДФН на одну молекулу CO2 для C3-шляху та 5 молекул АТФ і 2 молекули НАДФН у випадку C4-шляху. У всякому разі, витрати окупляються, оскільки при високих концентраціях CO2 в сайті кабоксилювання оксигеназна реакція значною мірою подавлена, і втрати енергії у фотодиханні значно знижені. Тому C4-метаболізм не обов'язково потребує великих енерговитрат; насправді при підвищених температурах C4-фотосинтез енергетично більш вигідний, ніж C3-фотосинтез, про що свідчить графік температурної залежності фотосинтезу. Причина цього полягає в тому, що оскільки вміст кисню в атмосфері значно вищий від вмісту вуглекислого газу, оксигеназна активність Рубіско з підвищенням температури зростає сильніше, ніж карбоксилазна. Тому в умовах теплого клімату C4-рослини, в яких не лише знижена потреба у водопостачанні, але й подавлене фотодихання, мають значну перевагу порівняно з C3-рослинами[63].
Для більшості C3-рослин помірної кліматичної зони температурний оптимум фотосинтезу припадає на 25—30 °C. У рослин із C4- і CAM-метаболізмом температурний оптимум припадає на 30—35 °C[60].
Крім того, C4-метаболізм забезпечує рослинам ефективніше використання азоту. Завдяки наявності концентраційного механізму їм потрібна значно менша кількість Рубіско, ніж C3-рослинам, які компенсують низьку концентрацію CO2 в сайті карбоксилювання високим вмістом Рубіско в хлоропластах. Підраховано, що C4-рослині потрібно близько 13—20 % від кількості Рубіско C3-рослини для того, щоб досягти тієї ж швидкості фотосинтезу. Вільний азот, який не витрачається на Рубіско, іде на синтез білків люмена та водорозчинних білків[64]. Підраховано, що ефективність використання азоту в розрахунку на площу листа у C4-рослин вища, ніж у C3. Це, однак, не означає, що в них міститься менше азоту чи що вони ростуть на бідних азотом ґрунтах. Наприклад, C4-трави, що використовуються для засіву газонів, є досить вимогливими до наявності у ґрунті поживних речовин, оскільки еволюціонували в умовах, у яких поживні речовини були в надлишку[65].
Обмеженість життєвих форм
Майже всі C4-рослини представлені травами та чагарниками — серед них немає дерев. Тому в місцях, де переважно ростуть C4-рослини, не утворюється лісів і формується зовсім інший ландшафт. Винятком є ендемічні для Гавайських островів представники роду Euphorbia, що досягають висоти від 6 до 10 метрів. Euphorbia herbstii — тіньовитривале дерево з острова Оаху, яке росте в тіні інших дерев; Euphorbia olowaluena росте в сухих лісових масивах на острові Гаваї. Два других види, що ростуть на Гаваях, E. remyi та E. rockii, також можуть ставати маленькими деревами висотою до 4 метрів. Ще один виняток із парадигми відсутності серед C4-рослин дерев — саксаул Haloxylon ammodendron, що росте у Казахстані. Його старі особи можуть вирости до 10—12 метрів і утворюють домінуючий, центральний стовбур. Haloxylon ammodendron утворює щільні насадження вздовж рік у Центральній Азії, які іноді називають лісами в широкому смислі цього слова; тим не менш, ці «ліси» швидше нагадують високі зарослі чагарників і не є типовими лісами, як в районах з помірною вологістю, де дерева можуть виростати більше ніж на 20 метрів у висоту[66].
Відсутність, за невеликим винятком, у дерев C4-шляху, а також низька представленість C4-рослин у підліску вже давно є предметом дискусій. Часто висувається гіпотеза, що через підвищені вимоги до енергії C4-фотосинтез неефективний в умовах низької освітленості. Хоча останні дані показують, що C4-рослини дійсно трохи гірше пристосовані до затінення у порівнянні з C3-видами, ця різниця не є настільки суттєвою та не пояснює, чому C4-дерева не змогли сформуватися на більш відкритих просторах. Висловлюються різні пояснення з позиції еволюції, фізіології та екології, але поки що чіткої відповіді на це питання немає[66].
Порівняння характеристик C3-, C4- і CAM-рослин
| Характеристика | C3 | C4 | CAM |
|---|---|---|---|
| Коефіцієнт транспірації мл (H2O) на г (C) | 450–900 | 250–350 | 18–100 (вночі) 150–600 (вдень) |
| Ефективність використання води (г сухої маси/г втрати води) | 1,05–2,22 | 2,85–4,00 | 8,0–55,0 |
| Максимальна швидкість фотосинтезу (мкмоль CO2/площа листя м2 · с) | 20–40 | 30–60 | 5–12 (на світлі) 6–10 (у темряві) |
| Температурний оптимум | 15–25 °C | 30–47 °C | 35 °C |
| Приріст сухої речовини (тон/га · рік) | 10–25 | 40–80 | 6–10 |
| δ-13C | від −32 до −20 ‰ | від −17 до −9 ‰ | від −17 до −9 ‰ (посуха) від −32 до −20 ‰ (хороше забезпечення водою) |
Економічне значення
Серед культурних рослин C4-види (кукурудза, сорго, деякі види проса, цукрова тростина) мають більше значення, ніж серед дикорослих, їхня продуктивність становить від 33 % (із врахуванням залишків, що не використовуються за прямим призначенням, як, наприклад, солома злаків, стебла та листя коренеплодів) до 38 % сумарної продуктивності основних сільськогосподарських культур[69]. Також у цих рослин спостерігаються вищі швидкості росту. В оптимальних умовах зрошення та удобрення посіви кукурудзи та цукрової тростини є найпродуктивнішими з відомих агроценозів[70]. До C4-рослин також належать і найстійкіші бур'яни, включаючи 8 із 10 найбільш злісних бур'янів, наприклад, свинорий пальчастий і куряче просо[71].
C4-рослини також можуть бути використані для виробництва біопалива, як наприклад кукурудза в США чи цукрова тростина в Бразилії. Як альтернативу також розглядають варіант вирощування холодостійких C4-злаків, таких як просо, для виробництва целюлозного етанолу. Наприклад, урожайність холодостійких злаків із роду Міскантус становить 15—29 тон сухої речовини на гектар за рік[64].
Однією з проблем, пов'язаних зі зростанням чисельності населення світу, є виснаження запасів продовольства, тим більше, що кількість доступних для обробки орних земель невпинно зменшується. Один із способів збільшення урожайності — використання C4-фотосинтезу. Найпростіший із відомих підходів полягає у зміні диких, не культивованих C4-видів з метою створення на їхній основі нової сільськогосподарської культури. Наприклад, методами селекції з курячого проса можна було б вивести рисоподібну культурну рослину[72].
Альтернативний підхід полягає у впровадженні C4-шляху в існуючі культурні C3-рослини методами генної інженерії. Головними кандидатами на подібне перетворення є рис, який є хлібною культурою для половини земної кулі, та соя, здатна до симбіотичної азотофіксації. Для роботи у цьому напрямку був зібраний великий міжнародний проект, організований на базі Міжнародного інституту дослідження рису на Філіппінах, під назвою «Проект C4-рис», в який входять 12 лабораторій з восьми країн. У грудні 2015 року проект оголосив про створення культивару рису з рудиментарною формою C4-фотосинтезу. В клітини цього сорту вдалося вбудувати всі основні ферменти C4-шляху, хоча створені рослини поки що переважно покладаються на C3-фотосинтез. Тим не менше, цей результат показав принципову можливість протікання C4-циклу в рисі[73].
Станом на сьогоднішній день усі спроби запустити C4-цикл в рамках однієї клітини шляхом простого вбудовування відповідних ферментів або провалилися, або виявилися вкрай малоефективними. Причиною багатьох ранніх провалів була відсутність у трансформованих рослинах описаних вище білків-регуляторів головних ферментів C4-метаболізму, які забезпечили б їхнє налаштування у відповідності з рівнем освітленості та енергетичним станом клітини, а також необхідних для правильної експресії ключових білків регуляторних генетичних послідовностей. Іншою серйозною перешкодою є відсутність в такій схемі яких-небудь перешкод проти витікання CO2 з клітини. Найбільш очевидним рішенням стало б створення повноцінної кранц-анатомії, однак наразі гени, відповідальні за розвиток такої будови, залишаються невідомими, а їхній пошук залишається пріоритетним напрямком[72].
Біосеквестрація
Одне з напрямків боротьби з парниковим ефектом (Біосеквестрація) передбачає збільшення в Землі частки фотосинтетичних рослин, що фіксують вуглець С4. Рослини С4 становлять близько 5% рослинної біомаси та 1% відомих видів рослин [74] але на них припадає близько 30% наземної фіксації вуглецю. [75]
Еволюція
Згідно з сучасними геологічними даним C4-фотосинтез виник в олігоцені близько 30 мільйонів років до нашої ери[47]. Цей період характеризується падінням температури і концентрації діоксиду вуглецю (з 1000 частин на мільйон до приблизно 300 частин на мільйон). Крім того, атмосферна концентрація О2 збільшилася з 18 % до 21 %. Склалися вкрай несприятливі для C3-фотосинтезу умови, які сприяли високому фотодиханню. Вважається, що саме низька доступність CO2 стала причиною початку відбору рослин з нагнітальними механізмами, що зрештою призвело до появи C4 і CAM. Клімат того часу став більш посушливим, з'явилися відкриті простори з високою освітленістю, підсилилася сезонність і кількість пожеж, що також, ймовірно, сильно вплинуло на відбір ознак C4- і CAM-видів[76].
Зменшення концентрації CO2 вважається важливим еволюційним тригером і загальною передумовою для формування C4-рослин, але не обов'язково головною. Оскільки C4-фотосинтез розвивався протягом 30 мільйонів років з моменту його першої появи, важливу роль, без сумніву, відіграли локальні фактори. Існує шість глобальних центрів, які розглядаються як ядро для багатьох C4-евдикотів і деяких трав: Північна Америка, Південна Америка, Південна Африка, Східна Африка та Аравія, Центральна Азія і Австралія. Це теплі та сухі регіони з помірно-арідним кліматом і регулярними опадами протягом літа. Солоні, піщані чи сухі ґрунти сприяли виникненню і поширенню C4-рослин, іншим сприятливим фактором став високий рівень інсоляції. Близько 23 млн років тому C4-рослини були вже широко поширені в Африці, Америці та Південній Азії. Поширення відбувалося поступово, особливо в області низьких і середніх широт[48].
Глобального, екологічного значення цей тип фотосинтезу набув лише після широкого поширення C4-трав і розширення впливу C4-рослин у лугових екосистемах і саванах. Це відбулося в кінці міоцену і на початку пліоцену близько 2—8 мільйонів років тому. Залишається спірним питання про те, чи було зниження концентрації CO2 в атмосфері глобальним загальним фактором для такого поширення (принаймні, він — важлива передумова до цього). Іншими причинами цілком могли бути зміна клімату, поява великих травоїдних і збільшення частоти лісових пожеж[77].
Етапи формування C4-метаболізму
З еволюційної точки зору перетворення C3-рослин у C4 — доволі нескладний процес: усі необхідні структурні елементи і ферменти вже є в C3-рослин. Наприклад, ферменти ФЕП-карбоксилаза та хлоропластна НАДФ-малатдегідрогеназа в нормі наявна у замикальних клітинах C3-рослин, де забезпечують синтез іонів малату, необхідних для відкривання продихової щілини. Аналогічним чином усі рослини мають ізоформи малік-ензиму, які розташовуються в цитозолі, хлоропластах чи мітохондріях і в нормі забезпечують анаплеротичні шляхи метаболізму.
Сильна кластеризація C4-видів у рамках певних груп, наприклад, клади PACMAD, всередині якої C4-фотосинтез виникав близько 18 разів[48], вказує на те, що не всі C3-рослини однаково добре підходять для виникнення C4-фотосинтезу, і що для цього необхідні сприятливі преадаптації.
На сьогодні процес становлення C4-метаболізму уявляється таким чином: на першому етапі відбувалося накопичення сприятливих преадаптацій, таких як висока кількість жилок у листі, а також повногеномне подвоєння, в результаті якого виникли копії генів, необхідних для C4-шляху. Надалі ці копії пройшли відповідну спеціалізацію. На другому етапі відбувалося послідовне утворення протокранц-анатомії: збільшувались в розмірі клітини обкладки, в них збільшилась кількість органел, відбулося зміщення і кластеризація мітохондрій і хлоропластів. Припускається, що такі перетворення могли бути вигідні рослині, оскільки призвели до появи одноклітинного гліцинового шаттла, який дозволив рослині вивільняти CO2 із метаболітів фотодихання безпосередньо поблизу хлоропластів. Подібні рослини зустрічаються у природі, їхня точка компенсації CO2 на 5—15 % нижча, ніж у типових C3-рослин. На третьому етапі відбулося виникнення повноцінного C2-фотосинтезу: зменшилася кількість клітин мезофілу відносно клітин обкладки пучка, відбулася інактивація ГДК у клітинах мезофілу. На четвертому етапі на основі цих рослин виник повноцінний C4-фотосинтез. Припущення про виникнення C4-видів із C3-C4 перехідних форм виникли, зокрема, на основі того, що у частини останніх активність ФЕП-карбоксилази, ПФДК і НАДФ-МЕ у 2—5 разів вища, ніж у C3-видів. В ході заключного, п'ятого етапу, відбувалася оптимізація та тонке налаштування нового концентраційного механізму для максимально ефективної дії, що і призвело зрештою до появи повноцінних C4-рослин. Повинно було відбутися посилення експресії ключових ферментів і виникнення необхідних регуляторних механізмів, покращення кінетичних якостей ФЕП-карбоксилази, зниження експресії Рубіско в клітинах мезофілу та зміна режиму роботи продихів[78].
Див. також
- ABC-модель розвитку квітки
- CAM-фотосинтез
- Фотодихання
- Фотосинтез
- Біосеквестрація
Примітки
- Ермаков, 2005, с. 196.
- Ермаков, 2005, с. 198.
- Discoveries in Plant Biology / Editors: Shain-dow Kung,Shang-Fa Yang. — Chapter 13; M.D. Hatch and C.R. Slack: C4 Photosynthesis: Discovery, Resolution, Recognition, and Significance, 1998. — Vol. 1. — P. 175-196. — ISBN 981-02-1313-1. (англ.)
- Полевой В. В. Физиология растений. — Высшая школа. — Москва, 1989. — С. 93. — ISBN 5-06-001604-8. (рос.)
- Карпилов Ю. С. Распределение радиоактивного углерода 14C среди продуктов фотосинтеза кукурузы // Труды Казанского сельскохозяйственного института. — 1960. — Т. 41, № 1. — С. 15—24. (рос.)
- M. D. Hatch and C. R. Slack (1966). Photosynthesis by sugar-cane leaves. A new carboxylation reaction and the pathway of sugar formation.. Biochem.J. 101 (1): 103–111. PMID 5971771. (англ.)
- Медведев, 2013, с. 57.
- Страсбургер, 2008, с. 140-142.
- Страсбургер, 2008, с. 140.
- Donat-Peter Häder: Photosynthese, 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 205.
- Centrifugal versus centripetal chloroplasts. Plants in Action. Australian and New Zealand societies of plant sciences. Процитовано 22 серпня 2016. (англ.)
- Хелдт, 2011, с. 188.
- Хелдт, 2011, с. 185.
- Хелдт, 2011, с. 147.
- Страсбургер, 2008, с. 144.
- Evans, HJ (1968). The Mechanism of the Pyruvate, Phosphate Dikinase Reaction.. Proceedings of the National Academy of Sciences 61 (4): 1448–53. PMC 225276. PMID 4303480. doi:10.1073/pnas.61.4.1448. (англ.)
- Ермаков, 2005, с. 197.
- Yu Wang, Andrea Bräutigam, Andreas P. M. Weber and Xin-Guang Zhu (2014). Three distinct biochemical subtypes of C4 photosynthesis? A modelling analysis. J. Exp. Bot. 65 (13): 3567–78. doi:10.1093/jxb/eru058. (англ.)
- Кобак, 1988, с. 20.
- Страсбургер, 2008, с. 146.
- Хелдт, 2011, с. 190.
- Gerry Edwards,David Walker. C3, C4: Mechanisms, and Cellular and Environmental Regulation, of Photosynthesis. — Univ of California Pr. — 1983. — С. 552. — ISBN 978-0520050181. (англ.)
- Donat-Peter Häder: Photosynthese, 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 207.
- Медведев, 2013, с. 59.
- Sage, RF., Sage, TL. und Kocacinar, F. (2012): Photorespiration and the evolution of C4 photosynthesis. In: Annu Rev Plant Biol. 63; S. 19-47; PMID 22404472; doi:10.1146/annurev-arplant-042811-105511.
- Raghavendra, Sage, 2011, с. 29–61, Chapter 4; Gerald E. Edwards, Elena V. Voznesenskaya: C4 Photosynthesis: Kranz forms and single-cell C4 in terrestrial plants..
- Хелдт, 2011, с. 194.
- Gonzalez, Daniel H.; Iglesias, Alberto A.; Andreo, Carlos S. (1986). Active-site-directed inhibition of phosphoenolpyruvate carboxylase from maize leaves by bromopyruvate. Archives of Biochemistry and Biophysics 245 (1): 179–186. ISSN 0003-9861. PMID 3947097. doi:10.1016/0003-9861(86)90203-1. (англ.)
- Nimmo, Hugh G (2000). The regulation of phosphoenolpyruvate carboxylase in CAM plants. Trends in Plant Science 5 (2): 75–80. ISSN 1360-1385. PMID 10664617. doi:10.1016/S1360-1385(99)01543-5. (англ.)
- José A. Monreal, Fionn McLoughlin, Cristina Echevarría, Sofía García-Mauriño and Christa Testerink (February 2010). Phosphoenolpyruvate Carboxylase from C4 Leaves Is Selectively Targeted for Inhibition by Anionic Phospholipids. Plants Physiology 152 (2): 634–638. doi:10.1104/pp.109.150326. (англ.)
- Kai, Yasushi; Matsumura, Hiroyoshi; Izui, Katsura (2003). Phosphoenolpyruvate carboxylase: three-dimensional structure and molecular mechanisms. Archives of Biochemistry and Biophysics 414 (2): 170–179. ISSN 0003-9861. PMID 12781768. doi:10.1016/S0003-9861(03)00170-X. (англ.)
- Chris J. Chastain, Raymond Chollet (June 2003). Regulation of pyruvate, orthophosphate dikinase by ADP-/Pi-dependent reversible phosphorylation in C3 and C4 plants. Plant Physiology and Biochemistry 41 (6-7): 523–532. doi:10.1016/S0981-9428(03)00065-2. (англ.)
- Кобак, 1988, с. 21.
- Freitag, H; Stichler, W (2000). A remarkable new leaf type with unusual photosynthetic tissue in a central Asiatic genus of Chenopodiaceae. Plant Biol 2: 154–160. doi:10.1055/s-2000-9462. (англ.)
- Voznesenskaya, Elena; Vincent R. Franceschi; Olavi Kiirats; Elena G. Artyusheva; Helmut Freitag; Gerald E. Edwards (2002). Proof of C4 photosynthesis without Kranz anatomy in Bienertia cycloptera (Chenopodiaceae). The Plant Journal 31 (5): 649–662. PMID 12207654. doi:10.1046/j.1365-313X.2002.01385.x. (англ.)
- Akhani, Hossein; Barroca, João; Koteeva, Nuria; Voznesenskaya, Elena; Franceschi, Vincent; Edwards, Gerald; Ghaffari, Seyed Mahmood; Ziegler, Hubert (2005). Bienertia sinuspersici (Chenopodiaceae): A New Species from Southwest Asia and Discovery of a Third Terrestrial C4 Plant Without Kranz Anatomy. Systematic Botany 30 (2): 290–301. doi:10.1600/0363644054223684. (англ.)
- Akhani, H; Chatrenoor, T; Dehghani, M; Khoshravesh, R; Mahdavi, P.; Matinzadeh, Z. (2012). A new species of Bienertia (Chenopodiaceae) from Iranian salt deserts: a third species of the genus and discovery of a fourth terrestrial C4 plant without Kranz anatomy. Plant Biosystems 146: 550–559. doi:10.1080/11263504.2012.662921. (англ.)
- Richard M. Sharpe, Sascha Offermann (2014). One decade after the discovery of single-cell C4 species in terrestrial plants: what did we learn about the minimal requirements of C4 photosynthesis?. Photosynth Reasrch 119 (169). doi:10.1007/s11120-013-9810-9. (англ.)
- J.B. Reiskind, G. Bowes. The role of phosphoenolpyruvate carboxykinase in a marine macroalga with C4 photosynthetic characteristics. Proceedings of the National Academy of Sciences 88 (7): 2883–7. doi:10.1073/pnas.88.7.2883. (англ.)
- Reinfelder JR, Kraepiel AM, Morel FM. (2000). Unicellular C4 photosynthesis in a marine diatom. Nature 407 (6807): 996–9. PMID 11069177. doi:10.1038/35039612. (англ.)
- Richard C. Leegood (2002). C4 photosynthesis: principles of CO2 concentration and prospects for its introduction into C3 plants. J. Exp. Bot. 53 (369): 581–590. doi:10.1093/jexbot/53.369.581. (англ.)
- Hans Lambers, F. Stuart Chapin III. und Thijs L. Pons: Plant Physiological Ecology. 2. Auflage, Springer, Berlin 2008; ISBN 978-0-387-78340-6; S. 80.
- Sage, RF. (2002): Are crassulacean acid metabolism and C4 photosynthesis incompatible? In: Functional Plant Biology 29(6); S. 775—785; doi:10.1071/PP01217.
- Raghavendra, Sage, 2011, с. 110, Chapter 7; Stanislav Kopriva: Nitrogen and Sulfur Metabolism in C4 Plants..
- Ulrich Lüttge, Manfred Kluge und Gerhard Thiel: Botanik — Die umfassende Biologie der Pflanzen. 1. Auflage, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1; S. 781—782.
- Raghavendra, Sage, 2011, с. 95, 132, Chapter 6; Bauwe H.: Photorespiration: the bridge to C4 photosynthesis..
- Rowan F. Sage, Matt Stata (2015). Photosynthetic diversity meets biodiversity: The C4 plant example. J. Plant Physiol. 172: 104–119. doi:10.1016/j.jplph.2014.07.024. (англ.)
- Rowan F. Sage, Pascal-Antoine Christin and Erika J. Edwards (2011). The C4 plant lineages of planet Earth. Journal of Experimental Botany 62 (9): 3155–69. doi:10.1093/jxb/err048. (англ.)
- Sage, Rowan; Russell Monson (1999). 7. C4 Plant Biology. с. 228–229. ISBN 0-12-614440-0. (англ.)
- Bond, W. J.; Woodward, F. I.; Midgley, G. F. (2005). The global distribution of ecosystems in a world without fire. New Phytologist 165 (2): 525–538. PMID 15720663. doi:10.1111/j.1469-8137.2004.01252.x. (англ.)
- Osborne, C. P.; Beerling, D. J. (2006). Nature's green revolution: the remarkable evolutionary rise of C4 plants. Philosophical Transactions of the Royal Society B: Biological Sciences 361 (1465): 173–194. PMC 1626541. PMID 16553316. doi:10.1098/rstb.2005.1737. (англ.)
- Rowan F. Sage (2016). A portrait of the C4 photosynthetic family on the 50th anniversary of its discovery: species number, evolutionary lineages, and Hall of Fame. Journal of Experimental Botany 67 (14): 4039–56. doi:10.1093/jxb/erw156. (англ.)
- Sage Rowan, Russell Monson (1999). 16. C4 Plant Biology. с. 551–580. ISBN 0-12-614440-0. (англ.)
- Zhu XG, Long SP, Ort DR (2008). What is the maximum efficiency with which photosynthesis can convert solar energy into biomass?. Current Opinion in Biotechnology 19 (2): 153–159. PMID 18374559. doi:10.1016/j.copbio.2008.02.004. (англ.)
- Kadereit, G; Borsch, T; Weising, K; Freitag, H (2003). Phylogeny of Amaranthaceae and Chenopodiaceae and the Evolution of C4 Photosynthesis. International Journal of Plant Sciences 164 (6): 959–86. doi:10.1086/378649. (англ.)
- Кобак, 1988, с. 23.
- Страсбургер, 2008, с. 145.
- Raghavendra, Sage, 2011, с. 170, Chapter 10; Rowan F. Sage, Ferit Kocacinar, David S. Kubien: C4 Photosynthesis and Temperature..
- Ulrich Lüttge, Manfred Kluge: Botanik — Die einführende Biologie der Pflanzen. 6. aktualisierte Auflage, Wiley-VCH, 2012, ISBN 978-3527331925, S. 498.
- Ермаков, 2005, с. 204.
- Linder Biologie Gesamtband, Schroedel, 22. Auflage, Braunschweig, 2005, S. 56
- Страсбургер, 2008, с. 151.
- Хелдт, 2011, с. 186.
- Raghavendra, Sage, 2011, с. 379–397, Chapter 19; Michael B. Jones: C4 species as energy crops..
- Joseph Craine (11 листопада 2009). Why be efficient? A question for C4 plants. Wild Plants Post.
- Rowan F. Sage, Stefanie Sultmanis (2016). Why Are There No C4 Forests?. Journal of Plant Physiology. doi:10.1016/j.jplph.2016.06.009. (англ.)
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5. vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005; ISBN 978-3-527-31179-8; S. 485.
- Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5; S. 136.
- Кобак, 1988, с. 26.
- Donat-Peter Häder: Photosynthese, 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 214.
- Хелдт, 2011, с. 195.
- Raghavendra, Sage, 2011, с. 363, Chapter 18; James N. Burnell: Hurdles to Engineering Greater Photosynthetic Rates in Crop Plants: C4 Rice..
- Bullis, Kevin (December 2015). Speeding Plant Growth to Feed the World | MIT Technology Review. MIT Technology Review. Процитовано 30 грудня 2015. (англ.)
- The global distribution of ecosystems in a world without fire. New Phytologist 165 (2): 525–38. 2005. PMID 15720663. doi:10.1111/j.1469-8137.2004.01252.x. Проігноровано невідомий параметр
|vauthors=(довідка) - Osborne, C. P.; Beerling, D. J. (2006). Nature's green revolution: the remarkable evolutionary rise of C4 plants. Philosophical Transactions of the Royal Society B: Biological Sciences 361 (1465): 173–94. PMC 1626541. PMID 16553316. doi:10.1098/rstb.2005.1737.
- Ulrich Lüttge, Manfred Kluge und Gerhard Thiel: Botanik — Die umfassende Biologie der Pflanzen. 1. Auflage, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1; S. 797.
- Raghavendra, Sage, 2011, с. 339–357, Chapter 17; Colin P. Osborne: The geologic history of C4 plants.
- Sage R.F.; Sage T.L.; Kocacinar F. (2012). Photorespiration and the Evolution of C4 Photosynthesis. Annu Rev Plant Biol. 63 (19): 19–47. PMID 22404472. doi:10.1146/annurev-arplant-042811-105511. (англ.)
Література
- П. Зитте, и др. на основе учебника Э. Страсбургера. Ботаника / Под ред. В. В. Чуба. — 35-е изд. — М. : Академия, 2008. — Т. 2. Физиология растений. — 495 с. (рос.)
- Медведев С. С. Физиология растений. — СПб. : БХВ-Петербург, 2013. — 335 с. (рос.)
- Физиология растений / Под ред. И. П. Ермакова. — М. : Академия, 2005. — 634 с. (рос.)
- Хелдт Г. В. Биохимия растений / Пер. с англ. — М. : БИНОМ. Лаборатория знаний, 2011. — 471 с. (рос.)
- К.И.Кобак. Биотические компоненты углеродного цикла / Под ред. М.И. Будыко. — Ленинград : Гидрометеоиздат, 1988. — 246 с. — ISBN 5-286-00055-X. (рос.)
- C4 Photosynthesis and Related CO2 Concentrating Mechanisms / Editors: Agepati S. Raghavendra and Rowan F. Sage. — Springer, 2011. — Vol. 32. — 424 p. — (Advances in Photosynthesis and Respiration) — ISBN 978-90-481-9407-0. — DOI: (англ.)
- Мусієнко М. М. Фізіологія рослин. Підручник. 2-е вид., вип. та доп. — К.: Фітосоціоцентр, 2001. — 392 с.