Молекулярна енергетика
Молекулярна енергетика (англ. molecular power або англ. molecular power engineering) — складова частина електроенергетики, яка вивчає і використовує енергетичні властивості молекул, атомів, йонів, інших малих частинок рідинного та газоподібного середовищ, взаємодію цих частинок між собою, з іншими тілами, а також з електричними та магнітними полями з метою вироблення, передачі, накопичення, розподілу та використання електричної енергії.
У фундаменті молекулярної енергетики лежать атомно-молекулярний та йонно-молекулярний
принципи побудови речовини[джерело?]. Перший принцип характеризує дискретність або перервність будови речовини, другий принцип розкриває стан електролітичних розчинів та взаємодію йонів з молекулами розчинника. Ключовими поняттями молекулярної енергетики є атом, молекула, йон, хімічний зв'язок, міжатомний та міжмолекулярний потенціали, термодинамічні потенціали. Предметом дослідження молекулярної енергетики є агрегатні стани речовини, міжфазна поверхня, поверхневі явища, процеси перенесення, перетворення та відновлення енергії, молекулярні способи (технології) та технічні засоби (системи) виробництва, накопичення, розподілу та використання електричної енергії.
Двома складовими частинами молекулярної енергетики є молекулярна гідроенергетика та молекулярна вітроенергетика[джерело?].
Молекулярна гідроенергетика (англ. molecular hydropower) — наука і галузь, складова частина молекулярної енергетики, яка вивчає та використовує відновлювані енергетичні властивості молекул, атомів, йонів, інших малих частинок рідинного середовища, взаємодію цих частинок між собою, з іншими тілами, а також з електричними та магнітними полями з метою вироблення, передачі, накопичення, розподілу та використання електричної енергії. У молекулярній гідроенергетиці певний об'єм рідини або розчину, розглядається як молекулярна термодинамічна система з притаманними їй фізико-хімічними параметрами та характеристиками: внутрішньою енергією, енергією на кордонах фаз, концентрацією розчиненої речовини, осмотичним тиском, хімічним потенціалом тощо. Ефективне перетворення та вивільнення енергії молекул, атомів, йонів та інших частинок рідини, скажімо, води або водних розчинів (електролітів), може бути здійснено за допомогою фізичних та хімічних поверхневих явищ, які виникають на межі фаз, зокрема, змочування, адгезії, когезії, капілярного ефекту, адсорбції, абсорбції тощо. Поряд з вище названими явищами для створення молекулярних технологій та систем гідроенергетики застосовні також фізичні явища електрокінетики, осмосу, електродіалізу, магнітогідродинаміки в рідинах та їх розчинах, а ще поєднання цих ефектів. Звідсіля витікає і поділ молекулярної гідроенергетики на гідроенергетику міжфазної поверхні, електрокінетичну гідроенергетику, гідроенергетику градієнта солоності, магнітогідродинамічну гідроенергетику тощо.
Молекулярна вітроенергетика (англ. molecular wind power) — складова частина молекулярної енергетики, що вивчає та використовує відновлювані енергетичні властивості швидких молекул, атомів, йонів, інших малих частинок газового повітряного середовища, взаємодію цих частинок між собою, з іншими тілами, а також з електричними та магнітними полями з метою вироблення, накопичення, передачі та розподілу електричної енергії. Молекулярна вітроенергетика є також складовою частиною класичної вітроенергетики, в основі якої лежать закони газодинаміки (аеродинаміки), що описують рух повітря та його взаємодію з твердими тілами, а також закони аеростатики, що оцінюють рівновагу повітря та його дію на занурені в нього тіла. Для ефективного перетворення енергії молекул газової повітряної суміші в електричну енергію можна використати відомі фізичні явища: йонізації атомів та молекул активної речовини під дією швидких молекул повітря, зокрема, явище ступінчато-ударної йонізації; термоелектричний ефект Зеебека — виникнення термо-ЕРС у молекулярній структурі під тепловою дією швидких молекул повітря; сорбційний ефект — виникнення термо-ЕРС у сорбційній молекулярній структурі при поглинанні швидких молекул повітря; прямий п'єзоелектричний ефект — виникнення електричних зарядів на гранях певних кристалів при деформації та зворотний магнітострикційний ефект (магнетопружний ефект Вілларі) — зміна намагніченості певних матеріалів під впливом механічних напружень. Ці фізичні явища окремо або ж у поєднанні з іншими застосовні для створення високоефективних систем молекулярної вітроенергетики.[1][2] Молекулярна енергетика є альтернативою макроскопічної енергетики[джерело?].
Історичний огляд
Своїм корінням молекулярна енергетика сягає V ст. до н. е.[джерело?], коли Демокрит (460—370 рр. до н. е.) увів поняття атом. Ця ідея була сприйнята наукою нового часу та зіграла видатну роль у її розвитку. Припущення про молекулярну структуру речовини стало визнаною теорію, що поширилася на молекулярну фізику рідини та кінетичну теорію газів у результаті напруженої роботи великої когорти вчених XVIII—XX ст. і була спрямована значною мірою на вирішення прикладних її задач, зокрема, у рамках гідродинаміки та термодинаміки.
Англійський фізик-експериментатор Френсіс Хоксби ще у 1709 році виконав перші дослідження капілярності.[3] У 1718 році Джеймс Джюрін показав залежність висоти стовпа рідини у капілярі від площі його поперечного перетину.[4] Швейцарський математик і фізик Даніель Бернуллі вдосконалив диференціальні рівняння, чисельні методи та теорію ймовірностей і застосував їх у вивченні гідродинаміки, кінетичної теорії газів, аеродинаміки та теорії пружності.[5] У 1805 році англійський вчений Томас Юнг встановив зв'язок між перепадом капілярного тиску на кордоні системи «рідина-повітря» та поверхневим натягом.[6] Того ж року висновки Томаса Юнга були математично формалізовані французьким математиком і астрономом П'єром Симоном Лапласом.[7] Сьогодні одна з важливих формул фізики носить назву рівняння Юнга-Лапласа. 1830 року результати були узагальнені в роботах німецького математика та астронома Карла Фрідріха Гаусса.[8] Німецьким інженером і будівельником Готтхільфом Генріхом Хагеном у 1839 році була встановлена кількісна залежність об'ємних витрат рідини через капіляр від перепаду тиску.[9] У 1841 році ця залежність була підтверджена французьким фізиком і фізіологом Жаном Леонардом Пуазейлем.[10] Сьогодні відповідний закон носить ім'я Хагена–Пуазейля. Німецький фізик Франц Ернст Нейман у своїй роботі, яка побачила світ 1894 року, систематизував досягнення своїх попередників.[11] Дев'ятнадцяте століття позначилося широким застосуванням в аналізі фізичних та хімічних систем положень гідродинаміки, термодинаміки та статистичної механіки. Сучасне пояснення поведінка флюїдів знайшла в роботах французького інженера Клода-Луї Нав'є з теорії пружності та гідродинаміки,[12][13] а пізніше — в рівняннях британського математика та фізика Джорджа Габріеля Стокса.[14][15]
У міру того як становилася атомістично-молекулярна теорія побудови речовини дослідниками усвідомлювалася спільна природа рідин та газів. Англійський хімік та фізик Роберт Бойль у 1662 відкрив закон про обернено пропорційну залежність об'єму ідеального газу від тиску при постійній температурі й масі газу. Роберт Бойль вперше запровадив наукове поняття про хімічний елемент (1661 р.) і є одним із засновників якісного хімічного аналізу.[16][17][18][19][20] З британською науковою школою у всіх сферах знань завжди змагалася французька наукова школа. Французький фізик Едм Маріотт в одній із своїх робіт описує обернено пропорційну залежність між об'ємом і тиском газу,[21] фактично відкривши заново закон Роберта Бойля. У 1738 році Даніель Бернуллі висловив думку, що газ складається з великої кількості молекул, які хаотично рухаються. Зіткненнями цих молекул він пояснював природу тиску та деякі теплові процеси. Французький винахідник і вчений. Жак Александр Сезар Шарль у 1787 році встановив прямо пропорційну залежність об'єму ідеального газу від температури при постійному тиску. Французький хімік та фізик Жозеф Луї Гей-Люссак сформулював термодинамічний закон теплового розширення газів, згідно якому зміна об'єму газу пропорційна зміні температури тіла.[22][23][24] Італійський фізик та хімік Амедео Авогадро увів 1811 року у вжиток термін «молекула» і незаперечно є одним із авторів теорії атомно-молекулярної будови речовини.[25]
Французький фізик та інженер Еміль Клапейрон у 1834 році вивів рівняння стану ідеального газу,[26] аналізуючи роботи своїх попередників Роберта Бойля, Едма Маріотта, Жозефа Луї Гей-Люссака, Жака Шарля а також Амедео Авогадро. Німецький фізик Юліус Роберт фон Маєр встановив зв'язок між теплоємностями для ізобаричних та ізохоричних процесів у газах.[27][28] Шотландський фізик Джон Джеймс Уотерстоун показав залежність тиску газу в одиниці об'єму від кількості молекул та від середньої квадратичної швидкості молекул і фактично вивів закон ідеального газу.[29] Проте, сучасну кінетичну теорію газів сформулював у 1856 році німецький хімік та фізик Август Креніг.[30] Роком пізніше німецький фізик Рудольф Клаузіус увів у користування поняття ентропії й створив більш фундаментальну теорію, що враховувала поступальний, обертовий та коливальний рухи молекул. Ним же запропоновано поняття довжини вільного пробігу частинки.[31][32]
Джеймс Клерк Максвелл визначив статистичний розподіл молекул газу за швидкостями.[33] У 1866 році австрійський фізик Людвіг Больцман отримав рівняння рівноважного розподілу молекул ідеального газу за імпульсами та координатами, а 1871 року узагальнив цей розподіл для частинок у зовнішньому полі, постулював логарифмічну залежність між ентропією та числом станів термодинамічної системи і цим відкриттям зробив суттєвий вклад у становлення статистичної механіки.[34][35]
Томсон лорд Кельвін спільно з Джеймсом Прескоттом Джоулем провели охолодження газів при розширенні без здійснення роботи, яке послужило перехідним ступенем від теорії ідеальних газів до теорії реальних газів. Вільяму Томсону належить також одне з перших формулювань другого закону термодинаміки.[36] Важливими етапами в розвитку газової теорії стали дослідження міжмолекулярної взаємодії та створення голландським фізиком Яном Дидериком ван дер Ваальсом теорії фазових переходів між газоподібним та рідким станами речовини,[37] побудова теорії броунівського руху Альбертом Ейнштейном [38] та роботи з теорії броунівського руху і теорії флуктуацій Мар'яна Смолюховського.[39]
Паралельно з атомістично-молекулярною теорією будови речовини науковий та індустріальний світ концентрувався на вивченні електричних та магнітних явищ. Невдовзі після того як італійський медик і фізик Луїджі Гальвані опублікував свої дослідження електричних явищ у біологічному організмі,[40] 1800 року його земляк Алессандро Вольта побудував (Вольтів) стовп — фактично створив першу молекулярну електрохімічну електростанцію.[41] У 1820 році французький фізик та математик Андре-Марі Ампер встановив залежність між електрикою та магнетизмом, що дало поштовх розвитку електродинаміки,[42][43][44] а вже у 1827 році німецький фізик і математик Георг Ом відкрив закон (Ома), який описує струм в електричному колі.[45][46] Епохальним стало відкриття Майклом Фарадеєм 1831 року явища електромагнітної індукції, що роз'яснює причину взаємодії між собою на відстані тіл з магнітними та електричними властивостями. Це відкриття зумовило винахід електричного генератора.[47] У подальшому Джеймс Максвелл математично визначив напрямок та величину діючих при електромагнітній індукції сил, таким чином, сформулював класичну теорію електромагнетизму.[48]
Ряд фундаментальних явищ було відкрито при дослідженні електрики у рідинах, газах, твердих тілах та на їх кордоні. Появу електричного заряду на дисперсних частинках та перенесення заряджених частинок під дією зовнішнього електричного поля (явище електрофорезу) 1808 року вперше спостерігав професор кафедри хімії Московського університету Фердинанд Фрідріх Рейсс. Йому належить також відкриття явища електроосмосу.[49] Пріоритет у відкритті потенціалу седиментації належить німецькому фізику Фрідріху Ернсту Дорну. Явище зворотного електроосмосу відкрив німецький фізик Георг Герман Квінке 1859 року.[50]
Будову та поведінку частинок дисперсної фази колоїдної системи пояснює теорія подвійного електричного шару (ПЕШ). Згідно моделі німецького фізика Германа Гельмгольца, опублікованій 1879 року, подвійний електричний шар є плоским конденсатором, одна обкладка якого міститься в твердій фазі, а друга — в розчині.[51] Важливими етапами у розвитку теорії ПЕШ стали роботи французького вченого Луї Жоржа Гуї, виконані у 1910 році,[52] та англійського фізика Девіда Леонарда Чепмена, які вийшли друком 1913 року[53] . За моделлю Гуї-Чепмена електричні протийони утворюють розмитий шар. Основи сучасної теорії ПЕШ, яка враховує адсорбцію, розроблені німецьким фізиком Отто Штерном і побачили світ 1924 року.[54] Одну з моделей розрахунку потенціалу побудував на початку 1900-х польський фізик Маріан Смолюховський.[55]
У 1860—1880 роках на кордоні фундаментальних наук зародилися фізична хімія та хімічна фізика, які узагальнили хімічну термодинаміку та хімічну кінетику. В рамках молекулярної фізики та хімії вималювалися нові розділи — фізика та хімія поверхні. У 1876 році американський математик, фізик та хімік Джозая Віллард Гіббз пояснив поняття поверхневої енергії, хімічного потенціалу та правила фаз (Гіббза).[56] Голландський фізик та хімік Якоб Гендрік Вант-Гофф 1887 року встановив залежність осмотичного тиску від концентрації розчиненої речовини.[57] Автором теорії електролітичної дисоціації та хімічної кінетики є шведський фізик та хімік Сванте Август Арреніус. Він же є піонером-дослідником парникового ефекту, що зумовлює зміни клімату.[58][59] Важливий науковий внесок у використання методів статистичної механіки в колоїдній хімії та хімії поверхні був зроблений американським хіміком Ірвінгом Ленгмюром.[60]
Ширина та ґрунтовність наукових досліджень попереднього періоду викликають захоплення і логічне здивування, бо вони багато в чому обігнали свій час. Дивним, зокрема, виглядає той факт, як багато корисних фізичних і хімічних відкриттів було зроблено тоді, коли саме існування атомів і молекул було під питанням. Бурхливий розвиток промисловості на початку ХХ ст. вимагав впровадження нових технологій. Фундаментальна наука відгукнулася революційними теоріями. Для того щоб пояснити результати експериментів по розсіюванню α–частинок речовиною, британський фізик, виходець із Нової Зеландії, Ернст Резерфорд створив планетарну модель атома.[61][62][63] Протягом 1913—1924 рр. данський фізик-теоретик Нільс Бор друкує ряд фундаментальних статей, присвячених квантовій будові атома та молекул.[64][65][66][67] Аби подолати неузгодженість між експериментальними молекулярними спектрами та теорією квантової механіки у 1924 р. австрійський фізик-теоретик Вольфганг Паулі запропонував квантове число з двома можливими значеннями і фактично передбачив спін електрона.[68] Упродовж 1923—1926 рр. французький фізик Луї де Бройль постулював хвильову природу електрона і всієї матерії, висунув гіпотезу про корпускулярно-хвильовий дуалізм.[69][70] Австрійський фізик-теоретик Ервін Шредінгер є автором хвильової нерелятивістської механіки, сформульованої у 1925—1926 рр. на снові хвильових рівнянь (Шредінгера).[71][72][73] «Нова ера взаємного стимулювання механіки та математики» пов'язана також з іменем німецького фізика-теоретика Вернера Гейзенберга, який запропонував для опису квантової механіки матричну механіку, сформулював принцип невизначеності, застосував принципи квантової механіки до проблем феромагнетизму а також до релятивістської квантової теорії поля та квантової електродинаміки.[74][75][76][77][78] Британський фізик Поль Дірак поєднав матричну механіку Гейзенберга з рівнянням Шредінгера й увів у хвильове рівняння відносність. Рівнянням Дірака підтверджується і гіпотетичний спін, і магнітні властивості електрона (магнітний момент). Рівнянням Дірака описуються важкі атоми, де слід враховувати спін-орбітальну взаємодію. Дірак припустив існування позитивно зарядженої частинки — протона. Передбачив існування античастинки — «дірки», близнюка електрона, можливість народження електрон-антиелектронної пари з фотона достатньо великої енергії, відкрив статистичний розподіл енергії в електронній системі (статистика Фермі-Дірака).[79][80][81][82] Квантова теорія дала народження квантовій механіці та допомогла подолати протиріччя, які виникли при вивченні глибинних процесів у речовині. З одного боку, в молекулярній фізиці панує термодинамічний метод, при якому не враховується дискретна молекулярна та атомна структура речовини, і речовина розглядається як суцільне неперервне середовище. З іншого боку, згідно атомістичної та молекулярної теорії речовина є дискретним середовищем і може бути вивчена статистичними методами з використанням теорії ймовірності. Зміна методології визначила появу нових напрямків розвитку наук.
Данський фізик Віллем Хендрік Кеезом 1921 року дослідив диполь-дипольну електростатичну взаємодію між зарядами для молекулярних йонів, між диполями для полярних молекул, між квадруполями і мультиполями. Взаємодія Кеезона є різновидом слабкої міжмолекулярної взаємодії ван дер Ваальса. Голландсько-американcький фізик і хімік Петер Джозеф Вільям Дебай. поширив поняття дипольного моменту на розподіл заряду в молекулі. Згідно розрахункам Петера Дебая полярна молекула (диполь) поляризує сусідню молекулу, утворюючи таким чином диполь і обумовлюючи притягання молекул. Фундаментальний вклад у теорію хімічного зв'язку та міжмолекулярних (дисперсійних) сил вніс німецький та американський фізик-теоретик Фріц Вольфганг Лондон. Вчений встановив взаємодію неполярних молекул, обумовлену флуктуаціями електронних хмаринок. У 1924 році англійський фізик та хімік-теоретик Джон Едвард Леннард-Джонс, вивчаючи взаємодію молекул рідини та газів запропонував поняття потенціалу міжатомних сил (потенціалу Ленарда-Джонса), який дозволяв пояснити параметри рівнянь ван дер Ваальса. У сфері його наукових доробок — парамагнетизм двоатомних молекул, зокрема, молекул оксигену, хвильові функції мультіелектронних атомів, хімічна валентність та метод молекулярних орбіталей.
Дослідження, які ведуться протягом останніх десятиліть на перехресті гідродинаміки, електрохімії, колоїдної хімії та електрокінетики, дали народження мікрогідродинаміці або мікрофлюїдиці (англ. microfluidics), в якій розглядаються механізми переміщення рідини у вузьких капілярах під впливом зовнішніх та/або внутрішніх сил. Сферою використання досягнень мікрогідродинаміки стали на початку 1980-х років струменеві принтери, пізніше — мініатюрні хімічні лабораторії на чипі. З розвитком нанотехнологій з'явилося поняття наногідродинаміки або нанофлюїдики (англ. nanofluidics) — розділ гідродинаміки, в якому розглядаються механізми переміщення рідини у капілярах діаметром 1—100 нм. У рамках мікрогідродинаміки та наногідродинаміки досліджується рух флюїдів капілярними системами вивчаються особливості побудови капілярів у неживій та живій природі.
Останнім часом значна увага приділяється дослідженням подвійного електричного шару в дисперсних рідинних системах. З'ясувалося, що при поміщенні діелектричної частинки в електричне поле на її кордоні появляються рівні і протилежні по знаку електричні заряди й наводиться дипольний момент — частинка поляризується. Модуляцією густини заряду в мікроканалі можна спрямовувати електроосмотичний потік. ПЕШ на поляризованій поверхні індукується та управляється тим же електричним полем. Аби підкреслити цей єдиний механізм, автори Мартін Базант, Тодд Сквайрес та ін. запропонували термін електроосмос індукованого заряду (ICEO). Окремим напрямком мікрогідродинаміки є електроосмос змінного струму. Вагомий внесок у розвиток колоїдних систем здійснили вчені Інституту колоїдної хімії і хімії води ім. А. В. Думанського Національної Академії наук України, зокрема, Станіслав Духін, доктор хімічних наук, Володимир Шилов, доктор фізико-математичних наук, Микола Жарких, кандидат хімічних наук, Ілля Разілов, кандидат фізико-математичних наук та ін. Дельгадо розглядає теоретичні основи інтерфейсної електрокінетики, Берт'є та Табелінг у своїх роботах вивчають питання дискретної та неперервної мікрогідродинаміки. Рамос та ін. акцентують увагу на фізичних основах діелектрофорезу, електрокінетики змінного струму, електрозмочування, електрогідродинаміки а також на практичному використанні електрокінетичних явищ у мікросистемах. Галіндо-Росалес фокусується на параметрах та характеристиках флюїдів, віддаючи перевагу чисельним методам оцінки та оптимізації мікрогідродинамічних систем.
Десятки публікацій присвячені дослідженню електрокінетичних способів та засобів виробництва електричної енергії.
Ведеться пошук нових молекулярних джерел відновлюваної енергії. Один із напрямків отримання електричної енергії, оприлюднений у 1954 році, припускає використання градієнта солоності. Сьогодні дослідження технологій забарного осмосу та зворотного електродіалізу із застосуванням сукупності аніонних та катіонних обмінних мембран для виробництва електричної енергії із градієнта солоності ведуться у багатьох напрямках.
Із часів Майкла Фарадея тривають спроби створити магнітогідродинамічний генератор електричного струму на основі рідинних, які особливо прогресували після виділення магнітогідродинаміки в окремий науковий напрямок. Велика заслуга в цьому належить швецькому фізику та астроному Ганнесу Альвену. Пізніше розвиток магнітогідродинаміки рухали дослідження електромагнітної індукції у газових середовищах. Застосування законів магнітогідродинаміки дозволяло оминути малоефективний етап механічних перетворень у класичних теплових електростанціях і позбавитися масивних механічних елементів при виробництві електричного струму. Отримані потужності МГД-генераторів не перевищували кількох десятків кіловат.
Кінець 1990-х років ознаменувався інтенсивним розвитком нанотехнологій, в рамках яких дослідники маніпулюють дуже малими частинками речовини, атомами та молекулами включно, для створення більш складних макроскопічних структур. Нова методологія виявилася до того універсальною, що швидко поширилася в різні сфери нашого життя і, можна сказати, дала поштовх народженню молекулярних технологій відновлюваної енергії (англ. molecular renewable power technologies), які засновані на використанні відновлюваних енергетичних властивостей молекул, атомів, йонів та інших малих частинок речовини, квантів електромагнітного поля та плазми. У відповідності до походження (природи) відновлюваного джерела енергії, агрегатного стану робочого тіла, що застосовується для отримання електричного струму, а також враховуючи спорідненість з існуючими технологіями відновлюваної енергії і сфери застосування, молекулярні технології можуть бути класифіковані на гідроенергетичні та вітроенергетичні. Загалом же вказані технології складають технологічну основу молекулярної енергетики. На противагу макроенергетиці, молекулярну енергетику можна назвати наноенергетикою.
Революційні науково-технологічні досягнення останніх років в галузях нанотехнологій, біотехнологій, комп'ютерного моделювання дозволяють нам «управляти матерією та енергією». Про це свідчить поява ряду публікацій з концептуально новим баченням шляхів освоєння відновлюваної енергії. Едвард Вольф використовує нанофізику для аналізу ядерного синтезу, фотоелектричного ефекту в сонячних елементах та фотокаталітичного процесу виробництва гідрогену із води. Браян Кірбі розглядає мікрогідродинаміку та наногідродинаміку рідинних систем з огляду на їх використання в лабораторіях на чипі. Токайо Охта, професор Йокогамського Національного Університету м. Йокогама (Японія) досліджує енергетичні перетворювачі, паливні комірки, мембрани, магнітогідрогенератори та електролізери води.
Наростаючі дослідження свідчать про об'єктивну невідворотність використання в електроенергетиці внутрішніх резервів енергії молекул та атомів речовини. Велика енергія витікає з маленьких джерел, з атомів та молекул твердого тіла, рідини та газу. Витоки енергії ховаються на міжфазних поверхнях, в осмосі гетерогенних рідин, у динаміці швидких молекул повітря тощо.
Молекулярна енергетика — нова, швидко прогресуюча галузь. Вона є результатом довгої череди досліджень фізичних та хімічних властивостей речовини і електромагнітного поля а також встановлення зв'язків між ними. Описані у цій роботі технології дуже відрізняються одна від одної, можна говорити навіть про кардинальну несхожість технологій, з іншої сторони, їх єднає атомно-молекулярне походження енергії, а ще вони мають спільну історію самовідданої праці затятої когорти талановитих учених протягом просвічених століть. Хоча ідея є надбанням часу, а не якогось окремого генія, речі у світі науки співвідносяться з іменами, а десь ними і вимірюються. Наука в деталях, з конкретними історичними постатями і датами свідчить про її неперервність і методологічну цілісність, а витоки науки є тими дивними анахронізмами, які живлять весь океан знань. Найбільші зміни у нашому житті не обов'язково асоціюються з Оксфордом, але там, де цих змін торкнувся благодатний подих науки, світ квітнув барвами. Ми вертаємося в історію і шукаємо в ній витоки ідей, аби усвідомити їх шлях і ґрунтовно зрозуміти фізику, яка лежить в основі технологій сьогодення. В історії ми черпаємо мудрість, шукаємо паралелі із сучасністю, бо «старі» ідеї мають властивість час від часу «омолоджуватися».
Молекулярні технології та системи відновлюваної енергії
Молекулярна технологія відновлюваної енергії (англ. molecular renewable power technology) — сукупність способів та технічних засобів, які забезпечують виробництво електричного струму з відновлюваних джерел енергії, використовуючи глибинні енергетичні властивості атомів, молекул, йонів та інших малих частинок речовини, квантів електромагнітного поля та плазми. В залежності від походження (природи) енергії, агрегатного стану робочого тіла, а також враховуючи спорідненість з існуючими технологіями відновлюваної енергетики й застосовність, розрізняють молекулярні технології гідроенергетики та молекулярні технології вітроенергетики.
На відміну від макроскопічних технологій, які потребують подвійного а, інколи, й потрійного проміжного перетворення одного виду енергії в інший, молекулярні енергетичні технології є переважно прямими способами отримання електричного струму. Цікавість до них спричинена, в першу чергу, можливістю створення малогабаритних матричних пристроїв генерації електричної енергії а також співмірних з ними по розмірам та масі накопичувачів енергії, які дозволяють наряду з існуючими використовувати нові джерела відновлюваної енергії, притаманні гідросфері та атмосфері, зокрема, енергію молекул всередині рідини та на кордоні фаз, градієнт солоності води, кінетичну енергію швидких молекул повітря тощо. Кожна молекулярна енергетична технологія складається з послідовності певних операцій або процесів, які виконуються за допомогою сукупності технічних засобів, зведених в молекулярні системи енергетики.
Молекулярна система відновлюваної енергетики — сукупність молекулярних технологій та обладнання для отримання електричного струму з відновлюваних джерел енергії. В розрахунках параметрів та характеристик молекулярної системи енергетики, окрім звичайних макроскопічних параметрів речовини та поля, таких як швидкість, тиск, питома густина молекул, поєднаних у повітряний та/або водний потоки, враховуються глибинні властивості молекул, атомів, йонів, інших малих частинок речовини, характер взаємодії частинок між собою, взаємодія з електромагнітними полями та дія на інші тіла. Такий підхід дозволяє віднайти великі резерви внутрішньої енергії, які криються в речовині, електромагнітному полі та плазмі і на порядки перевищують рівні енергії, досяжні для макроскопічних (балкових) технологій.
Ефективне перетворення та вивільнення енергії молекул, атомів, йонів та інших частинок рідини, скажімо, води або водних розчинів (електролітів), може бути здійснено за допомогою фізичних та хімічних поверхневих явищ, які виникають на межі фаз, зокрема, змочування, адгезії, когезії, капілярного ефекту, адсорбції, абсорбції тощо. Поряд з вище названими явищами для створення молекулярних технологій та систем гідроенергетики застосовні також фізичні явища електрокінетики, осмосу, електродіалізу, магнітогідродинаміки в рідинах та їх розчинах, а ще поєднання цих ефектів. Звідсіля витікає і поділ молекулярних систем гідроенергетики на гідроадзезійні, гідроабсорбційні, електрокінетичні, осмотичні, електродіалізні, магнітогідродинамічні тощо. Робота гідроадзезійних та гідроабсорбційних систем заснована на використанні енергетичних властивостей міжфазної поверхні, тож, ці категорії систем належать до сфери гідроенергетики міжфазної поверхні. Класифікація молекулярних технологій та систем гідроенергетики є умовною, бо на практиці вони нерідко інтегруються.
За фізичними принципами отримання електричного струму молекулярні системи вітроенергетики можна класифікувати на йонізаційні, вітрильні, п'єзоелектричні, магнітострикційні та інші. Йонізаційна молекулярна система формує електричний струм використовуючи механізми йонізації активної структури швидкими молекулами повітря. Принцип роботи вітрильних молекулярних систем заснований на виникненні спрямованого руху твердотільної частинки з анізотропними властивостями поверхні в ізотропному середовищі швидких молекул повітря. Вітрова п'єзоелектрична система генерації електричного струму заснована на явищі прямого п'єзоелектричного ефекту — виникненні електричної поляризації під дією механічної деформації п'єзоелектричного перетворювача швидкими молекулами повітря. Принцип роботи магнітострикційних молекулярних технологій та систем вітроенергетики базується на використанні зворотного магнітострикційного ефекту Вілларі — зміни намагніченості активного матеріалу під впливом швидких молекул повітря.
Побудова та принцип роботи молекулярної системи енергетики
Узагальнена схема молекулярної системи
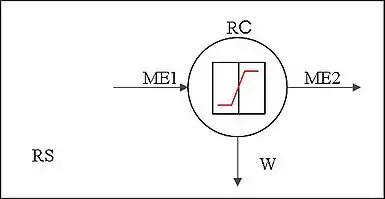
Узагальнена схема молекулярної системи виробництва електричного струму включає резервуар RS, робоче тіло WB (флюїд FL) та приймач-перетворювач енергії RС. Кожному стану матерії відповідає своє значення енергії ME. Початкова енергія молекул ME1 поступає на вхід приймача-перетворювача RС. Частина цієї енергії перетворюється в корисну роботу W [Дж], частина енергії розсіюється у вигляді тепла, частина незадіяної енергії молекул ME2 покидає приймач-перетворювач з робочим тілом WB і повертається у резервуар RS. Робота системи W [Дж] використовується для виробництва електричної енергії EEL [Дж]. Роботу вважають додатною, якщо вона здійснюється системою над зовнішніми тілами. В ідеальному випадку, W = EEL [Дж].
Ця схема є дещо спрощеною і не відображає всієї сутності процесів та структури молекулярної системи. Проте, наочність для пояснення і розуміння побудови та роботи молекулярної системи так же важлива, як і математична модель цієї системи.
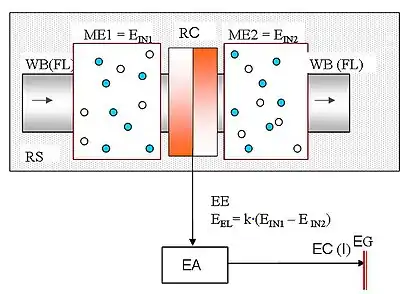
Розширена функціонально-структурна схема молекулярної системи виробництва електричного струму віддзеркалює основні функціональні частини, їх взаємозв'язки та призначення, зміст та порядок енергетичних перетворень у технологічному процесі генерації а також способи реалізації заданих функцій. Основними складовими частинами молекулярної системи виробництва електричного струму є резервуар RS, робоче тіло WB (флюїд FL), приймач-перетворювач енергії RC та електричний адаптер EA.
Робоче тіло
Робочим тілом WB слугує певний об'єм флюїду FL (рідини чи газової суміші в залежності від типу молекулярної системи енергетики), молекули, атоми, йони та інші малі частинки якого володіють виразними енергетичними властивостями всередині і на кордоні фаз (енергією ME). У цьому відношенні макроскопічні оточуючі ареали — гідросфера (водне середовище) та атмосфера (повітряне газове середовище) є невичерпними природними резервуарами молекулярної відновлюваної енергії. Молекулярні та макроскопічні джерела енергії пов'язані між собою єдиними фізичними законами. Аби розгадати та опанувати потужність океанічних хвиль, слід вивчити окрему краплю води. Для того щоб збагнути силу урагану, необхідно знати поведінку наперстка повітря.
Робоче тіло WB (флюїд FL), будь то рідина, газ чи потік випромінювання, переносить енергію. Це може бути, наприклад, енергія молекул рідини ME, які взаємодіють між собою чи з молекулами поверхні твердого тіла і можуть транспортувати великі об'єми рідини. Потік рідини може транспортувати йони певної речовини, формувати подвійний електричний шар на кордоні твердого тіла з рідиною та утворювати електричні потенціали (наприклад, седиментаційний чи течії). Рідини можуть також різнитися між собою вмістом деяких частинок і володіти, наприклад, градієнтом солоності, утворювати осмотичні потоки рідини, які володіють високою кінетичною енергією. Йони певної речовини можуть транспортуватися потоком певного флюїду, перерозподілятися в магнітному полі та формувати електрорушійну силу у влаштованих поблизу електродах як це спостерігається у магнітогідродинамічних явищах.
Робочим тілом може слугувати також повітряна суміш тобто певний об'єм швидких молекул повітря, які перебувають у тепловому хаотичному русі. Вони зіштовхуються одна із одною, ударяються в оточуючі тіла, постійно змінюють напрям руху, віддають енергію одна одній та зовнішньому оточенню і отримують енергію одна від одної та від зовнішнього оточення, таким чином активно взаємодіють між собою та з оточуючими тілами. В основі такої взаємодії лежать слабкі хімічні зв'язки, які названі на відміну від сильних хімічних зв'язків, що лежать в основі побудови молекул із атомів. Згідно теорії голландського фізика Яна Дидерика ван дер Ваальса сила міжмолекулярної взаємодії F(r) [Н] є рівнодійною або векторною сумою сил тяжіння та відштовхування й залежить від відстані r [м] наступним чином
де а — коефіцієнт.
На певній відстані [м] сили тяжіння молекул урівноважуються силами відштовхування. Сили тяжіння, які убувають обернено пропорційно шостому степеню відстані між молекулами при , звуться силами ван дер Ваальса. Сили ван дер Ваальса виникають при взаємодії незаряджених атомів та молекул і викликають когезію та адгезію конденсованої фази а також адсорбцію газів твердим тілом та рідиною.
Процеси, що мають місце в атомі, молекулі, йоні, в хімічній та йонній сполуках, між атомами та молекулами зумовлюють складні перетворення в газовому середовищі, рідині та твердому тілі. При фізичних перетвореннях атоми та молекули речовини не змінюються, трансформується лише їх енергетичний стан. В хімічних реакціях молекули речовини перетворюються на інші молекули, у результаті, виникає нова речовина, її поява супроводжується енергетичними змінами. В процесі подібних перетворень атоми, молекули та йони середовища можуть віддавати свою енергію, наприклад, для виконання відповідної роботи й отримувати іншу енергію зовні: враховуючи свою важливість, природні сили виробили звичай відновлюватися — властивість вельми корисна при виробництві електричної енергії. По суті, маленькі атоми, молекули та йони є поглиначами, накопичувачами, перетворювачами та ваговитими джерелами відновлюваної енергії. А витікає вона зовні під час трансформацій. Однаково правильно буде сказати у рамках наших досліджень, що джерелом молекулярної відновлюваної енергії є фізичні процеси та/або хімічні реакції, які протікають у речовині. Цінність джерела відновлюваної енергії полягає не в кількості у ньому наявних ресурсів, а в швидкості їх відновлення.
Енергетичні перетворення в атомно-молекулярних та йонно-молекулярних системах визначаються часо-просторовими та масо-енергетичними параметрами і характеристиками малих частинок. Час має один вимір, але існування, вимірюване часом, має їх два: одне за одним та воднораз. Мить є існування без жодної тривалості. Вічність є існування з усією тривалістю. У динаміці атомам, молекулам та йонам немає рівних, бо в їх обслуговуванні задіяні могутні сили Всесвіту. Співвідношення між одиницями маси та енергії, необхідні для розуміння нанорозмірів
1 кг = 5,61·1035 еВ = 8,99·1016 Дж = 2,50·1010 кВт·год = 6,02·1026 а. о. м.
1 еВ = 1,78·10–36 кг = 1,60·10–19 Дж = 4,45·10–26 кВт·год = 1,074·10–9 а. о. м.
1 кВт·год = 4,00·10–11 кг = 2,25·1025 еВ = 3,60·106 Дж = 2,41·1016 а. о. м.
Енергетичний еквівалент маси електрона mе = 9,109·10–31 кг = 0,511 МеВ.
Взаємодія молекул характеризується їх потенціальною енергією EP(r) [Дж]. Потенціальна енергія визначається роботою W [Дж], яку необхідно виконати силам F(r) [Н] для того щоб перемістити молекулу з даної точки до безкінечності, де вважається, що потенціальна енергія дорівнює нулю, EP(r) = 0. Якщо відстань між двома молекулами змінюється на величину Δr [м], то робота, що виконується, дорівнює ΔW = F(r)·Δr [Дж] і є позитивною. Зростання потенціальної енергії молекул у відповідності із законом збереження енергії супроводжується зменшенням їх кінетичної енергії EК [Дж]. Співвідношення між значеннями потенціальної EP(r) та середньої кінетичної енергії EK молекул визначає агрегатний стан речовини, EK < EP(r) для твердого тіла;
EK ≈ EP(r) для рідини;
EK " EP(r) для газів.
Співвідношення сил взаємодії молекул однієї фази між собою та з молекулами суміжної фази визначає поведінку молекул та їх агрегацій на міжфазній поверхні і, в кінцевому результаті, обумовлює енергетичні перетворення у всьому об'ємі молекулярної системи. У вихідному стані робоче тіло характеризується сумарною енергією молекул ЕIN [Дж], що може уловлюватися приймачем–перетворювачем RC і за певних умов відновлюватися. Нагнітання (відновлення параметрів) робочого тіла здійснюється, наприклад, тиском водяного або повітряного потоків.
Міжфазна поверхня
У дослідженні атомно-молекулярних та йонно-молекулярних систем або просто молекулярних систем, як ми будемо називати подібні утворення в подальшому, велику роль відіграють поняття поверхні та об'єму. Аби пізнати речовину, не обов'язково занурятися в її глибину. Поверхня та об'єм — дві різні просторові характеристики одного і того ж тіла.
Під поверхнею звичайно розуміється межа або край об'ємного тіла, двовимірне топологічне утворення, геометрична фігура, кожна точка якої та її оточення можуть бути відображені у проекції на площину без розриву. При розгляді властивостей поверхні та її частин у малих проміжках часу поняття неперервності та квантування не суперечать одне одному і пов'язані між собою у просторі та часі. Неперервна лінія складається із окремих дискретних точок. Неперервна поверхня теж складається із сукупності окремих точок. Спорідненість неперервності та квантування відбивається також на фізичних поверхневих явищах. Неперервний рух об'єкта складається із множини окремих стрибків. Точка може рухатися на поверхні лише у двох напрямках. Деталізацію цих доволі абстрактних понять залишимо математикам, там вони знаходили раніше і знаходять до цього часу величезну наснагу. Ми ж під терміном поверхня будемо розуміти оболонку певного тіла, місце його контакту з іншими тілами, сукупність точок, розташованих на краю фізичного тіла або як кордон фізичного тіла — у загальному випадку поверхня являє собою деяку деформовану площину.
Під об'ємом будемо розуміти тривимірну частину простору, яка обмежена замкнутою поверхнею. Це може бути порожнина (пустота) або ж наповнення певної форми речовиною: твердим тілом, рідиною, газом або ж плазмою. Об'єм можна представити у вигляді сукупності точок. Геометрично, об'єм можна спроектувати на поверхню, так він вироджується у поверхню, поверхня — у лінію, лінія — в точку. Об'єм контактує з іншими тілами поверхнею.
Якщо два тіла привести у контакт, то їх стани будуть змінюватись до тих пір, доки між ними встановиться рівновага. На кордоні тіла, на міжфазній поверхні, його властивості проявляються найбільш чітко. Тут атоми та молекули кожної фази оточені атомами та молекулами своєї та суміжної фаз і проявляють себе з двох сторін — зі сторони об'єму та зі сторони сусідньої речовини. Поверхня відкриває нові відомості про речовину. «Хочу стояти як можна ближче до краю, ризикуючи впасти. Із краю бачиться те, чого не видно із середини». (I want to stand as close to the edge as I can without going over. Out on the edge you see all the kinds of things you can't see from the center (Kurt Vonnegut. Player Piano).
Наше захоплення поверхнею не відкидає нашу відданість об'єму — знання поверхні дозволяє краще зрозуміти і контролювати об'єм. Поверхня — найбільш антагоністична і агресивна частина об'єму. Поверхня демонструє енергію, об'єм нею послуговується.
Деякі молекулярні джерела енергії, які ми будемо розглядати у цій роботі, мають певне відношення до поверхні. Поверхня нас цікавить, перш за все, як міжфазне утворення, кордон між твердим тілом, рідиною та газом. У контексті фізики та хімії поверхні розглядаються також молекулярні технології отримання енергії, бо їх робота пов'язана з використанням поверхневих явищ. Увагу дослідників молекулярної гідроенергетики привертають властивості міжфазних поверхонь рідина — тверде тіло та рідина — повітря, у той час як дослідники молекулярної вітроенергетики більше переймаються всім, що має відношення до міжфазної поверхні тверде тіло — повітря.
Приймач-перетворювач
Приймач-перетворювач енергії RC є активною чутливою структурою, яка трансформує енергетичні властивості молекул, атомів, йонів, інших малих частинок робочого тіла в електричну енергію ЕE. Робоче тіло з початковою енергією молекул та атомів ME1 = EIN1 [Дж] всередині та на кордоні фаз може виконати певну роботу W [Дж] і перейти у стан з енергією ME2 = EIN2 [Дж], W = ∆E = EIN1 — EIN2,
Кінцева електрична енергія EEL [Дж] пропорційна зміні енергії ∆E робочого тіла, EEL = k·∆E = k·(EIN1 — EIN2) [Дж], де EIN1, EIN2 [Дж] — сумарна енергія частинок робочого тіла у початковому та кінцевому станах. Коефіцієнт пропорційності k характеризує ефективність енергетичних перетворень і зветься коефіцієнтом корисної дії приймача-перетворювача RС.
Електричний адаптер
Електричний адаптер ЕА є пристроєм, який доводить параметри електричного струму (силу струму I [А], напругу U [В] та частоту f [Гц]) до необхідних стандартів, прийнятних для споживача та/або для спрямування в об'єднану електричну мережу ЕN. Він може поєднувати в собі функції інвертора.
Молекулярна енергетична система функціонує наступним чином. Робоче тіло WB (флюїд FL) з початковою внутрішньою енергією молекул ME1 = EIN1 [Дж] виконує роботу W [Дж] і переходить у стан з енергією ME2 = EIN2. Приймач-перетворювач RС трансформує енергію флюїду ME в електричну енергію EE, скажімо, шляхом утворення вільних електричних зарядів, електричного потенціалу й вихідного електричного струму І (EC). Параметри електричної енергії доводяться в електричному адаптері EA до необхідних стандартів, і струм спрямовується споживачам та/або в електричну мережу ЕN.
Робота W [Дж], яка виконується молекулярною енергетичною системою як термодинамічним утворенням при переході його з одного енергетичного стану до іншого, сумарна енергія частинок робочого тіла у початковому EIN1 [Дж] та кінцевому EIN2 [Дж] станах, кінцева електрична енергія EEL [Дж], яка отримується трансформацією енергії флюїду у вільні електричні заряди, в електричний потенціал та електричний струм І (EC), визначаються, наприклад, через термодинамічні параметри та характеристики цієї системи.
У залежності від агрегатного стану речовини можуть бути використані прямі чи багатоетапні процеси енергетичних перетворень при виробництві електричної енергії. Прямі та багатоетапні способи незмінно конфліктують між собою в молекулярних технологіях. Вибираючи між одним енергетичним перетворенням та їх низкою, слід пам'ятати, що будь-яке перетворення призводить до втрати частини енергії. Прямі способи виробництва електричної енергії мають істотний пріоритет перед іншими у молекулярних технологіях енергетики, бо запорукою прямого виробництва електричної енергії є перебування у русі всього, від атомів, молекул та йонів до макроскопічних тіл. Як не існують без руху електрони, протони та інші мінливі складові частинки атомів та молекул, мусимо сказати, що немає також жодного утворення кінцевої маси та розмірів, котре могло б існувати у стані спокою.
Термодинамічні параметри молекулярних систем
Молекулярна енергетична система використовує в своїй роботі сукупність малих частинок речовини або ж випромінювань, які оточені у просторі деякою уявною або ж реальною поверхнею, перебувають у взаємодії з навколишніми тілами і можуть обмінюватися із ними енергією та частинками, тож, вона є термодинамічним утворенням і може розглядатися в рамках. термодинаміки. На відміну від теплового двигуна при вивченні молекулярної енергетичної системи теплота розглядається лише як одна із багатьох форм енергії, що спроможні виконати роботу по отриманню електричної енергії.
Поведінка молекулярної енергетичної системи характеризується певними термодинамічними кількісними параметрами стану, які розкривають потоки енергії та частинок, основними з яких є тиск р [Па], температура ТК [К], густина ρ [кг/м3], об'єм V [м3], питомий об'єм υ [м3/кг] та теплоємність. У молекулярній фізиці для пояснення густини речовини оперують також поняттями моля, молекулярної (молярної) маси, атомної одиниці маси та молярного об'єму. Моль — одиниця кількості речовини, яка включає 6,0222·1023 хімічних одиниць або число Авогадро NА, NА = 6,0222·1023 моль–1. Молярна маса M [кг/моль] — фізична величина, що визначається як маса речовини m [кг], поділена на кількість речовини nM [моль]. Атомна одиниця маси [кг] або Дальтон [Да] — це маса одного протона або нейтрона. Вона еквівалентна 1 г/моль і чисельно дорівнює одній дванадцятій маси нейтрального атома вуглецю 12С у стані спокою. Об'єм, який займає один моль речовини, називається молярним об'ємом VМ [м3/моль]. Число молів nM [моль] та число молекул N зв'язані між собою співвідношеннями, nM = m/М = V/VМ;
N = nM·NА = (V/VМ) ·NА = V·NL,
де NL [м–3] — стала Лошмідта, NL = 2,6868·1025 м–3.
Окрім вказаних інтенсивних термодинамічних параметрів, використовуються також спеціальні екстенсивні параметри, такі як внутрішня енергія UIN [Дж], ентальпія H [Дж], ентропія S [Дж∙К–1], вільна енергія Гельмгольца FH [Дж] та вільна енергія Ґіббза GS [Дж], які в сукупності складають функції стану, що характеризують макроскопічні фізичні властивості системи і взаємопов'язані з іншими термодинамічними параметрами певними рівняннями в рамках законів (початків) термодинаміки. Знаючи параметри стану системи в деякий вихідний момент часу, можна передбачити її поведінку в наступні періоди.
Коли внутрішню енергію системи визначити неможливо, обмежуються визначенням зміни внутрішньої енергії ΔUIN [Дж] вказаної системи при дотриманні першого закону термодинаміки, ЕEX = ΔUIN +W,
де ЕEX [Дж] — зовнішня енергія, яка підведена до системи, W [Дж] — робота, яка виконується системою.
З іншої сторони, внутрішня енергія закритої системи UIN [Дж] може змінюватись за рахунок передачі системі деякої кількості теплоти Q [Дж] або здійснення над системою певної роботи W [Дж]; при цьому теплота Q [Дж] може переходити в роботу W [Дж], і робота може переходити в теплоту, Q = ΔUIN +W.
або у нескінченно малих величинах dUIN [Дж], dUIN = δQ — δW.
Рівняння представляє собою диференціальний запис першого начала термодинаміки для закритої системи.
Нескінченно мала кількість роботи δW [Дж] може складатися із суми нескінченно малих кількостей роботи різних видів δWі [Дж],
δW = δW1 + δW2 + δW3 +…+ δWі.
Різновидами робіт можуть бути, наприклад, механічна робота δWMEX [Дж], перенесення електричного заряду δWEL [Дж], робота поверхневого натягу δWST [Дж], намагнічування δWM [Дж] тощо,
δW = δWMEX + δWEL + δWST + δWM
Нескінченно малу кількість роботи кожного виду можна представити у вигляді добутку узагальненої сили на приріст відповідної узагальненої координати,
δW = p·dV + φ·dq + γ·dA + m·g·dh + H·dM, де φ [В] — різниця потенціалів, під дією якої відбувається переміщення заряду dq [Кл]; m [кг] — маса речовини, g [м·с–2] — прискорення вільного паління на даній місцевості, g = 9,81 м·с–2, h [м] — переміщення компонентів системи по висоті, γ [Н/м] — поверхневий натяг, під дією якого змінюється площа поверхні dА [м2]; H [A/м] — напруженість магнітного поля, під дією якої змінюється намагніченість dM [A/м].
Внутрішня енергія термодинамічної системи не залишається незмінною при перебігу термодинамічних процесів. Напрямок самочинного перебігу процесів визначається розсіюванням енергії. Кількісною мірою цього розсіювання є ентропія S [Дж∙К–1]. Поняття ентропії введено німецьким фізиком Рудольфом Клаузіусом, dS ≥ δQ/T.
Знак (=) є справедливим для зворотних процесів, знак (>) — для незворотних. Для ізольованих процесів dS ≥ 0. Для зворотного процесу справедливим є співвідношення δQ = T∙dS [Дж]. Враховуючи рівняння першого начала термодинаміки для випадку ексклюзивного виконання механічної роботи, отримуємо фундаментальне рівняння термодинаміки, dUIN = T∙dS − р∙dV.
У разі виконання всіх видів робіт маємо, dUIN = T∙dS − р∙dV + φ·dq + γ·dA + m·g·dh + H·dМ.
Фактично, кожну із узагальнених сил можна представити у вигляді часткової похідної від внутрішньої енергії UIN [Дж], Т = ∂UIN/∂S [K];
p = ∂UIN/∂V [Пa];
V = ∂UIN/∂p [м3].
Для відкритих систем рівняння (1.32) включає ще одну складову Σμi·dNi,
dUIN = T∙dS − р∙dV + Σμi·dNi [Дж], де T [К] — температура, р [Па] — тиск, S [Дж/К] — ентропія, V [м3] — об'єм, μi [Дж/моль] — хімічний потенціал i-ї частинки, Ni — число частинок.
З урахуванням всіх видів робіт, dUIN = T∙dS − р∙dV +φ·dq + γ·dA + m·g·dh + H·dМ + Σμi·dNi.
Для відкритих систем вводиться поняття ентальпії H [Дж] — термодинамічного потенціалу, котрий дорівнює сумі внутрішньої енергії системи UIN [Дж] та добутку тиску р [Па] на об'єм V [м3], H = UIN + р·V.
При постійному тиску зміна ентальпії dH [Дж] дорівнює зміні внутрішньої енергії системи T·dS [Дж] плюс робота, яка виконана при зміні тиску V·dр [Дж], dH –T∙dS ≤ 0.
Зміна внутрішньої енергії призводить до зміни ентропії та зовнішніх параметрів. Якщо система знаходиться при сталих температурі та тиску, то кількість теплоти, отриманої нею в певному процесі, дорівнює зміні її ентальпії H [Дж] тобто δQ = dH [Дж].
Тоді нерівність можна переписати так
dH = T·dS + V·dр.
За умови сталої температури ліва частина нерівності являє собою диференціал вільної енергії Гіббза GS [Дж], яка є функцією стану системи, dGS = dH − T∙dS
або
dGS = dH − T∙dS ≤ 0.
Спонтанні процеси при постійних температурі та тиску звичайно відбуваються зі скороченням вільної енергії Гіббза системи. Система у стані рівноваги володіє мінімальною вільною енергією Гіббза. Для зворотного ізотермічного процесу та сталого тиску потенціал Гіббза dGS [Дж] описується виразом: dGS = dН + р∙dV − T∙dS =
= δQ + δW + р∙dV − T∙dS [Дж].
Використовуючи перетворення Лежандра, знаходимо диференціал вільної енергії Гіббза dGS,
dGS = d(Н − T∙S) =
= T∙dS + V∙dр − T∙dS − S∙dT =
= V∙dр − S∙dT [Дж].
Як видно із рівняння, вільна енергія Гіббза — ізобарно-ізотермічний потенціал. Для відкритих систем рівняння включає ще одну складову Σμi·dNi,
dGS = V∙dр − S∙dT + Σμi·dNi [Дж].
Цей вираз називається фундаментальним рівнянням Гіббза для фізичних та хімічних систем.
Зміна енергії Гіббза з температурою, тиском або кількістю молів відповідної речовини може бути представлена у вигляді часткових похідних: S = −∂GS/∂Т [Дж/К];
V = ∂GS/∂р [м3];
μi = ∂GS/∂Ni [Дж/моль].
Хімічний потенціал μi [Дж/моль] демонструє спроможність системи виконати певну роботу. Чисельно він дорівнює енергії, яку слід вкласти, щоб система увійшла в стан термодинамічної рівноваги після включення у неї нового компонента.
Для однокомпонентної системи вільна енергія Гіббза 1 молю чистої речовини є хімічним потенціалом цієї речовини. Враховуючи (1.50), отримуємо
dGS = μ·dN.
Після інтегрування виразу (1.50) отримуємо вільну енергію Гіббза GS [Дж] для одного моля речовини, GS = μ.
Тепер читачу, хочеться думати, стає зрозумілим, чому ми приділили так багато уваги термодинамічним потенціалам Гіббза. Вони є кількісними і якісними показниками фундаментального термодинамічного рівняння і дозволяють не тільки всебічно характеризувати енергетичний стан системи із врахуванням молекулярної структури робочого тіла, але й визначають напрямок перебігу процесів. У певних випадках поведінку системи можна розглядати у геометричному виразі, тоді зміна термодинамічних потенціалів задається відповідними координатними осями, а підрахунок ведеться з початку цієї системи координат. У разі інтеграції кількох явищ в одній системі координат, термодинамічна система є багатовимірною. Викладення фізичних основ часто спрощуються за допомогою математичного ускладнення, тож, спасіння фізика шукає на берегах математики. Використовуючи формули, математика дозволяє спростити та упорядкувати текст краще, ніж це робить синтаксис чи орфографія. Довершена формула може розглядатися як викінчений різновид лаконічного тексту і не потребує пояснень — якщо для пояснення слів потрібні інші слова, то перші були пустими. З іншого боку, перенасичення тексту формулами створює певні складнощі в сприйняті матеріалу. Через умовність математична формула не може бути повною правдою, а лише напівправдою.
Молекули та атоми утворюють власні енергетичні поля і взаємодіють із зовнішніми полями. Розвиток квантової фізики виявив відносність поділу між речовиною та полем. Тільки на макрорівні поля вважаються беззмінними середовищами, на мікрорівні має враховуватись їх квантова природа.
Взаємодія між тілами та частинками, що мають електричний заряд, відбувається через електромагнітне поле, пов'язане з протонами та електронами, що входять до складу атомів, молекул та йонів. Електромагнітні сили значно перевищують гравітаційні. Електромагнітною зветься енергія, накопичена електромагнітним полем; відповідно, електростатичною зветься енергія, накопичена електростатичним полем, і магнітною зветься енергія, накопичена магнітним полем.
Енергетичний стан деякої точки простору, розташованої на відстані r [м] від заряду q [Кл] визначається електричним потенціалом φ(r) [В],
φ(r) = q/(4∙π∙ε0∙εr∙r), де ε0 [Ф/м] — діелектрична проникність вакууму, ε0 = 8,8542·10–12 Ф/м, εr — відносна діелектрична проникність середовища.
Потенціал, сформований системою зарядів, визначається як скалярна сума в скалярному полі окремих потенціалів, або ж як векторна сума у векторному полі.
Потенціальна енергія UEP [Дж] заряду q0 [Кл], який розміщений в електростатичному полі другого заряду q [Кл] із електричним потенціалом φ(r) [В], дорівнює добутку заряду q0 на електричний потенціал φ(r), UEP = q0∙φ(r).
Потенціальна енергія UEP [Дж] системи двох точкових зарядів q1 та q2 [К] прямо пропорційна добутку зарядів і обернено пропорційна відстані між ними r [м], UEP = (q1∙q2)/(4∙π∙ε0∙εr∙r).
Потенціальна енергія системи нерухомих зарядів, що формують електростатичне поле, дорівнює енергії взаємодії цих зарядів.
Що стосується електростатичної взаємодії, то згідно закону Кулона сила взаємодії FC [Н] двох точкових зарядів q1 [Кл] та q2 [Кл] прямо пропорційна добутку величин цих зарядів і обернено пропорційна квадрату відстані r [м] між ними, FC = (q1∙q2)/(4∙π∙ε0∙εr∙r2).
У твердому тілі, рідині чи газі електричні та магнітні сили проявляються однаково. Те, що рідина і тверді частинки взаємодіють між собою, утворюючи на кордоні фаз подвійний електричний шар, можна пояснити спорідненістю Природи: рідина колись була газом, кристал — рідиною. Кожна речовина, будь то газ, «мокра» рідина чи тверде тіло, складається із «сухих» електричних частинок, зв'язаних між собою в атоми, молекули та квазікристали різного роду електричними, внутрішньоядерними та гравітаційними силами. Якраз ці електричні частинки та сили, які їх з'єднують, можуть бути використані для прямого виробництва електричної енергії. Кожен акт взаємодії молекул рідини між собою, молекул рідини та твердого тіла подібний іскрі, і хай нікого не введе в оману фазний стан речовини. Жодний атрибут рідини не завадить цій іскрі. Якщо правильно скористатися електричними частинками та електричними силами в атомі та молекулі, електричними силами між атомами та молекулами а також гравітаційними та магнітними силами, ці частинки чи сили, які їх супроводжують, пройдуть через всяку матерію, навіть не торкнувшись її, як і світло доходить усюди раніше будь-якого банального дотику.
Енергетичні перетворення в молекулярній енергетиці виконуються маніпуляцією окремими атомами, молекулами, йонами та іншими співставними з ними по розмірам і масі наноскопічними (розміром ≤ 100 нм) частинками речовини. Атоми та молекули є типовими наночастинками. Перетворення енергії проходять з надвисокими фемптосекундними швидкостями. Для того, щоб скористатись потаєними у мікросвіті грандіозними ресурсами чистої енергії, у рамках молекулярної енергетики застосовуються споріднені цьому мікросвітові молекулярні наноенергетичні технології (грец. τεχνολογια або τεχνολογο — майстерність, техніка) виробництва, накопичення, транспортування та розподілу енергії. Якраз з впровадженням молекулярних технологій багато хто з фахівців пов'язує перспективи розвитку електроенергетики. Атом та молекула — найбільш досконалі енергетичні системи. Проблема полягає у тому, аби не загубити їх унікальні властивості при утворенні потужної молекулярної енергетичної системи. Досконала енергетична система зберігає в собі виняткові атрибути атома та молекули. Поважне ставлення до енергетичних перетворень дозволяє запобігти можливим катастрофічним наслідкам.
Примітки
- Сидоров (2018). Від макроскопічних до молекулярних технологій відновлюваної енергії. Промислова електроенергетика та електротехніка — № 3. — С. 34—42. (українська).
- Сидоров, Василь (2020). Молекулярна енергетика. Теорія та технічні рішення. (українська). Черкаси: Вертикаль, видавець Кандич С. Г. с. 486 с. ISBN 978-617-7475-79-7.
- Hauksbee, F. (1709). Physico-mechanical Experiments on Various Subjects. (англійська). London, England: printed by R. Brugis. с. 139–169.
- II. An account of some experiments shown before the Royal Society; with an enquiry into the cause of the ascent and suspension of water in capillary tubes.. Philosophical Transactions of the Royal Society of London 30 (355). 31 грудня 1719. с. 739–747. ISSN 0261-0523. doi:10.1098/rstl.1717.0026. Процитовано 26 червня 2020.
- Bernoulli, D. (1738). Hydrodynamica, sive de Viribus et Motibus Fluidorum commentarii. Opus Academicum. (Лат). Strasbourg: Dulsecker.
- Young,, Tomas (1805). An essay on the cohesion of fluids. Philosophical Transactions of the Royal Society of London. – 95. – Р. 65-87. (англ.).
- Marquis de Laplace, Pierre Simon (1805). Traité de Mécanique Céleste, volume 4 Supplément au dixième livre du Traité de Mécanique Céleste (французька). Paris, France: Courcier. с. 1–79.
- Gauss, Carl Friedrich (1877). Principia generalia theoriae figurae fluidorum in statu aequilibrii. Werke. Berlin, Heidelberg: Springer Berlin Heidelberg. с. 287–292. ISBN 978-3-642-49320-1.
- Hagen, G. (1839). Ueber die Bewegung des Wassers in engen cylindrischen Röhren. Annalen der Physik und Chemie 122 (3). с. 423–442. ISSN 0003-3804. doi:10.1002/andp.18391220304. Процитовано 26 червня 2020.
- Poiseuille, J. L. M. (1841). Recherches expérimentales sur le mouvement des liquides dans les tubes de très petits diamètres. Mémoire lu (3e partie, suite). Comptes rendus hebdomadaires des séances de l'Académie des Sciences. – Vol. 12. – Р. 112-115. (французька).
- Neumann, F. with Wangerin, A. ed., (1894.). Vorlesungen über die Theorie der Capillarität (нім.). Leipzig, Germany: B. G. Teubner.
- Navier, C. L. M. H. (1833.). Résumé des leçons données à l'École des ponts et chaussées sur l'application de la mécanique à l'Établissement des constructions et des machines, tome 2, Deuxième partie, leçons sur le mouvement et la résistance des fluides, la conduite et la distribution des eaux, Troisième partie, leçons sur l'établissement des machines (Фр.). Paris: chez Carilian-Gœury.
- Navier, C. L. M. H. (1833.). Résumé des leçons données à l'École des ponts et chaussées sur l'application de la mécanique à l'Établissement des constructions et des machines, tome 1, Première partie contenant des leçons sur la résistance des matériaux, et sur l'établissement des constructions en terre, en maçonnerie et en charpente (Фр.). Paris: chez Carilian-Gœury.
- Stokes, G. G. (1864). On the discontinuity of arbitrary constants which appear in divergent developments. Transactions of the Cambridge Philosophical Society. – Vol. 10. Part I. – Р. 105-124, 125-128. (Англ.).
- Stokes, G. G. (1856). On the numerical calculation of a class of definite integrals and infinite series. Transactions of the Cambridge Philosophical Society. – Vol. 9. Part I. – Р. 166-188.
- Boyle, R. (1661.). The Sceptical Chymist. London.
- Boyle, R. (1666.). Origin of Forms and Qualities according to the Corpuscular Philosophy. (A continuation of his work on the spring of air demonstrated that a reduction in ambient pressure could lead to bubble formation in living tissue. This description of a viper in a vacuum was the first recorded description of decompression sickness.).
- Boyle, R. (1674.). wo volumes of tracts on the Saltiness of the Sea, Suspicions about the Hidden Realities of the Air, Cold, Celestial Magnets.
- Boyle, R. (1660.). New Experiments Physico-Mechanical: Touching the Spring of the Air and their Effects (Англ.). Oxford, H-Hall.
- Boyle, R. A (1669). A Continuation of New Experiments Physico-mechanical, Touching the Spring and Weight of the Air, and Their Effects (Англ.). Oxford, H-Hall. с. 198.
- Mariotte, E. (1679.). Essais de Physique, ou mémoires pour servir à la science des choses naturelles "Second essai. De la nature de l'air" (Фр.). Paris, France: E. Michallet.
- Humboldt, A., Gay-Lussac, J. L. . (1804.). Mémoires sur l'analyse de l'air atmosphérique (Фр.). Paris.
- Gay-Lussac, J. L. (1827-1828). Cours de physique (Фр.). Paris. с. 562 p.
- Gay-Lussac, J. L. (1802). Recherches sur la dilatation des gaz et des vapeurs. Annales de chimie. – 43. – Р. 137-175. (Фр.).
- Avogadrо, A. (1811). Essai d'une manière de déterminer les masses relatives des molécules élémentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons. Journal de Physique, de Chimie et d'Histoire naturelle. – 73. – Р. 58-76. (Фр.).
- Clapeyron, E. (1834). Mémoire sur la puissance motrice de la chaleur. Journal de l'École Polytechnique. – XIV. – Р. 153-90. (Фр.).
- Mayer, J. R. (1867). Die Mechanik der Wärme (Нім.). с. 294 р.
- Mayer, J. R. (1842). Bemerkungen über die Kräfte der unbelebten Natur. Annalen der Chemie und Pharmacie. – 42 (2). – Р. 233-240. (Нім.).
- Waterston, J. J. (1843.). Thoughts on the Mental Functions (Англ.).
- Krönig, A. (1856). Grundzüge einer Theorie der Gase. Annalen der Physik. – Vol. 99 (10): – Р. 315-322. (Нім.).
- Clausius, R. (1850). Ueber die bewegende Kraft der Wärme und die Gesetze, welche sich daraus für die Wärmelehre selbst ableiten lassen. Annalen der Physik. – Vol. 79. – Р. 368-397, 500-524. (Нім.).
- Clausius, R. (1857). Über die Art der Bewegung, die wir Wärme nennen. Annalen der Physik. – Vol. 100. – Р. 353-379. (Нім.).
- Maxwell, J. C. (1867). On the Dynamical Theory of Gases. Philosophical Transactions of the Royal Society of London. – Vol. 157. – 49 р. (Англ.).
- Boltzmann, L. E. (1871). Analytischer Beweis des zweiten Haubtsatzes der mechanischen Wärmetheorie aus den Sätzen über das Gleichgewicht der lebendigen Kraft.
- Boltzmann, L. E. (1871). Über das Wärmegleichgewicht zwischen mehratomigen Gasmolekülen.
- Thomson, W. (1851). On the dynamical theory of heat; with numerical results deduced from Mr. Joule's equivalent of a thermal unit and M. Regnault's observations on steam. Math. and Phys. Papers. – Vol. 1. – Р. 175-183. (Англ.).
- Van der Waals, J. D. (1873). Over de Continuiteit van den Gas- en Vloeistoftoestand (on the continuity of the gas and liquid state). PhD thesis (Нім.). Leiden, The Netherlands.
- Einstein, A. (1905). Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten. Teilchen. Annalen der Physik. – Vol. 17 (8). – Р. 549-560. (Нім.).
- Smoluchowski, M. (1906). Zur kinetischen Theorie der Brownschen Molekularbewegung und der Suspensionen. Annalen der Physik. – Vol. 21 (14). – Р. 756-780. (Нім.).
- Galvani, L. (1791). De viribus electricitatis in motu musculari commentarius. De Bononiensi Scientiarum et Artium Instituto atque Academia Commentarii. – № 7. – Р. 363-418. (Італ.).
- Volta, A. (1777). Lettere del Signor Don Alessandro Volta Sull. Aria Inflammabile Nativa delle Paludi [Letters of Signor Don Alessandro Volta … on the flammable native air of the marshes] (Італ.). Milan, Italy: Giuseppe Marelli.
- Ampère, A. M. (1826). Description d'un appareil électro-dynamique (Фр.). Paris: Bachelier.
- Ampère, A. M. (1834). Essai sur la philosophie des sciences, ou Exposition analytique d'une classification naturelle de toutes les connaissances humaines (Фр.). Paris: Bachelier.
- Ampère, André-Marie (1827). Théorie mathématiques des phénomènes électro-dynamiques, uniquement déduite de l'expérience (Фр.). Paris: Firmin Didot.
- Ohm, G. S. (1827). Die galvanische Kette. Mathematisch Bearbeitet (Нім.).
- Ohm, G. S. (1826). Bestimmung des Gesetzes, nach welchem Metalle die Contactelektricitätleiten.
- Faraday, M. (1832). Experimental Researches in Electricity. First Series. Philosophical Transactions of the Royal Society. – Р. 125-162. (Англ.).
- Maxwell, J. C. (1865). A Dynamical Theory of the Electromagnetic Field. Phil. Trans. R. Soc. Lond. – Vol. 155. – Р. 459-512. (Англ.).
- Reuss, F. F. (1808). Notice sur un nouvel effet de l'électricité galvanique. // Mémoires de la Societé Impériale des Naturalistes de Moscou. Mémoires de la Societé Impériale des Naturalistes de Moscou. – Vol. 2. – Р. 327-337. (Фр.).
- Quincke, G. H. (1859). Ueber eine neue Art electrischer Ströme. Ann. Phys. Chem. – Vol. 107. – Р. 1-47. (Нім.).
- Helmholtz, H. (1879). Studien über electrische Grenzschichten. Annalen der Physik. – Vol. 243, Issue 7. – Р. 337-382. (Нім.).
- Gouy, M. (1910). Sur la constitution de la charge électrique à la surface d'un électrolyte. J. de Physique Théorique et Appliquée. – Vol. 9. – Р. 457-468. (Фр.).
- Chapman, D. J. (1913). A contribution to the theory of electrocapillarity. Philos. Mag. – Vol. 25. – Р. 475-481. (Англ.).
- Stern, O. (1924). Zur Theorie der elektrolytischen Doppelschicht. Zeitschrift für Elektrochemie. – Vol. 30. – Р. 508-516. (Нім.).
- Contribution à la théorie de l’endosmose électrique et de quelques phénomènes corrélatifs. Bulletin international de l’Académie des Sciences de Cracovie. – Vol. 8. – Р. 182-200. (Фр.). 1903.
- Gibbs, J. W. (1876). On the Equilibrium of Heterogeneous Substances. Transactions of the Connecticut Academy of Sciences (Англ.).
- Hoff, J. H. van't. (1884). Etudes de dynamique chimique (Фр.). Amsterdam: Frederik Muller Publisher. с. 242.
- Arrhenius, S. (1896). On the Influence of Carbonic Acid in the Air upon the Temperature of the Ground. London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science (fifth series). – April. – Vol. 41. – Р. 237-275. (англ.).
- Arrhenius, S. (1884). Recherches sur la conductivité galvanique des électrolytes, doctoral dissertation (Фр.). Stockholm: Royal publishing house, P.A. Norstedt & söner. с. 89.
- Langmuir, I. (1906). The Constitution and Fundamental Properties of Solids and Liquids: II. Liquids. Journal of the American Chemical Society. – Vol. 39 (9). – Р. 1848-1906. (англ.).
- Rutherford, E. (1913). Radioactive Substances and their Radiations (Англ.). Cambridge: Univ. Press. с. 734.
- Rutherford, E. (1906). Radioactive Transformations (Англ.). New York: C. Scribner& Sons. с. 319.
- Rutherford, E. (1905). Radio-activity. 2nd ed. (Англ.). Cambridge University Press. с. 609.
- Bohr, N. (1913). On the Constitution of Atoms and Molecules, Part I. Philosophical Magazine. – Vol. 26. – Р. 1-24. (Англ.).
- On the Constitution of Atoms and Molecules, Part III. Systems containing several nuclei. Philosophical Magazine. – 26 (155). – Р. 857-875. (Англ.). 1913.
- Bohr, N., Kramers, H. A., Slater, J. C. (1924). The Quantum Theory of Radiation. Philosophical Magazine. – 47 (6). – Р. 785-802. (Англ.).
- Bohr, N. (1913). On the Constitution of Atoms and Molecules, Part II. Systems Containing Only a Single Nucleus. Philosophical Magazine. – 26 (153). – Р. 476-502. (Англ.).
- Pauli, W. (1925). Über den Zusammenhang des Abschlusses der Elektronengruppen im Atom mit der Komplexstruktur der Spektren (On the Connexion between the Completion of Electron Groups in an Atom with the Complex Structure of Spectra). Zeitschrift für Physik. – 31. – Р. 765-783 (Нім.).
- de Broglie, L. (1926). Ondes et Mouvements (Фр.). Paris: Gauthier-Villars.
- de Broglie, L. (1925). Recherches sur la théorie des quanta. Annales de Physique. –10 (3). – Р. 22-128 (Фр.).
- Schrödinger, E. (1926). Quantisierung als Eigenwertproblem (Quantization as a Problem of Eigenvalues). Annalen der Physik. – 384. – Р. 361-377. (Нім.).
- Schrödinger, E. (1927). Abhandlungen zur Wellenmechanik (Нім.). Leipzig.
- Schrödinger, E. (1926). An Undulatory Theory of the Mechanics of Atoms and Molecules. Physical Review. – 28 (6). – Р. 1049-1070 (Англ.).
- Born, M., Heisenberg, W., Jordan, P. (1926). Zur Quantenmechanik II (On quantum mechanics II)557-615.. Zeitschrift für Physik. – Vol. 35, № 8-9. – P. 557-615. (Нім.).
- Heisenberg, W. (1927). Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik (The Actual Content of Quantum Theoretical Kinematics and Mechanics). Zeitschrift für Physik. – Vol. 43, № 3-4. – P. 172-198. (Нім.).
- Heisenberg, W. (1925). Über quantentheoretische Umdeutung kinematischer und mechanischer Beziehungen (Quantum theoretical re-interpretation of kinematic and mechanical relations). Zeitschrift für Physik. – Vol. 33, № 1. – P. 879-893. (Нім.).
- Heisenberg, W. , Pauli, W. (1929). Zur Quantendynamik der Wellenfelder (On the quantum dynamics of wave fields). Zeitschrift für Physik. – Vol. 56, № 1-2. – P. 1-61. (Нім.).
- Heisenberg, W. (1928). Zur Theorie des Ferromagnetismus (On the theory of ferromagnetism). Zeitschrift für Physik. – Vol. 49, № 9-10. – P. 619-636. (Нім.).
- Dirac, P. A. M. (1926). On the Theory of Quantum Mechanics. Proceedings of the Royal Society. – 112 (762). – P. 661-677 (Англ.).
- Dirac, P. A. M. (1930). The Principles of Quantum Mechanics (Англ.). Oxford: Clarendon Press.
- Dirac, P. A. M. (1931). Lectures on quantum mechanics (Англ.).
- Dirac, P. A. M. (1928). The Quantum Theory of the Electron. Proceedings of the Royal Society of London. – 117 (778). – P. 610-624 (Англ.).
Джерела
- Keesom, W.H. The second virial coefficient for rigid cpherical molecules whose mutual attraction is equivalent to that of a quadruplet placed at its center // Proc. R. Acad. Sci. — 1915.– Vol. 18. — Р. 636—646.
- Debye, P. Zur Theorie der spezifischen Waerme // Annalen der Pyisik. Leipzig. – 1912. — 39(4). — P. 789—839.
- Heitler, W. and London, F. Wechselwirkung neutraler Atome und homöopolare Bindung nach der Quantenmechanik // Zeitschrift für Physik. — 1927. — 44. — Р. 455472.
- Jones, J. E. On the Determination of Molecular Fields. I. From the Variation of the Viscosity of a Gas with Temperature // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1924. — 106 (738). — Р. 441—462.
- Jones, J. E. On the Determination of Molecular Fields. II. From the Equation of State of a Gas // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1924. — 106 (738). — Р. 463.
- Jones, J. E., Ingham, А. Е. On the Calculation of Certain Crystal Potential Constants, and on the Cubic Crystal of Least Potential Energy // Proceedings of the Royal Society. A. — 1925. — 107. — Р. 636—653.
- Garner, W. E., Lennard-Jones, J. E. Molecular Spectra and Molecular Structure. A general discussion // Transactions of the Faraday Society. — 1929. — Т. 25. — Р. 611—627.
- Lennard-Jones, J. E. The electronic structure of some diatomic molecules // Transactions of the Faraday Siciety. 1929. — Vol. 25. — P. 668—686.
- Lennard-Jones, J. E. Wave Functions of Many-Electron Atoms // Mathematical Proceedings of the Cambridge Philosophical Society. — 1931. — 27 (3). — Р. 469.
- Lennard-Jones, J. E. The electronic structure and the interaction of some simple radicals // Transactions of the Faraday Society. — 1934. — Vol. 30. — Р. 70-148
- Lennard-Jones, J. E. The Electronic Structure of Some Polyenes and Aromatic Molecules. I. The Nature of the Links by the Method of Molecular Orbitals // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1937. — 158 (894). — Р. 280.
- Lennard-Jones, J. E. The Molecular Orbital Theory of Chemical Valency. I. The Determination of Molecular OrbitalsProceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1949. — 198 (1052).
- Hall, G. G., Lennard-Jones, J. E. The Molecular Orbital Theory of Chemical Valency. III. Properties of Molecular Orbitals // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1950. — 202 (1069). — Р. 155.
- Lucas, R. Ueber das Zeitgesetz des Kapillaren Aufstiegs von Flussigkeiten // Kolloid Z. — 1018. — Vol. 23(1). — P. 15-22.
- Washburn, E.W. The Dynamics of Capillary Flow // Physical Review. — 1921..- Vol. 17(3). — P. 273—283.
- Rideal, E. An Introduction to Surface Chemistry. — Cambridge University Press, 1926. 346 p.
- Rideal, E. Bakerian Lectures. On Reactions in Monolayers // Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. — 1951. — Vol. 209(1099). — P. 321—446.
- Hamraoui, A. and Nylander, T. Analytical Approach for the Lucas–Washburn Equation // Journal of Colloid and Interface Science. — 2002. — Vol. 250. — Р. 415—421.
- Brunauer, S., Emmet, P.H., Teller, E. Adsorption of Gases in Multimolecular Layers // Journal of American Chemical Society. — 1938. — Vol. 60(2). — P. 309—319.
- Fan, X., Phan-Thien, N., Tanner, R. Numerical Study on Some Rheological Problems of Fibre Suspensions: Numerical Simulations of Fibre Suspensions. — Germany: VDM Verlag Dr Muller, 2008. — 188 р.
- Zheng, R., Tanner, R., Fan, X. Injection Molding: Integration of Theory and Modeling Methods. — Heidelberg Dordrecht London New York: Springer, 2011. — 187 p.
- Warrick, A. W. Soil Water Dynamics. — Oxford University Press, 2003. — 416 р.
- Devereux, D. F., de Bruin, P. L. Interaction of Plane Parallel Double Layers. — Massachusetts Institute of Technology: The MIT Press, 1963. — 361 р.
- Haydon, D. A. The Electrical Double Layer and Electrokinetic Phenomena. In: Recent Progress in Surface Science / Ed. by Danielly J. F., Panknurst K. G. A., Ridiford A. C. N. Y.: Academic Press, 1964. — Р. 94-157.
- Levine, S., Neale, G., Epstein, N. The prediction of electro-kinetic phenomena with in multiparticle systems. 2. Sedimentation potential // J. Coll. Int. Sci. — 1976. Vol. 57, № 3. — Р. 424—437.
- Lyklema, J. Fundamentals of Interface and Colloid Science, Solid–Liquid Interfaces. Vol. 2. New York: Academic Press, 1995. — 768 p.
- Ajdari, A. Electroosmosis on inhomogeneously charged surfaces // Phys. Rev. Lett. — 1995. — Vol. 75. — Р. 755—758.
- Ajdari, A. Pumping liquids using asymmetric electrode arrays // Phys. Rev. — 2000. — Vol. E 61. — R45-R48.
- Squires, T. M. and Bazant, M. Z. Induced-charge electro-osmosis // J. Fluid. Mech. — 2004. — Vol. 509. — Р. 217—252.]
- Squires, T. M. and Bazant, M. Z. Breaking symmetries in induced-charge electro-osmosis and electrophoresis // J. Fluid Mech. — 2006. — Vol. 560. — Р. 65-101.
- Huang, D. M. et al. Molecular views of electrokinetic phenomena In «Surface Electrical Phenomena in Membranes and Microchannels», A. Szymczyk (Ed), Research Signpost, 2008.
- Ohshima, H. Theory of electrostatics and electrokinetics of soft particles // Sci. Technol. Adv. Mater. — 2009. — Vol. 10 (6). — Р. 1-13.
- Bazant, M. Z. et al. Towards an understanding of induced-charge electrokinetics at large applied voltages // Advances in Colloid and Interface Science. — 2009. — Vol. 152. — Р. 48-88.
- Lacoste, D. et al. Electrostatic and electrokinetic contributions to the elastic moduli of a driven membrane // European Physical Journal. — 2009. — Vol. E 28. — Р. 243—264.
- Kilic, M. S. and Bazant, M. Z. Induced-charge electrophoresis near a wall // Electrophoresis. — 2011. — Vol. 32. — Р. 614—628.
- Bazant, M. Z. and Squires, T. M. Induced-charge electrokinetic phenomena // Current Opinion in Colloid and Interface Science. — 2010. — Vol. 15. — Р. 203—213.
- Духин, С. С., Шилов, В. Н. Диэлектрические явления и двойной слой в дисперсных системах и полиэлектролитах. — Киев: Наук. думка, 1972. — 246 с.
- Dukhin, S. S. and Shilov, V. N. Dielectric phenomena and the double layer in dispersed systems and polyelectrolytes. — New York: John Wiley and Sons, 1974.
- Dukhin, S. S. & Derjaguin, B. V. Electrokinetic Phenomena. — New York: John Wiley and Sons, 1974.
- Духин, С. С. Электропроводность и электрокинетические свойства дисперсных систем. — Киев: Наук, думка, 1975. — 246 с.
- Духин С. С., Дерягин Б. В. Электрофорез. — М.: Наука, 1976. — 326 с.
- Dukhin, S. S. & Shilov, V. N. Kinetic aspects of electrochemistry of disperse systems. Part 2. Induced dipole-moment and the nonequilibrium double-layer of a colloid particle // Adv. Colloid Interface Sci. — 1980. — Vol. 13. — Р. 153—195.
- Жарких, Н. И., Шилов, В. Н. Теория обратного осмоса на мембране из сферических частиц. Приближение Дебая // Химия и технология воды. — 1981. — Т. 4, № 1. — С. 3-9.
- Delgado, A. V. et al. Measurement and interpretation of electrokinetic phenomena (IUPAC Technical Report) // Pure Appl. Chem. — 2005. — Vol. 77, № 10. — Р. 1753—1805.
- Delgado, A. V. Interfacial Electrokinetics and Electrophoresis. — New York, NY: Marcel Dekker, Inc., 2002. — 991 p.
- Berthier, J. Micro-Drops and Digital Microfluidics — Norvich, NY: William Andrew Inc., 2008. — 441 p.
- Tabeling, P. Introduction to Microfluidics — USA Oxford University Press, 2010. — 310 p.
- Ramos, A. (Ed.). Electrokinetics and Electrohydrodynamics in Microsystems — Wien, New York: Springer, 2011. — 300 p.
- Galindo-Rosales, F. J. (Ed.). Complex Fluid-Flows in Microfluidics / Springer International publisher AG, 2018. — 111 p.
- Burgreen, D. and Nakache, F. R. Efficiency of Pumping and Power Generation in Ultrafine Electrokinetic Systems J. Appl. Mech. — 1965. — 32 (3). — P. 675—679.
- Van der Heyden, F. H. et al. Electrokinetic Energy Conversion Efficiency in Nanofluidic Channels Nano Letters. — 2006. — Vol. 6, № 10. — P. 2232—2237.
- Van der Heyden, F. H. et al. Power Generation by Pressure-Driven Transport of Ions in Nanofluidic Channels Nano Letters. — 2007. — Vol. 7, № 4. — P. 1022—1025.
- Linde N. et al. Streaming current generation in two-phase flow conditions Geophys. Res. Lett. — 2007. — 34 (3). — L03306.
- Sherwood, J. D. et al. Theoretical aspects of electrical power generation from two-phase flow streaming potentials Microfluidics and Nanofluidics. — 2013. — 15. — Р. 347—359.
- Duffin, A. M., Saykelly, R. I. Electrokinetic Power Generation from Liquid Water Microjets J. Phys. Chem. — 2008. — 112 (43). — Р. 17018-17022.
- Mansouri, A., Bhattacharjee, S., Kostiuk, L. W. High-power electrokinetic energy conversion in a glass microchannel array Lab on a Chip. — 2012. — 12. — Р. 4033-4036.
- Lin, C. H., Ferguson, G. S., and Chaudhury, M. K. Electrokinetics of Polar Liquids in Contact with Nonpolar Surfaces Langmuir. — 2013. — Vol. 29, № 25. — P. 7793-7801.
- Haldrup, S. et al. High Electrokinetic Energy Conversion Efficiency in Charged Nanoporous Nitrocellulose/Sulfonated Polystyrene Membranes — 2015. — Vol. 15, № 2. — P. 1158—1165.
- Pattle, R. E. Production of electric power by mixing fresh and salt water in the hydroelectric pile // Nature. — 1954. — Vol. 174. — Р. 660—666.
- Norman, R. S. Water salination: a source of energy // Science. — 1974. — Vol. 186. — Р. 350—352.
- Loeb, S. Osmotic power plants // Science. — 1975. — Vol. 189. — Р. 654—655.
- Loeb, S. Method and apparatus for generating power utilizing pressure-retarded osmosis, United States patent US 3 906 250, 1975.
- McGinnis, R. L., McCutcheon, J. R., Elimelech, M. A novel ammonia–carbon dioxide osmotic heat engine for power generation // Journal of Membrane Science. — 2007. — Vol. 305. — Р. 13-19.
- Nijmeijer, K.; Metz, S. Salinity Gradient Energy. In Sustainability Science and Engineering; Isabel, C. E., Andrea, I. S., Eds.; Elsevier, 2010. — Vol. 2. — Р. 95-139.
- Yip, N. Y., Elimelech, M. Comparison of Energy Efficiency and Power Density in Pressure Retarded Osmosis and Reverse Electrodialysis // Environ. Sci. Technol. — 2014. — Vol. 48. — Р. 11002-11012.
- Cipollina, A., Micale, G. Sustainable Energy from Salinity Gradients. — Cambridge: Woodhead Publishing, 2016. — 350 p.
- Touati, K., Tadeo, F., Kim, J. H. Silva, O. A. Pressure Retarded Osmosis: Renewable Energy Generation and Recovery. Academic Press, 2017. — 188 p.
- Tufa, R. A. et al. Progress and prospects in reverse electrodialysis for salinity gradient energy conversion and storage // Applied Energy. — 2018. — Vol. 225 (C). — Р. 290—331.
- Alfven, H. Existance of electromagnatic-hydrodynamic waves // Nature. — 1942. — Vol. 150, Iss. 3805. — P. 405—406.
- Alfven, H. On the cosmogony of the solar system III // Stockholms Observatoriums Annaler. — Vol. 14. — Р. 1-9.
- Lundquist, S. Experimental investigations of magneto-hydrodynamic waves // Physical Review. — 1949. — Vol. 76. — Р. 1805—1809.
- Sutton, G. W. and Sherman, A. Engineering Magnetohydrodynamics. — New York: MacGraw-Hill, 1965. — 548 p.
- Hughes, W. F. and Young, F. J. The Electromagnet dynamics of fluids. — New York: John Wiley and Sons, 1966.
- Elliott, D. G. Direct current liquid-metal magnetohydrodynamic power generation // AIAA Journal. — 1966. — Vol. 4, № 4. — Р. 627—634.
- Rosa, R. J. Magnetohydrodynamic energy conversion. — Washington: Hemisphere Pub. Corp., 1987.
- Yoshizawa, A. Hydrodynamic and Magnetohydrodynamic Turbulent Flows. Modelling and Statistical Theory. — Publisher, Springer Netherlands, 1998.
- Takeda, M. et al. Fundamental Studies on Helical-Type Seawater MHD Generation System // IEEE Transactions on Applied Superconductivity. — 2005. — Vol. 15, № 2. — Р. 2170—2173.
- Takeda, M., Hirosaki, H., Kiyoshi, T., Nishio, S. Fundamental Study of Helical-Type Seawater MHD Power Generation with Partitioned Electrodes // Journal of the JIME. — 2014. — Vol. 49, № 3. — Р. 113—117.
- Morgan, E. R. and Shafer M. W. Marine Energy Harvesting Using Magnetohydrodynamic Power Generation. — ASME 2014 Conference on Smart Materials, Adaptive Structures and Intelligent Systems. Volume 2: Mechanics and Behavior of Active Materials; Integrated System Design and Implementation; Bioinspired Smart Materials and Systems; Energy Harvesting Newport, Rhode Island, USA, September 8-10, 2014.
- Directing Matter and Energy: Five Challenges for Science and the Imagination: a Report from the Basic Energy Sciences Advisory Committee, U.S. Department of Energy. Office of Basic Energy Sciences, 2007. — Energy development. — 134 p.
- Wolf, E. L. Nanophysics of Solar and Renewable Energy. Wiley-VCH, 2012. –270 p.
- Kirby, B.J. Micro- and Nanoscales Fluid Mechanics: Transport in Microfluidic Devices. Cambridge Univirsity Press. 2010. — 536 p.
- Ohta, T. Energy Technology: Sources, Systems, and Frontier Conversion. Oxford: Pergamon Press, 1994. — 235 p.