HDAC4
HDAC4 (англ. Histone deacetylase 4) – білок, який кодується однойменним геном[5][6], розташованим у людей на короткому плечі 2-ї хромосоми. [7] Довжина поліпептидного ланцюга білка становить 1 084 амінокислот, а молекулярна маса — 119 040[8].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MSSQSHPDGL | SGRDQPVELL | NPARVNHMPS | TVDVATALPL | QVAPSAVPMD | ||||
| LRLDHQFSLP | VAEPALREQQ | LQQELLALKQ | KQQIQRQILI | AEFQRQHEQL | ||||
| SRQHEAQLHE | HIKQQQEMLA | MKHQQELLEH | QRKLERHRQE | QELEKQHREQ | ||||
| KLQQLKNKEK | GKESAVASTE | VKMKLQEFVL | NKKKALAHRN | LNHCISSDPR | ||||
| YWYGKTQHSS | LDQSSPPQSG | VSTSYNHPVL | GMYDAKDDFP | LRKTASEPNL | ||||
| KLRSRLKQKV | AERRSSPLLR | RKDGPVVTAL | KKRPLDVTDS | ACSSAPGSGP | ||||
| SSPNNSSGSV | SAENGIAPAV | PSIPAETSLA | HRLVAREGSA | APLPLYTSPS | ||||
| LPNITLGLPA | TGPSAGTAGQ | QDAERLTLPA | LQQRLSLFPG | THLTPYLSTS | ||||
| PLERDGGAAH | SPLLQHMVLL | EQPPAQAPLV | TGLGALPLHA | QSLVGADRVS | ||||
| PSIHKLRQHR | PLGRTQSAPL | PQNAQALQHL | VIQQQHQQFL | EKHKQQFQQQ | ||||
| QLQMNKIIPK | PSEPARQPES | HPEETEEELR | EHQALLDEPY | LDRLPGQKEA | ||||
| HAQAGVQVKQ | EPIESDEEEA | EPPREVEPGQ | RQPSEQELLF | RQQALLLEQQ | ||||
| RIHQLRNYQA | SMEAAGIPVS | FGGHRPLSRA | QSSPASATFP | VSVQEPPTKP | ||||
| RFTTGLVYDT | LMLKHQCTCG | SSSSHPEHAG | RIQSIWSRLQ | ETGLRGKCEC | ||||
| IRGRKATLEE | LQTVHSEAHT | LLYGTNPLNR | QKLDSKKLLG | SLASVFVRLP | ||||
| CGGVGVDSDT | IWNEVHSAGA | ARLAVGCVVE | LVFKVATGEL | KNGFAVVRPP | ||||
| GHHAEESTPM | GFCYFNSVAV | AAKLLQQRLS | VSKILIVDWD | VHHGNGTQQA | ||||
| FYSDPSVLYM | SLHRYDDGNF | FPGSGAPDEV | GTGPGVGFNV | NMAFTGGLDP | ||||
| PMGDAEYLAA | FRTVVMPIAS | EFAPDVVLVS | SGFDAVEGHP | TPLGGYNLSA | ||||
| RCFGYLTKQL | MGLAGGRIVL | ALEGGHDLTA | ICDASEACVS | ALLGNELDPL | ||||
| PEKVLQQRPN | ANAVRSMEKV | MEIHSKYWRC | LQRTTSTAGR | SLIEAQTCEN | ||||
| EEAETVTAMA | SLSVGVKPAE | KRPDEEPMEE | EPPL |
Кодований геном білок за функціями належить до репресорів, гідролаз, регуляторів хроматину, фосфопротеїнів. Задіяний у таких біологічних процесах як транскрипція, регуляція транскрипції, поліморфізм, альтернативний сплайсинг. Білок має сайт для зв'язування з іонами металів, іоном цинку. Локалізований у цитоплазмі, ядрі.
Як і всі ферменти групи гістондеацетилаз, близької до сиртуїнів, гістондеацетилаза 4 каталізує видалення ацетильних груп із залишків лізину в N-кінцевій частині корових гістонів (H2A, H2B, H3 і H4), що змінює структуру хроматину. Деацилювання гістонів є одним з механізмів транскрипційної та епігенетичної регуляції, впливає на хід клітинного циклу і бере участь в регуляції розвитку[9]. Робота HDAC4 регулюється шляхом різних посттрансляційних модифікацій і взаємодій з різноманітними білками, іноді тканиноспецифічними. Порушення роботи HDAC4 призводить до розвитку багатьох захворювань, зокрема ракових[10], тому інгібітори HDAC4 можуть мати важливе медичне застосування.
Ген і регуляція експресії
У людини ген HDAC4 розташований на 2-ій хромосомі (2q37.3)[9], завдовжки близько 353,49 кілобаз (кб), містить 37 екзонів[11] і дає початок 8980 мРНК-транскриптам. У миші гомологічний ген Hdac4 має довжину близько 215,7 кб, розташовується на 1-ій хромосомі і дає початок 3960 мРНК-транскриптам. HDAC4 експресується в різних тканинах, і рівень експресії залежить від інтенсивності різних стимулів. Попри величезну кількість процесів, регульованих HDAC4, і унікальні механізми регуляції активності цього білка, про механізми регуляції його експресії відомо мало. Фактори транскрипції SP1 і SP3 пов'язуються безпосередньо зі специфічними консенсусними GC-збагаченими ділянками в промоторі HDAC4 і запускають транскрипцію HDAC4. HDAC4 не експресується в ядрах ембріональних стовбурових клітин миші, однак на початку диференціації клітин рівень його експресії різко зростає[10].
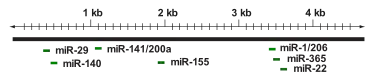
Показано, що в регуляції експресії HDAC4 беруть участь кілька МікроРНК, серед яких miR-1, miR-29, miR-140, miR-155, miR-200a, miR-206 і miR-365, які діють у клітинах різних типів. miR-200a безпосередньо зв'язується з 3'-нетрансльованою областю (3'-UTR) мРНК HDAC4 і пригнічує його експресію. miR-1 специфічна для клітин м'язів і стимулює міогенез, діючи на 3'-UTR мРНК HDAC4 і пригнічуючи експресію HDAC4. Білок mTOR контролює MyoD-залежну транскрипцію miR-1 через вищерозміщений енхансер, а опосередкована miR-1 репресія HDAC4 призводить до утворення фоллістатину і подальшого злиття міоцитів. Тимчасова трансфекція прогеніторних клітин кардіоміоцитів за допомогою miR-1 і miR-499 знижувала швидкість проліферації і викликала посилену диференціацію людських прогеніторних кардіоміоцитів і клітин ембріональних стовбурових клітин у кардіоміоцити через репресію HDAC4. Крім того, miR-22, пригнічена при гепатоцелюлярній карциномі, пригнічує проліферацію і схильність до утворення пухлин через регуляцію HDAC4[10].
Крім того, надекспресія miR-206 і miR-29 придушувала експресію HDAC4 на рівні трансляції як за присутності, так і за відсутності трансформуючого фактору росту-бета (TGF-β) через взаємодію з 3'-UTR HDAC4. Експресія miR-206 і miR-29, задіяних у диференціації клітин м'язів, негативно регулюється TGF-β, тому обробка міогенних клітин TGF-β викликає підвищену експресію HDAC4. miR-29b виступає ключовим регулятором диференціювання в остеобласти, діючи на білки HDAC4, TGF-β3, ACVR2A, CTNNBIP1 і DUSP2. miR-140, специфічна для хрящової тканини, безпосередньо діє на 3'-UTR HDAC4. Миші, позбавлені miR-140, мають карликовий фенотип через порушення розвитку хондроцитів. miR-365, яка активується при механічному впливі, пов'язана з модуляцією диференціювання хондроцитів, діючи безпосередньо на HDAC4. У трансгенних мишей, що мають людську miR-155, miR-155 діє на HDAC4 і порушує регуляцію транскрипції гена B-клітинної лімфоми 6 в В-клітинах. Штучно посилена експресія HDAC4 в людських клітинах В-клітинної лімфоми зменшувала индуковану miR-155 проліферацію і посилювала апоптоз. Все це свідчить про важливу роль мікроРНК, які специфічно діють на HDAC4, в модуляції клітинної відповіді та біологічних функцій клітин різних типів у відповідь на різні стимули[10].
Структура
Структура доменів

| Детальний вигляд білок-білкових взаємодій у тетрамері HDAC4 | |
Людський ген HDAC4 кодує білки завдовжки від 972 до 1084 амінокислотних залишків, а мишачий гомолог Hdac4 — від 965 до 1076 амінокислотних залишків. HDAC4 містить унікальний регуляторний домен на N-кінці, який взаємодіє з різними транскрипційними факторами, а цинк-містить каталітичний домен на С-кінці. Аналіз кристалічної структури показує, що правильно фолдований (укладений) цинк-зв'язувальний домен необхідний для формування репресорного комплексу. N-кінцева ділянка мономеру HDAC4 консервативна і містить збагачений глутаміном домен (19 залишків глутаміну з 68), який укладається в пряму альфа-спіраль, що бере участь в збірці тетрамеру гістондеацетилази 4. Тетрамер HDAC4 не має регулярно розташованих неполярних амінокислотних залишків і протяжного гідрофобного кору. Натомість взаємодія між субодиницями забезпечується безліччю гідрофобних острівців, розташованих усередині ділянок з полярними амінокислотними залишками, а глутамін-збагачені ділянки беруть участь у згортанні альфа-спіралей мономерів та їх взаємодії один з одним[12]. С-кінцевий цинк-зв'язувальний домен відіграє ключову роль у розпізнаванні субстрату і зв'язування HDAC4 з репресорним комплексом HDAC3-NCoR. Детальний аналіз кристалічної структури показав, що між цистеїном 669, розташованим у цинк-зв'язувальному домені, і цистеїном 700 сусідньої молекули може формуватися міжмолекулярний дисульфідний зв'язок[10].
Посттрансляційні модифікації
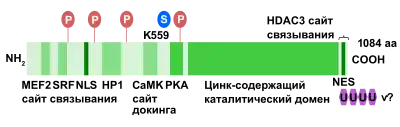
Посттрансляційні модифікації HDAC4 можуть змінювати його внутрішньоклітинну локалізацію і склад білків, які з ним взаємодіють. Добре відомо, що однією з ключових функцій HDAC4 є репресія транскрипції генів-мішеней через регуляцію конденсації і структури хроматину. Нещодавні дослідження показали критичну роль посттрасляційних модифікацій у контролі клітинних відповідей, у яких задіяна HDAC4. Показано, що HDAC4 може фосфорилюватися, сумоїлюватися, карбонілюватися, убиквітинуватися і розрізатися під дією різних ферментів[10].
Фосфорилювання
Фосфорилювання/дефосфорилювання забезпечує швидку і ефективну репресію гістондеацетилаз (HDAC) класу ІІа, до якого належить і HDAC4. Оборотне фосфорилювання — регуляторний механізм, необхідний для функціювання HDAC4. HDAC4 взаємодіє з сімейством білків 14-3-3, які специфічно зв'язуються з фосфосерин-містними консервативними мотивами. Фосфорилювання цих залишків серину створює сайти зв'язування з шапероном сімейства 14-3-3, який супроводжує фосфорильовану HDAC4 при транспорті з ядра в цитоплазму. HDAC4 може фосфорилюватися такими білками: CaMK, ERK1/2, протеїнкіназа А (РКА) і GSK3[10].
Стимуляція CaMK запускає міогенез шляхом руйнування комплексів MEF2-HDAC і подальшого експорту HDAC з ядра. CaMKII специфічно зв'язується з HDAC4 через унікальний сайт докінгу. Фосфорилювання HDAC4 за залишками серину S246, S467 і S632 за допомогою CaMKII посилює ядерний експорт і запобігає ядерному імпортові HDAC4 з подальшою репресією генів-мішеней HDAC4. Передача сигналу через ендогенний CaMKII необхідна для індукованого агоністом накопичення HDAC4 в цитозолі кардіоміоцитів. Однак РКА фосфорилює HDAC4 і регулює протеоліз HDAC4 за залишком тирозину 207, а також виступає антагоністом CaMKII-опосередкованої активації MEF2 шляхом регулювання протеолізу HDAC4. Продукт розрізання HDAC4, що включає в себе N-кінець колишнього білка, селективно інгібує активність MEF2, але не SRF, виступаючи антагоністом CaMKII, але не впливаючи на виживання кардіоміоциту. Активація сигнального шляху Ras-MAPK при експресії онкогенного білку Ras або у разі конститутивно активної MAPK/ERK-кінази 1 викликає накопичення HDAC4 в ядрі міобластів. GSK3 може фосфорилювати HDAC4 за позиціями 298 та 302, що призводить до руйнування HDAC4 протеасомами; таким чином, цей білок слугує важливим регулятором стабільності HDAC4[10].
Аналогічним чином, важливу роль у регуляції HDAC4 відіграють дефосфорилювальні ферменти — протеїнфосфатази. В умовах in vitro HDAC4 дефосфорилюється PP2A, яка спочатку взаємодіє з N-кінцем HDAC4, а потім дефосфорилює її. Регулюючи дефосфорилювання HDAC4 за кількома залишками серину, зокрема і тими, які входять в сайт зв'язування з білками 14-3-3, а також залишком серину 298, PP2A контролює ядерний імпорт HDAC4[10].
Карбонілювання
Карбонілювання, або алкілування, — характерна посттрансляційна модифікація в клітинах, які зазнали окислювального стресу. Карбонілюванням називається ковалентне приєднання активної карбонільної групи до тіольної групи залишків цистеїну в білкові-субстраті. У відповідь на стимули, що індукують утворення активних форм кисню в клітині, в білку DnaJb5 залишки цистеїну 274 і 276, а в HDAC4 — 667 та 669 окислюються і формують внутрішньомолекулярні дисульфідні зв'язки, які потім можуть бути відновлені тіоредоксином-1. Відновлення залишків цистеїну 274 і 276 білку DnaJb5 необхідне для взаємодії DnaJb5 і HDAC4, а відновлення залишків цистеїну 667 та 669 HDAC4 пригнічує її ядерний експорт незалежно від ступеню фосфорильованості[10].
Сумоїлювання
Сумоїлювання — це ковалентне приєднання білків групи SUMO до залишків лізину білку. Як і при убіквітинуванні, приєднання білків SUMO (SUMO1, SUMO2 і SUMO3) до залишків лізину в білках-субстратах відіграє критичну роль у модуляції активності та руйнування цих білків. Показано, що HDAC4 розпізнається SUMO1 за єдиним залишком лізину (лізин-559), за яким і відбувається сумоїлювання. Воно здійснюється E3 SUMO-протеїнлігазою RANBP2 і не впливає на внутрішньоклітинний розподіл HDAC4, а також на його взаємодію з деякими з білків, з якими вона взаємодіє. Однак HDAC4 з мутацією в позиції 559 значно гірше функціонує і здійснює репресію транскрипції генів-мішеней порівняно з диким типом. Сумоїлювання HDAC4 перешкоджає її фосфорилювання CaMK4[10].
Убіквітинювання
Зазвичай поліубіквітинювання направляє білки на деградацію протеасомами, тоді як моноубіквитинювання може мати різні біологічні ефекти. Убіквітинювання і протеасомне руйнування HDAC4 регулюється шляхом фосфорилювання GSK3β, однак механізм та біологічне значення убіквітинювання HDAC4 ще не з'ясовані[10].
Протеоліз
Переміщення HDAC4 між ядром і цитоплазмою також перебуває під впливом протеолізу, який відбувається в процесі апоптозу. HDAC4 розрізається каспазою-2 і -3 за залишком аспартату 289. N-кінцевий фрагмент HDAC4, відрізуваний каспазами, містить сигнал ядерної локалізації і накопичується в ядрі, репресуючи транскрипцію і викликаючи загибель клітини, а також виступаючи сильним репресором MEF2C. Порівняно з іншими ядерними формами HDAC4, ядерний фрагмент, відрізуваний каспазами, викликає загибель клітини і справляє потужну придушувальну дію на Runx2- або SRF-залежну транскрипцію, попри те що не містить С-кінцевого цинк-зв'язувального домену, необхідного для розпізнавання субстрату і зв'язування з корепресорним комплексом HDAC3-N-CoR. Створюваний каспазами фрагмент слабко зв'язується з хроматином, тоді як HDAC4, яка мутантна за сайтом зв'язування 14-3-3, формує стабільніші комплекси з білком HDAC5[10].
Дія на клітинному рівні
Гістони відіграють вкрай важливішу роль у регуляції експресії генів. Ацетилювання/деацетилювання гістонів змінює структуру хроматину і впливає на доступ факторів транскрипції до ДНК. HDAC4 належить до класу II сімейства гістондезацетилаз/acuc/apha. Він володіє активністю гістондеацетилази і пригнічує транскрипцію, зв'язуючись з промотором. Цей білок не пов'язує ДНК безпосередньо, а лише за допомогою транскрипційних факторів MEF2C і MEF2D. Як і для всіх гістондеацетилаз, для роботи HDAC4 необхідні іони Zn2+[9][13].
Як розглянуто вище, експресія гену HDAC4 може регулюватися на транскрипційному і посттранскрипційному (за допомогою мікроРНК і регуляції стабільності мРНК) рівнях, а також на рівні стабільності білка (руйнування протеазами). HDAC4 переміщується між ядром і цитоплазмою, а також виступає як ядерний корепресор, що регулює розвиток кісток і м'язів. Активність HDAC4 регулюється за допомогою двох основних механізмів: внутрішньоклітинної локалізації і утворення багатобілкових комплексів з іншими білками[10].
Внутрішньоклітинний розподіл
Як обговорювалося вище, переміщення HDAC4 між ядром і цитоплазмою може регулюватися за допомогою посттрансляційних модифікацій. Транслокація HDAC4 також регулюється через взаємодію з транспортним фактором експортином 1, також відомим як CRM1, який управляє експортом з ядра клітинних білків, що мають збагачений лейцином сигнал ядерного експорту (NES). Крім того, Нуклеопорин 155 (Nup155), головний компонент ядерного порового комплексу (NPC), задіяний у переміщенні білків між цитоплазмою та ядром. Вважається, що HDAC4 функціонує як корепресор транскрипції, деацетилюючи нуклеосомні гістони. Оскільки деацетилази гістонів не взаємодіють безпосередньо з ДНК, станом на 2017 рік вважають, що їх залучення до специфічних промоторів забезпечують ДНК-зв'язувальні білки, які розпізнають певні послідовності нуклеотидів у ДНК. HDAC4 також взаємодіє з різними білками, наприклад, НР1, гістонметилтрансферазою, різними транскрипційними факторами, що визначають функції цього білка в різних тканинах (список білків, з якими взаємодіє HDAC4, див. нижче). Є безліч доказів того, що гістондеацетилази, і HDAC4 зокрема, деацетилюють не лише гістони, але й інші білки, зокрема різні транскрипційні фактори, що може служити регуляторним механізмом біологічних сигнальних шляхів. Цитоплазматичні функції HDAC4 добре вивчені і висвітлюються нижче[10].
Регуляція деацетилювання гістонів
HDAC4 здійснює деацетилювання як гістонових, так і негістонових білків шляхом видалення з субстратів ацетильних груп цинк-містним каталітичним доменом. Оборотне ацетилювання за N-кінцевими лізиновими залишками гістону 3 (позиції 9, 14, 18 і 23) і гістону 4 (позиції 5, 8, 12 і 16) викликає деконденсацію нуклеосом, змінює взаємодію гістонів з ДНК і збільшує доступність ДНК для транскрипційних факторів. Стан ацетильованості гістонів управляється двома групами білків протилежної дії: гістонацетилтрансферазами (НАТ), ацетилювальними гістонами, і гістондеацетилазами, які здійснюють їх деацетилювання. На відміну від HDAC6, HDAC4 і HDAC5 взаємодіють з HDAC3 і RbAp48. Каталітичний домен HDAC схильний до утворення багатобілкового комплексу з корепресорним комплексом SMRT-NCoR-HDAC3. Цілісність каталітичного домену HDAC4 необхідна для залучення корепресорного комплексу HDAC3-N-CoR і його подальшої деацетилазної активності. Як деацетилаза HDAC4 не активна за відсутності зв'язування з HDAC3[10].
Регуляція деацетилювання негістонових білків
Білок Runx2 слугує головною мішенню сигнального шляху BMP. Сигнальний шлях BMP-2 стимулює ацетилювання Runx2, опосередковане р300. Ця модифікація збільшує активність Runx2 та інгібує Smurf1-опосередковану деградацію Runx2. HDAC4 і HDAC5 деацетилюють Runx2, дозволяючи цього білку піддатися Smurf-опосередкованому руйнуванню. Інгібування HDAC збільшує ацетилювання Runx2, посилює диференціацію остеобластів, стимульовану сигнальним шляхом BMP-2, і збільшує утворення кісток. Нещодавні дослідження показали, що HDAC4 може деацетилювати такі цитоплазматичні білки, як HIF-1α, MEKK2 і STAT1[10].
Деметилювання гістонів
Ацетилювання і метилювання гістонів — найбільш повно вивчені епігенетичні мітки. Триметилювання за позиціями H3K4, H3K36 або H3K79 призводить до того, що хроматин набуває активної форми, характерної для еухроматину. Еухроматин також характеризується високим ступенем ацетилювання гістонів. Тому HDAC можуть прибирати епігенетичні мітки, репресуючи транскрипцію. Метильований H3K9 створює сайт зв'язування для хромодомен-вмісного білку HP1, який індукує репресію транскрипції й перехід еухроматину в гетерохроматин. HDAC4 бере участь в епігенетичній регуляції генів через взаємодію з H3K9-метилтрансферазою SUV39H1 і HP1, забезпечуючи ефективний механізм сайленсингу генів-мішеней MEF2 шляхом здійснення і деацетилювання, і метилювання. Деметилювання H3K9 тісно пов'язане з переміщенням HDAC4 між цитоплазмою та ядром. Особливо значне триметилювання H3K9 в умовах стресу в промоторі 5'-ацетилхолінестерази (AChE), і накопичення такої гістонової мітки асоціюють з рекрутуванням SUV39H1 і HP1 на промотор AChE[10].
Крім того, HDAC4 негативно регулює транскрипційний фактор MEF2 через взаємодію з SUMO Е2-кон'югувальним ферментом Ubc9. Надекспресія HDAC4 призводила до надмірного сумоїлювання MEF2 в умовах in vivo. HDAC4 стимулює сумоїлювання MEF2 з того ж залишку лізину, який ацетилює коактиватор MEF2, ацетилтрансфераза CREBBP, тож, можливо, ацетилювання і сумоїлювання MEF2 взаємодіють при регуляції його активності. Втім, ця модель є предметом суперечок, і необхідні додаткові експерименти, щоб з'ясувати, чи сумоїлює HDAC4 MEF2 безпосередньо чи залучає для цього SUMO E2-кон'югувальний фермент[10].
Фізіологічні функції
HDAC4 виконує вкрай важливі функції в регуляції транскрипції генів, зростанні клітин, проліферації та виживанні, тому порушення в експресії або роботі цього білку призводять до розвитку раку[10].
Кісткова і хрящова тканини
HDAC4, яка експресується в прегіпертофічних хондроцитах, регулює гіпертрофію хондроцитів і ендоклональне утворення кісток, взаємодіючи з та інгібуючи активність Runx2 — транскрипційного фактору, необхідного для гіпертрофії хондроцитів. У мишей, нокаутних за HDAC4, спостерігається передчасне окостеніння кісток, що розвиваються, через передчасну ектопічну гіпертрофію хондроцитів; схожий фенотип проявляється в особин, у хондроцитах яких Runx2 експресується постійно. Runx2 може ацетилюватися білком р300, і ацетильована форма Runx2 запобігає убіквітинюванню білків. HDAC4 і HDAC5 відіграють протилежні ролі, деацетилюючи Runx2 і дозволяючи білкам руйнуватися Smurf-залежним шляхом. TGF-β пригнічує диференціювання остеобластів, діючи на HDAC4 і HDAC5, які в остеобластах, що диференціюються, через взаємодію з Smad3 рекрутуються в комплекс Smad3/Runx2, розташований на послідовності ДНК, яка зв'язується з Runx2. Надекспресія HDAC4 стимулює TGF-β1-індукований хондрогенез у стовбурових клітинах синовіального шару, проте пригнічує гіпертрофію в хондроцитах, які диференціювалися з них[10].
М'язова тканина
Перша стадія міогенезу включає формування міобластів, які експресують особливий набір транскрипційних факторів, зокрема MEF2C. У мишей, позбавлених MEF2C, спостерігаються порушення в морфогенезі серця, і на стадії утворення петлі в розвитку серця розвиток організму припиняється. HDAC4 зв'язується безпосередньо з MEF2, інгібуючи його функціонування, і регулює диференціацію клітин мезодерми в кардіоміобласти, пригнічуючи експресію GATA4 і Nkx2-5. Обробка інгібіторами HDAC викликає специфікацію клітин мезодерми в майбутні кардіоміоцити, про що можна судити з підвищення вмісту в них транскриптів Nkx2-5, MEF2C, GATA4 і серцевого α-актину. Таким чином, HDAC пригнічують диференціювання мезодермальних клітин у кардіоміоцити. Надекспресія HDAC4 пригнічує кардіоміогенез, про що свідчить зниження рівня експресії генів, що відповідають за розвиток кардіоміоцитів[10].
Показано, що при диференціюванні м'язових клітин HDAC4 управляє репресією генів, рекрутуючи MEF2 до промоторів репресованих генів. Репресія транскрипції генів MEF-2/HDAC-комплексом обумовлена CaMK-індукованою транслокацією HDAC4 і HDAC5 в цитоплазму. У серцях трансгенних мишей з надекспресією активного CAMK4 спостерігалася гіпертрофія серця з підвищенням вмісту деяких ембріональних транскриптів, наприклад, передсердного натрійуретичного фактору, і значне підвищення активності MEF2C[10].
Усі скорочення скелетної мускулатури контролюється нервовою системою. HDAC4 в нормі накопичується в області нервово-м'язових синапсів. Втрата іннервації викликає супутнє накопичення HDAC4 в ядрі м'язової клітини і зменшення експресії генів, регульованих MEF2. При хірургічній іннервації або у разі нервовом'язового захворювання бічного аміотрофічного склерозу підвищений рівень HDAC4 необхідний для ефективної репресії MEF2-залежних структурних генів. Посилена експресія HDAC4 викликає ефект, схожий з ефектом денервації, і активує транскрипцію ектопічного ацетилхолінового рецептора (nAChR) уздовж усього м'язового волокна. Інактивація HDAC4 запобігає індукованій денервацією транскрипції синаптичних рецепторів nAChR і MUSK. Особливо багато HDAC4 міститься в ядрах швидких окислювальних скелетних м'язових волокон, і нокаут HDAC4 посилює гліколіз у м'язових трубочках[10].
Нервова система
HDAC4 міститься в навколоядерній області цитоплазми більшості нейронів, проте його локалізація в ядрі варіює. В зубчастій звивині ядерної експресії HDAC4 не спостерігається, тоді як в ядрах нейронів інших зон містять HDAC4. У нормі HDAC4 локалізується в цитоплазмі нейронів головного мозку та вирощених у культурі гранулярних нейронів мозочка. HDAC4 швидко переноситься в ядро у відповідь на низький рівень калію і небезпечний рівень глутамату, які індукують смерть нейрона. Обробка фактором виживання нейронів BDNF перешкоджає ядерній локалізації HDAC4, тоді як інгібітор CaMK, який стимулює апоптоз, сприяє накопиченню HDAC4 в ядрі. Більш того, ектопічна експресія локалізованого в ядрі HDAC4 стимулює апоптоз нейронів і пригнічує функціонування як факторів транскрипції білків MEF2 і CREB. Гістондеацетилази відіграють важливу роль у виживанні нейронів і розвитку фоторецепторів. Транскрипційний комплекс MEF2-HDAC4 бере участь у виживанні нейронів і є мішенню атаксину-1. Внутрішньоклітинна локалізація HDAC визначається активністю нейрону. Спонтанна електрична активність необхідна для ядерного експорту HDAC4, але не HDAC5[10].
Підшлункова залоза
Показано, що HDAC4, HDAC5 і HDAC9 (клас IIa HDAC) виявляють несподівано обмежену експресію ендокринних β- і δ-клітин підшлункової залози. Ці HDAC виступають ключовими регуляторами β/δ-клітин підшлункової залози. Аналіз мишей, мутантних за HDAC класу IIa, показав, що кількість інсулін-продукувальних β-клітин підвищена у мишей, нокаутних за HDAC5 і HDAC9, а у нокаутних за HDAC4 і HDAC5 — соматостатин-продукувальних δ-клітин. Надекспресія HDAC4 і HDAC5 призводила до зниження кількості β - і δ-клітин[10].
Клінічне значення
Серцево-судинні захворювання
Гіпертрофія серця — це відповідь серця на різні зовнішні і внутрішні стимули, які призводять до біомеханічного стресу. Багато серцево-судинних захворювань, зокрема інфаркт міокарда, артеріальна гіпертензія і різні зміни в скоротливості серця, обумовлені мутаціями саркомерних білків, причому ці мутації змушують доросле серце збільшуватися в розмірах через гіпертрофічне зростання кардіоміоцитів. У кардіоміоцитах CaMKII-залежне фосфорилювання HDAC4 призводить до гіпертрофічного зростання, яке може блокуватися якщо HDAC4 не сприймає будь-які сигнали. Дослідження мишей, позбавлених miR-22, показали, що miR-22 необхідна для гіпертрофічного розростання серця у відповідь на стрес і безпосередніми мішенями цієї мікроРНК є HDAC4 і Sirt1[10].
Крім того, HDAC4 бере участь у регуляції скорочення міофіламентів через регуляцію деацетилювання MLP. HDAC4, HAT і p300/CREBBP-асоційований фактор (PCAF) пов'язані з серцевими міофіламентами. HDAC4 і PCAF пов'язані з Z-дисками і I - A-смугами серцевих саркомерів. MLP, білок, асоційований з Z-дисками, функціонує як сенсор механічного натягу серця, і в ацетильованому вигляді є мішенню HDAC4 і PCAF[10].
Неврологічні захворювання
Хвороба Гантінгтона (HD) — це нейродегенеративне генетичне захворювання, при якому порушується координація м'язових скорочень, виникають когнітивні розлади і психіатричні проблеми. Показано, що у разі HD miR-22 може мати різнобічний антинейродегенеративний ефект, що включає в себе інгібування апоптозу і вплив на гени (зокрема HDAC4, RCOR1 і Rgs2), задіяних у розвитку HD[10].
Недостатня експресія HDAC4 під час розвитку сітківки призводить до апоптозу паличок і біполярних інтернейронів (BP), тоді як надекспресія знижує порівняно з нормою кількість BP-клітин, що гинуть. Крім того, у мишей з дегенерувальною сітківкою надекспресія HDAC4 подовжувала тривалість життя фоторецепторів. Ефект виживання був обумовлений активністю HDAC4 в цитоплазмі[10].
Дефекти HDAC4 можуть бути причиною синдрому брахідактилії з відставанням розумового розвитку. Фізичні прояви цього синдрому нагадують схожі прояви спадкової остеодистрофії Олбрайта. Серед цих симптомів — помірні лицьові порушення, вроджені вади серця, брахідактілія типу Е, розумова відсталість, відставання в розвитку, епілептичні напади, розлади аутистичного спектру, кремезна статура. Після вивчення 278 пацієнтів з шизофренією і контрольних здорових 234 людей з корейської популяції аналіз однонуклеотидних поліморфізмів показав, що ген HDAC4 пов'язаний з розвитком шизофренії. Атаксія телеангіектазія — це нейродегенеративне захворювання, обумовлене мутацією в гені Atm. У мишей, дефектних за цим геном, накопичення HDAC4 в ядрі призводило до нейродегенерації[10].
Рак
У деяких випадках гострих лейкозів хромосомна транслокація, що приводить до злиття гену PLZF, який кодує білок PLZF, з геном, який кодує рецептор ретиноєвої кислоти RARα, дає початок химерному білкові PLZF-RARα, який, як вважають, здійснює конститутивну репресію генів, відповідальних за диференціацію. Встановлено, що HDAC4 взаємодіє з лейкозним білком PLZF-RARα і управляє репресією генів диференціювання в лейкозних клітинах. Пригнічення активності HDAC інгібіторами HDAC в клінічних і фундаментальних дослідженнях показало потенційну користь HDAC у лікуванні раку. Білок BCL6 відповідає за виживання і/або диференціювання при В-клітинній лімфомі, яка виникає через хромосомні перебудови. HDAC4 зв'язується з BCL6 і PLZF in vivo та in vitro і через них керує репресією транскрипції. Показано, що мікроРНК miR-155, надекспресія якої найчастіше спостерігається при злоякісних пухлинах і гематологічних захворюваннях, може безпосередньо зв'язуватися з 3'-UTR HDAC4 і пригнічувати її трансляцію. Ектопічна експресія HDAC4 в клітинах В-клітинної лімфоми людини приводила до зниження miR-155-індукованої проліферації та посилення апоптозу[10].
Найбільша експресія HDAC4 спостерігається в проліферативній частині нормального епітелію тонкої та товстої кишки, і при диференціюванні її експресія знижується. HDAC4 взаємодіє з Sp1 і прибирає ацетильні групи з гістону Н3 в сайті зв'язування Sp1/Sp3 на проксимальному промоторі білку р21, репресуючи транскрипцію. Індукція цього промотору шляхом сайленсингу HDAC4 зупиняла ріст ракових клітин і пригнічувала ріст пухлини в моделі людської гліобластоми. Х-пов'язаний супресор пухлин FOXP3 необхідний для експресії р21 у нормальному епітелії, і недолік FOXP3 призводить до негативної регуляції р21, що відбувається в деяких випадках раку молочної залози. FOXP3 специфічно інгібується при зв'язуванні HDAC4 і локальному збільшенні ацетилювання гістону Н3. При гепатоцелюлярній карциномі HDAC4 безпосередньо регулюється miR-22. Більш того, в тканині гепатоцелюлярної карциноми при негативному регулюванні miR-22 рівень HDAC4 підвищувався. Крім того, в клітинах цієї пухлини HDAC4 є також мішенню miR-200a[10].
При раку яєчника нерідко спостерігається стійкість до платинової хіміотерапії, причому показано, що в стійких пухлинах спостерігається підвищена експресія HDAC4. PLU-1/JARID1B, експресія якого підвищується в деяких випадках раку молочної залози, взаємодіє з HDAC4 і експресується спільно з ним в ракових клітинах цього типу. Показано, що в зразках тканини здорового сечового міхура для HDAC4-позитивних зразків була значно нижчою, ніж у зразках пухлини сечового міхура. Крім того, вміст HDAC4 при перехідних карциномах сечового міхура значно вищий, ніж у нормальних тканинах. HIF1α — необхідна частина транскрипційного комплексу HIF-1, який регулює ангіогенез, клітинний метаболізм і може відповідати за розвиток раку. Ацетилування HIF1α позитивно регулюється кшРНК HDAC4, але не ѕһРНК HDAC1 або HDAC3. Інгібування HDAC4 знижує і транскрипційну активність HIF-1, і експресію низки генів-мішеней HIF-1, а також зменшує стійкість до хіміотерапії із застосуванням доцетакселу. Встановлено, що HDAC4 може бути задіяна у розвитку остеосаркоми і раку товстої кишки. Тасхінімод, препарат, призначений для лікування стійкої до видалення пухлини передміхурової залози, безпосередньо зв'язується з HDAC4, тим самим інгібуючи деацетилювання гістонів і транскрипційні фактори, що залежать від HDAC4, наприклад, HIF-1α[10].
Інгібітори

На сьогодні відомо багато інгібіторів гістондеацетилаз, які належать до різних груп сполук. Серед них є гідроксамати (трихостатин А, вориностат), циклічні пептиди (ромідепсин, апіцидін), аліфатичні кислоти (бутират, фенілбутират, вальпроєва кислота), бензамід та його похідні. Перераховані інгібітори неспецифічні і пригнічують роботу всіх HDAC, а не лише HDAC4. Їх застосування може виявитися перспективним при лікуванні різних ракових захворювань[14]. Відомі й специфічні інгібітори HDAC4, зокрема, похідні трифлуорометил-1,2,4-оксидазолу. Ці сполуки можуть виявитися ефективними при лікуванні хвороби Гантінгтона, м'язової атрофії та діабету[15].
Взаємодії з іншими білками
HDAC4, як було виявлено, взаємодіє з:
| Білок | Коментар | Джерела |
|---|---|---|
| BCL6 | Може зв'язуватися не лише з HDAC4, але й з іншими спорідненими HDAC класу IIa: HDAC5 і HDAC7 | [16] |
| BTG2 | Може також зв'язуватися з HDAC1 | [17] |
| GATA1 | HDAC інгібують цей білок. Також він взаємодіє з HDAC3 і HDAC5 | [18] |
| HDAC3 | Разом входять до складу репресорного комплексу HDAC3-NCoR | [19][20] |
| MAPK1 | Локалізація HDAC4 залежить від сигнального шляху Ras-MAPK | |
| MAPK3 | Локалізація HDAC4 залежить від сигнального шляху Ras-MAPK | [21] |
| MEF2C | Інгібується HDAC4 | [22] |
| MEF2A | Інгібується HDAC4 | [23] |
| NCOR1 | Разом входять до складу репресорного комплексу HDAC3-NCoR | [24][25] |
| NCOR2 | Разом входять до складу репресорного комплексу HDAC3-NCoR |
Див. також
Примітки
- Захворювання, генетично пов'язані з HDAC4 переглянути/редагувати посилання на ВікіДаних.
- Сполуки, які фізично взаємодіють з HDAC4 переглянути/редагувати посилання на ВікіДаних.
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- PMID 10220385 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10206986 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - HUGO Gene Nomenclature Commitee, HGNC:14063 (англ.). Процитовано 28 серпня 2017.
- UniProt, P56524 (англ.). Процитовано 28 серпня 2017.
- GeneCards: HDAC4.
- PMID 24579951 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - HDAC4 histone deacetylase 4 [ Homo sapiens (human) ].
- PMID 17360518 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - Entrez Gene: HDAC4 histone deacetylase 4.
- PMID 17951399 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 24900734 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 11929873 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 17371797 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 14668799 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10869435 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 11466315 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 11114188 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10487761 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10748098 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 11804585 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10640275 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота.
Література
- Grozinger C.M., Hassig C.A., Schreiber S.L. (1999). Three proteins define a class of human histone deacetylases related to yeast Hda1p.. Proc. Natl. Acad. Sci. U.S.A. 96: 4868 — 4873. PubMed DOI:10.1073/pnas.96.9.4868
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- McKinsey T.A., Zhang C.-L., Olson E.N. (2001). Identification of a signal-responsive nuclear export sequence in class II histone deacetylases.. Mol. Cell. Biol. 21: 6312 — 6321. PubMed DOI:10.1128/MCB.21.18.6312-6321.2001
- Franco P.J., Farooqui M., Seto E., Wei L.-N. (2001). The orphan nuclear receptor TR2 interacts directly with both class I and class II histone deacetylases.. Mol. Endocrinol. 15: 1318 — 1328. PubMed DOI:10.1210/mend.15.8.0682
- Little G.H., Bai Y., Williams T., Poizat C. (2007). Nuclear calcium/calmodulin-dependent protein kinase IIdelta preferentially transmits signals to histone deacetylase 4 in cardiac cells.. J. Biol. Chem. 282: 7219 — 7231. PubMed DOI:10.1074/jbc.M604281200
- Wheeler P.G., Huang D., Dai Z. (2014). Haploinsufficiency of HDAC4 does not cause intellectual disability in all affected individuals.. Am. J. Med. Genet. A 164A: 1826 — 1829. PubMed DOI:10.1002/ajmg.a.36542
- PMID 12711221 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10487761 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10523670 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10825153 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10869435 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 10958686 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 11022042 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 11081517 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 11114188 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 11114197 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота.